- 2021-05-26 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考理综卷Ⅰ化学题分析
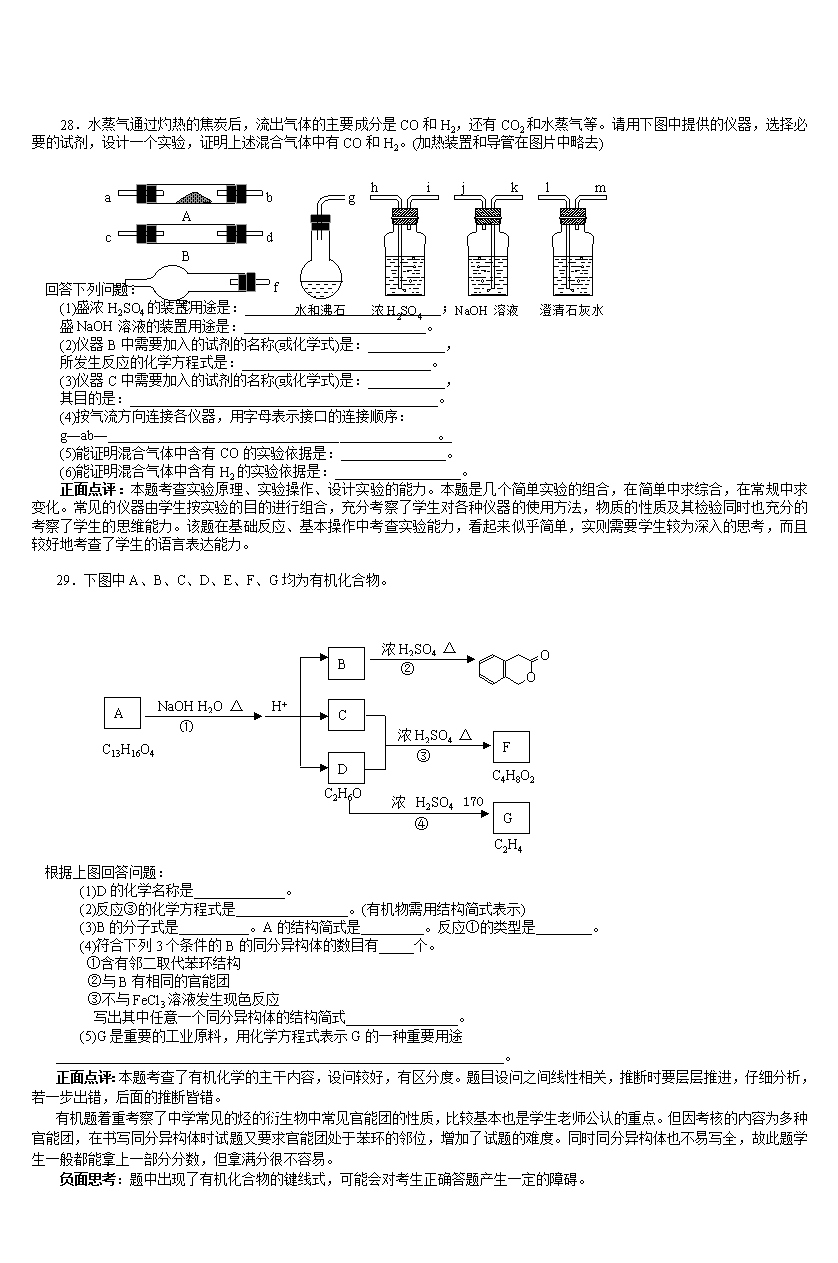
2007年高考理综卷(Ⅰ)化学题分析 浙江省丽水中学杨广斌 323000 6.下列有关环境问题的说法正确的是 A.燃煤时加入适量石灰石,可减少废气中SO2的量 B.臭氧的体积分数超过10-4%的空气有利于人体健康 C.pH在5.6~7.0之间的降水通常称为酸雨 D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 正面点评:本题不以纯化学知识为中心进行编制,而以当今人类关心的环境问题为背景,考查一些化学基础内容:SO2尾气的吸收、O3与人的健康、酸雨与PH、含磷合成洗涤剂与水污染。让考生在解题过程中感受化学是一门中心学科,是一门实用的学科,学习化学不仅是为了考试拿高分,更为了改善人居环境,创造美好的生活。 负面思考:本题目主要考查考生对化学与环境问题的相互联系的了解程度,属于较易题目。但要识记的知识点多,取材并不怎么鲜活,而且过于集中,值得斟酌! 7.室温时,下列混合溶液的pH一定小于7的是 A.pH=3的盐酸和pH=11的氨水等体积混合 B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 D.pH=3的硫酸和pH=11的氨水等体积混合 正面点评:本题考查化学主干知识——强弱酸碱的概念及中和反应、弱电解质电离平衡及水溶液的pH的定性判断。掌握适当的化学基础知识,是提高公民科学素养的必经途径。 负面思考:D对A,有一定的干扰性,但是题目若设置等物质的量浓度的一元酸碱混合,就可以把水解知识也牵扯进来,内容会更充实,对主干知识的考查就更充分。 8.以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量为 A.0.64 g B.1.28 g C.2.56 g D.5.12 g 正面点评:本题主要考查了关于电解的定量计算——以惰性电极电解CuSO4溶液。守恒思想是化学学科的主干思想,以CuSO4溶液电解为情景进行考查,是一个比较简单的切入途径。这是名副其实的送分能送到手的送分题。 负面思考:无。 9.在三个密闭的容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是 A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2) C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2) 正面点评:本题主要考查气体密度、相对分子质量及压强之间的关系。要解答本题,需要深层次理解阿伏加德罗定律的实质,能力要求很高。 负面思考:根据气体定律pV=nRT=mRT/M,变形为pM=ρRT。当它们的温度和密度都相同时,压强(p)与摩尔质量成反比。已知Ne、H2、O2的摩尔质量依次是20 g/mol、2 g/mol、32 g/mol,故压强(p)从大到小的顺序是p(H2)>p(Ne)>p(O2) 克拉伯珑方程不是中学学生所必须掌握的内容,这样命题,对广大考生公平与否,对中学教学又将产生怎样的影响,似乎都很有必要审慎为之。 10.已知氧化还原反应: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O 其中1 mol氧化剂在反应中得到的电子为 A.10 mol B.11 mol C.12 mol D.13 mol 正面点评:本题主要考查了氧化还原反应中氧化剂得电子的计算。 题目考查了物质中元素化合价的确定、归中规律,甚至还有防止化学计量数的干扰,有一定难度。 负面思考:无。 11.等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是 A.KClO3(加MnO2催化剂,加热) B.KMnO4(加热) C.H2O2(水溶液,加MnO2催化剂) D.HgO(加热) 正面点评:本题主要考查了氧化还原反应的简单计算。 【解析】依次写出四种物质分解反应的化学方程式,有 2KClO3=2KCl+3O2↑ 2KMnO4=K2MnO4+MnO2+O2↑ 2H2O2=2H2O+O2↑ 2HgO=2Hg+O2↑ 不难发现,等物质的量的上述四种化合物在相应条件下完全分解后得到氧气最多的是KClO3 负面思考:8、10、11三题连续就氧化还原命题,其中第8题侧重计算。考查学科思想、方法。第10题侧重考基本概念,本题侧重考查考生基本技能,看他们能不能熟练的书写化学方程式,注意避免思维定势。但是这样命题,能不被人质疑,似乎是不太可能的了。学科的主干知识、主干思想内涵丰富,非就一个主题如此大手笔吗? 12.某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为 A.4 B.5 C.6 D.7 正面点评:本题主要考查了有机物分子式的确定。 【解析】有机化合物相对分子质量小于150,又氧的质量分数为50% 故1个分子中,氧原子最多是4个,(16n<150×50%=75,n<5) 在题目这样的限制条件下,分子中碳原子的个数最多时,一定是不难发现氧原子数为4的时候。自然碳、氢的式量和也就为64,分子中碳原子的个数最多5,此时氢原子个数为4,对应的有机物为阿康酸(C5H4O4)。 负面思考:用这种形式考察有机知识,重在运用“讨论”的学科方法,确实回避了各地猜题的可能性,但是有的学生会对自己推断出来的C5H4O4产生怀疑,没有体现出合适的区分度,加之,这样命题,对今后执行有机化学——官能团化学的教学似乎不利。 13.右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是 A.反应达平衡时,正反应速率和逆反应速率相等 B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等 正面点评:本题主要考查了化学平衡图象的释读。首先是读图,图是反应速率与反应时间的关系图,且平衡态Ⅱ较平衡态Ⅰ正逆反应速率都增大。再看选项,并逐一分析,确定出答案。 负面思考:这样的平衡图象释读,是必要的,但选项设置得有点粗糙, A、D,特别是A没有嚼头,C几乎没有任何干扰的可能性,能不能把选项设计成与温度、压强或使用催化剂有关,毕竟学生在这些认识有差异,却得不到应有的区分。 26、W、X、Y和Z都是周期表中前20号元素,已知:` ①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物; ②Y和Z属同族元素,他们能形成两种常见的化合物; ③X和Z属同一周期元素,它们能形成两种气态化合物; ④W和X能形成组成为WX2的化合物; ⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。 请回答: (1)W元素是_____________;Z元素是__________。 (2)化合物WY和WX2的化学式分别是____________和___________。 (3)Y和Z形成的两种常见化和伍的分子式是__________和___________. (4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式______。 正面点评:考查原子结构和元素周期律、元素周期表知识。本题一改以往学生见到的“W、X、Y、Z原子序数依次增大”或“为短周期元素”,使题目不确定因素增多,显得灵活,思维容量增大。本题形式常见,却在常规中创新,由简单离子到复杂离子,由双原子分子到多原子分子,由无机物到有机物,全面考查学生对原子结构知识及元素化合物知识的熟悉程度。 27.A、B、C、D、E均为可溶于水的固体,组成它们的离子有 阳离子 Na+ Mg2+ Al3+ Ba2+ 阴离子 OHˉ Clˉ CO SO HSO 分别取它们的水溶液进行实验,结果如下: ①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液; ②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液; ③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸; ④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。 据此推断它们是 A____________;B__________;C_____________;D__________;E___________。 正面点评:本题考查元素化合物知识,是本卷中最难的试题,题型很新颖,它以给定的离子为切入点,通过物质间的变化、溶解性等考察学生对常见物质的掌握情况。此题只有经过缜密的逻辑思维,“烂熟”的化学知识,良好的心理素质,才能完全解答对试题,本题能充分考察学生的能力,是拉开学生分数的好题。 本题一改以往告诉物质的化学式为构成物质的离子,由反应现象确定各自的归属。本题的切入点是题中的现象④,并从后面向前逆推。本题也考查了学生对信息统摄能力,推断靠的是对信息的整体把握和综合把握,并把顺向推理与逆向推理结合起来。 负面思考:题中出现了NaHSO4溶液的性质、双水解等内容,可能会对考生正确答题产生一定的障碍。 28.a b A c d B e f C g 水和沸石 h i 浓H2SO4 j k NaOH溶液 l m 澄清石灰水 水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管在图片中略去) 回答下列问题: (1)盛浓H2SO4的装置用途是:____________________________; 盛NaOH溶液的装置用途是:__________________________。 (2)仪器B中需要加入的试剂的名称(或化学式)是:___________, 所发生反应的化学方程式是:___________________________。 (3)仪器C中需要加入的试剂的名称(或化学式)是:___________, 其目的是:____________________________________________。 (4)按气流方向连接各仪器,用字母表示接口的连接顺序: g―ab―_________________________________ 。 (5)能证明混合气体中含有CO的实验依据是:_______________。 (6)能证明混合气体中含有H2的实验依据是:__________________。 正面点评:本题考查实验原理、实验操作、设计实验的能力。本题是几个简单实验的组合,在简单中求综合,在常规中求变化。常见的仪器由学生按实验的目的进行组合,充分考察了学生对各种仪器的使用方法,物质的性质及其检验同时也充分的考察了学生的思维能力。该题在基础反应、基本操作中考查实验能力,看起来似乎简单,实则需要学生较为深入的思考,而且较好地考查了学生的语言表达能力。 29.下图中A、B、C、D、E、F、G均为有机化合物。 C2H6O A NaOH H2O △ ① H+ B 浓H2SO4 △ ② C D 浓H2SO4 △ ③ F C4H8O2 浓H2SO4 170℃ ④ G C2H4 C13H16O4 根据上图回答问题: (1)D的化学名称是_____________。 (2)反应③的化学方程式是________________。(有机物需用结构简式表示) (3)B的分子式是__________。A的结构简式是_________。反应①的类型是________。 (4)符合下列3个条件的B的同分异构体的数目有_____个。 ①含有邻二取代苯环结构 ②与B有相同的官能团 ③不与FeCl3溶液发生现色反应 写出其中任意一个同分异构体的结构简式________________。 (5)G是重要的工业原料,用化学方程式表示G的一种重要用途 ________________________________________________________________。 正面点评:本题考查了有机化学的主干内容,设问较好,有区分度。题目设问之间线性相关,推断时要层层推进,仔细分析,若一步出错,后面的推断皆错。 有机题着重考察了中学常见的烃的衍生物中常见官能团的性质,比较基本也是学生老师公认的重点。但因考核的内容为多种官能团,在书写同分异构体时试题又要求官能团处于苯环的邻位,增加了试题的难度。同时同分异构体也不易写全,故此题学生一般都能拿上一部分分数,但拿满分很不容易。 负面思考:题中出现了有机化合物的键线式,可能会对考生正确答题产生一定的障碍。 2007年理科综合能力测试山东卷 第6题 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是 A 再通入少量氯气,c(H+)/c(ClO-)减小 B 通入少量SO2,溶液漂白性增强 C 加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) D 加入少量水,水的电离平衡向正反应方向移动 点评: 氯气溶于水后存在如下平衡关系:Cl2+H2O H++Cl-+HClO A 再通入少量氯气后平衡向正反应方向移动,C(H+)增大,C(HClO)增大,因为HClO电离的程度很小,所以C(H+)/C(ClO-)减小的说法是不正确的。 B、 通入少量SO2,溶液漂白性增强的说法也是错误的。因为SO2与氯气在水中会发生氧化还原反应生成没有漂白性的物质,因此溶液的漂白性会降低。 C、 加入少量固体NaOH,一定有C(Na+)= C(Cl-)+ C(ClO-)的说法也是错误的。加入NaOH后HCl会转化为NaCl,HClO会转化为NaClO,但同时还要考虑到NaClO是弱酸强碱盐会发生水解反应,这样Cl-与ClO-浓度之和就不会与Na+浓度相等。 D、 加入少量水,相当于增大反应物的浓度平衡会向正反应方向移动,H+与水电离的OH-中和会使水的电离平衡也向正反应方向移动。D为正确选项。 该题主要考查有关化学平衡移动、氯水及次氯酸部分的核心知识内容,该题还具有迷惑性,SO2具有漂白性,氯水也具有漂白性,若不从平衡移动角度分析就很容易错选B;若忘记了NaClO会发生水解反应也会错选C。 2007年理科综合能力测试山东卷 第3题 下列说法正确的是 A 乙烯的结构简式可以表示为CH2CH2 B 苯、乙醇和乙酸都能发生取代反应 C 油脂都不能使溴的四氯化碳溶液褪色 D 液化石油气和天然气的主要成分都是甲烷 点评: A、乙稀的结构简式不能用CH2CH2表示,必须将碳碳双键画出才行,故A说法不正确。 B、苯、乙醇和乙酸都能发生取代反应,说法正确,B为正确选项。 C、油脂都不能使溴的四氯化碳溶液褪色的说法不正确。因为含有碳碳双键的不饱和高级脂肪甘油酯能使溴的四氯化碳溶液褪色。 D、 液化石油气和天然气的主要成分都是甲烷的说法错误。因为液化石油气的主要成分是丙烷和丁烷。 该题考查内容丰富,不仅四个选项包含了四个方面的核心知识内容,而且B选项本身就含有丰富内容。取代反应是一大类有机化学反应,羧酸的酯化反应,酯的水解反应,乙醇分子间脱水反应等都属于取代反应。 2007年理科综合能力测试山东卷 第8题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。 (1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。 正极反应 负投反应 。 (3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。 氢氧化物开始沉淀时的pH 氢氧化物沉淀完全时的pH Fe3+ Fe2+ Cu2+ 1.9 7.0 4.7 3.2 9.0 6.7 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu (4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀。 有关反应的化学方程式 劣质不锈钢腐蚀的实验现象 点评: FeCl3可用作印刷电路铜板腐蚀剂,即Fe3+将铜氧化成Cu2+的过程。 (1)2 Fe3++ Cu =2 Fe2++ Cu2+ (2)以FeCl3溶液和铜设计成原电池,铜必为失电子的负极,Cu-2e-Cu2+,电解质溶液中的Fe3+必然要在正极得电子变为Fe2+,2 Fe3++2e-2 Fe2+。 (3)除去CuCl2溶液中的Fe3+和Fe2+,必须将Fe2+氧化都变成Fe3+,氧化剂应选Cl2。调PH值使Fe3+沉淀完全应选加入CuO这样不会带入新的杂质,而且能收获更多CuCl2。调PH值一定要大于3.2并小于4.7以保证Fe(OH)3沉淀完全。最后过滤除去Fe(OH)3沉淀,便得到无杂质的CuCl2溶液。 (4)劣质不锈钢在酸中腐蚀缓慢,但在盐溶液中腐蚀现象明显。限定的盐要在表中提供的药品中选择,最佳选择应为CuO+H2SO4=Cu SO4+H2O,CuSO4+Fe=FeSO4+Cu,实验现象为不锈钢表面有紫色物质生成。 该题出法具有新意并具有一定的难度。若对原电池中发生的氧化还原反应本质认识不清就很难设计出以Cu作负极的原电池。对于除去CuCl2溶液中的Fe3+、Fe2+杂质,不仅要会看图表数据,还要会分析,才能做出正确解答。对于不锈钢的腐蚀也容易造成错选,如用Cu与浓H2SO4反应也能制出CuSO4,但忘记要求设计最佳实验就不能用Cu与浓H2SO4反应制CuSO4,因该反应会产生污染环境的SO2气体。用CuO与H2SO4反应制取CuSO4既有利于环境保护又能节约资源。 2007年理科综合能力测试山东卷 第9题 下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。 (1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氯化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产钧的现象是 。 (2)停止CO和CO2混合气体的通入,E内放置Na2O2按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。需要加热的仪器装置有 (填代号),m中反应的化学方程式为 。 (3)若气体入侵改造空气,分液漏斗内改变双氧水,内 NaOH 固体,E 内装置合金属,按A→G→E→D装置程序制取干燥氧气,并验证氧的某些性质。 ①装置A中能产生氨气的原因有: 。 ②实验中观察到E内有红棕色气体现出,证明氨气具有性。 点评: (1) 要获得纯净干燥的CO就必须用A中的NaOH溶液吸收CO2,并通过C中的澄清石灰水不变浑证明CO2已被完全吸收,再通过B浓硫酸干燥CO气体。CO通过E中加热的CuO被氧化成CO2,被C中澄清石灰水吸收变浑浊,证明CO还原性及氧化产物。所选装置的连接顺序为ACBECF。 能验证CO氧化产物的现象是:AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊。为防止CO有毒气体污染环境,未被氧化的CO气体必须使其燃烧。 (2) 停止CO和CO2混合气体的通入就要关闭活塞a,打开活塞b放入稀H2SO4与NaOH 发生中和反应,放热有水蒸气从A装置中出来,与E中Na2O2反应就会有O2生成,副产物NaOH进入D中,O2以B中浓H2SO4干燥再进入H装置将乙醇蒸气与O2能守加热的铜丝网被氧化成乙醛。 2CH3CH2OH+O2 2CH3CHO+2H2O (3)NaOH 溶于水放出大量的热,温度升高,使氨的溶解度减小而放出;NaOH 固体吸水,促使氨放出;NaOH 电离出的OH-增大了氨水中OH-浓度,促使氨水的电离平衡左移导致氨气放出。 氨气通过G中碱石灰被干燥,在E中铂铑合金的催化作用下与O2反应,被氧化成NO,NO接触O2就会被氧化成红棕色的NO2气体。NH3被O2氧化则证明氨气具有还原性。 该综合实验题出法很有新意,有仅考查了气体的制备、分离、干燥和性质验证,还考查了教材中的多方面核心知识内容,如Na2O2的性质,乙醇的脱氢氧化反应,氨的催化氧化反应等,可以说考查的内容相当丰富。而且一套实验仪器用于多种实验这在高考题中也非常少见。 2007年理科综合能力测试宁夏卷 第8题 下列除去杂质的方法正确的是 ①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离; ②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏; ③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶; ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。 A、①② B、②④ C、③④ D、②③ 点评: 1.除去乙烷中的乙烯:光照条件下通入Cl2,气液分离。这种除杂质的方法是错误的,光照通入Cl2是烷烃发生取代反应的条件。除去乙烷中的乙烯应将气体通入溴水中,乙烯与溴发生加成反应生成1,2—溴乙烷就留在了溶液中,出来的气体就剩乙烷。 2.除去乙酸乙酯中的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏。2除杂质的方法正确。杂质乙酸与Na2CO3反应而被吸收。 3.除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶。3除杂质的方法错误。SO2能与Na2CO3反应并放出CO2;但Na2CO3是正盐也能与CO2反应生成NaHCO3.因此正确的方法应该是让气体通过盛饱和碳酸氢钠溶液的洗气瓶。 4.除去乙醇中少量的乙酸:加足量生石灰,蒸馏。4除杂质方法正确。乙酸与CaO 反应生成盐不会被蒸馏出去。24方法正确,因此B为正确选项。 分离除去化合物中的杂质包含的内容很多,因此要掌握好最重要最具有代表性的化合物除杂质的方法。该题选择的内容具有典型性。要解答好这类题必须认真做好实验,认真观察思考老师做的演示实验,还要学会认真思考实验的过程和方法,认真分析对比相似相关的实验 2007年理科综合能力测试山东卷 第12题 乙基香草醛()是食品添加剂的增香原料,其香味比香草醛更加浓郁。 (1)写出乙基香草醛分子中两种含氧官能团的名称 。 (2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化: 提示:①RCH2OHRCHO KMnO4/H+ A(C9H10O3) HBr C (C9H9O2Br) CrO3/H2SO4 B(C9H8O3) 能发生银镜反应 ②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基 (a)由A→C的反应属于 (填反应类型) (b)写出A的结构简式 。 (3)乙基香草醛的另一种同分异构体D(CH3O--COOCH3)是一种医药中间体,请设计合理方案用茴香醛(CH3O--CHO)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。 例如:-Br 点评: (1乙基香草醛的同分异构体A是一种有机酸必为含有苯环的芳香羧酸。从A→C的分子组成的变化可知(a)发生的是取代反应,A中的-OH被HBr取代。从A→B分子组成上变化说明发生的是醇脱氢氧化变成醛基的反应。从A被氧化变成苯甲酸,又说明羧基和羟基在同一个侧链上。因此(b)A的结构简式只能是 (2)乙基香草醛的另一种同分异构体D是属于酯类化合物,用茴香醛合成,从结构上分析必须将醛氧化变为羧酸,然后进行酯化变为D,其反应流程应为: 该题突出了有机化合物结构与性质的关系。有机物的结构决定有机物的性质,有机物的性质反映有机物的结构。这是推导判断的基础。 除此之外还要认真学好题给信息,特别是提示中的12两条对推导判断A的结构非常重要。一道有机题就考查了醇、醛、羧酸等重要有机物的核心知识,并突出了学生分析问题与解决问题的能力,因此是好题。 2007年理科综合能力测试宁夏卷 第11题 11、下列反应的离子方程式正确的是 A、锌片插入硝酸银溶液中:Zn+Ag+= Zn2++ Ag B 、碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH= Ca2++2CH3COO-+2CO2↑+2H2O C、少量金属钠加到冷水中:Na+2H2O= Na++OH-+H2↑ D、氢氧化铜加到盐酸中:Cu(OH)2+2H+= Cu2++2H2O 点评: A、 离子方程式书写错误,错在氧化剂得电子总数与还原剂失电子总数不相等。正确的离子方程式应为Zn+2Ag+=Zn2++2Ag B、 离子方程式书写错误。错在Ca(HCO3)2为能溶于水的盐应写离子。正确的离子方程应为:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ C、 离子方程式书写错误。错在氧化剂得电子总数与还原剂失电子总数不相等。正确的离子方程式应为:2Na+2H2O=2Na++2OH-+H2↑ D、 离子方程式正确,D为正确选项。 该题为多年常出的传统试题。这类题常出而又有好的区分度。一是可出的化学反应非常之多,二是常出过的反应如Na与H2O反应等依然有学生照样选错。原因是对如何写好离子方程式规则不清楚,再就是学习这些重要反应时对其反应实质缺乏深入理解。 2007年理科综合能力测试宁夏卷 第26题 26.(14分) ⑴ 将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。 锌片上发生的电极反应: ; 银片上发生的电极反应: 。 ⑵ 若该电池中两电极的总重量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算: ① 产生氢气的体积(标准状况); ② 通过导线的电量。(已知NA=6.02×1023/mol,电子电荷为1.60×10-19C) 点评: (1) 将锌片和银片浸入稀硫酸中组成原电池,锌片上发生的电极反应:Zn-2e-→Zn2+,银片上发生的电极反应:2H++2e-→H2↑ (2)两电极的总重量为60g,消耗的只有锌片,因此消耗的锌的质量为(60-47)=13(g) 1.Zn+H2SO4(稀)= ZnSO4+ H2↑ 65g 22.4L 13g X=4.5L(或4.48L) 2.反应消耗的锌为:13g÷65g/mol=0.20mol 1molZn变为Zn2+时,转移2mole-,则通过的电量为:0.20mol×2×6.02×10-19=3.8×104C 该题将原电池的反应与化学方程式的计算及电量的计算有机地融合在一起。题目难度适中却能很好地考查出学生对原电池原理是否真正理解,对化学方程式的计算是否真正掌握 2007年理科综合能力测试宁夏卷 第27题 27.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: ⑴配平上述反应的化学方程式(将化学计量数填在方框内) ⑵该反应中的氧化剂是 ,其还原产物是 ; ⑶该反应的平衡常数表达式为K= ; ⑷若知上述反应为放热反应,则其反应热为ΔH 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”) ⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”); ⑹若已知CO生成速率为v(CO)=18mol/(L•min) 则N2的消耗速率为v(N2)= mol/(L•min)。 点评: 制取氮化硅的反应是氧化还原反应,因此配平时必须使氧化剂N2得电子总数与还原剂C失电子总数相等。 (1)3Si+6C+2N2 Si3N4+6CO (2)该反应中氧化剂是氮气,还原产物是Si3N4; (3)该反应的平衡常数表达式为 (4)制氮化硅的反应为放热反应,其反应热小于零,升高温度平衡向逆反应方向移动,其平衡常数值必然要减小。 (5)若使压强增大,化学平衡必然要向着气体体积减小的方向即逆反应方向移动。 (6)若CO的生成速率为V(CO)=18mol/(L·min),则N2的消耗速率就是V(N2)=6 mol/(L·min),因为N2与CO的物质的量之比为1:3。 该题以新型陶瓷材料Si3N4的制取为题材,题目新颖,反应方程式也没见过,这样能真正考查出学生分析氧化还原反应方程式的能力,配平氧化还原反应方程式的能力。以此反应为依据还考查了反应热、化学平衡常数、化学反应速率及影响化学平衡移动的因素等核心知识内容 2007年理科综合能力测试宁夏卷 第31题B B、〔化学---选修物质结构与性质〕 已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成。请回答: (1) 组成A分子的原子的核外电子排布式是 ; (2) B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”); (3) 若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ; (4) 若将1molE在氧气中完全燃烧,只生成1molCO2和2molH2O,则E的分子式是 。 点评: 含有18个电子的单原子分子是氩,双原子分子是HCl,三原子分子是H2S,四原子分子是PH3,五原子分子是SiH4,而且这些分子都由两种元素组成。含有10个电子的单原子分子是氖,双原子是HF,三原子分子是H2O,四原子分子是NH3,五原子分子是CH4。含有18个电子的双原子分子还有F2,四原子分子H2O2,六原子分子CH4O。 (1)Ar核外电子排布式为1S22S22P63S23P6 (2) B分子式为HCl,C分子式为H2S,C分子的主体结构是V形,该分子属于极性分子。 (3)符合题意的四原子分子D是H2O2,在MnO2催化作用下分解放出氧气的化学方程式为2H2O2H2O+O2↑ (4)1molE在O2中完全燃烧,只生成1molCO2说明分子中只含有1个碳原子,E又是六原子分子必还有1个氧原子,分子式为CH4O。 该题从原子结构到分子结构,以18个电子的五种分子为核心考查了有关物质结构的核心知识,同时还考查了H2O2分解和有机物燃烧的重要化学反应。该题的出法有利于学生思维能力的培养 2007年海南省化学高考卷 第3题 3.下列叙述正确的是 A. 95℃纯水的pH<7,说明加热可导致水呈酸性 B. pH=3的醋酸溶液,稀释至10倍后pH=4 C. 0.2mol/L的盐酸,与等体积水混合后pH=1 D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 点评: A、95℃纯水的PH<7,说明加热可导致水呈现酸性A叙述不正确。温度升高水的电离度变大H+浓度变大OH-浓度也同样变大,因此水仍为中性。 B、PH=3的醋酸溶液,稀释10倍后PH=4,B叙述也不正确。因为醋酸是弱酸,冲稀后电离度增大,因此稀释10倍后PH≠4。 C、0.2mol/L的盐酸,与等体积水混合后PH=1叙述正确,为正确选项。 D、PH=3的醋酸溶液,与PH=11的氢氧化钠溶液等体积混合后PH=7。D叙述也不正确。因为醋酸是弱酸;电离出来H+与OH-中和后还会继续电离,因此中生后PH<7。 考查水的电离和溶液PH内容,叙述不正确的选项都具有一定的迷惑性。要求考生对纯水电离的过程真正理解,对弱酸的电离与强酸的电离本质上有什么区别要真正理解。学习理论知识重在理解,这是判断正确与否的关键。 2007年海南化学高考试卷 第7题 7.下列实验现象的描述错误的是 A. 氢气在氯气中燃烧生成绿色烟雾 B. 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 C. 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰 D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 点评: A、氢气在氯气中燃烧生成黄绿色的烟雾。A实验现象的描述是错误的,A为正选项。氯气是黄绿色气体;氢气在氯气中燃烧生成的氯化氢是无色气体。雾是小液滴,烟是固体小颗粒。氯化氢易溶于水,在空气中易形成酸雾。 B、红热的铁锈在氧气中燃烧,火星四射,生成黑色的固体颗粒。B实验现象描述正确。 C、点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰。C实验现象描述正确。 D、钠中空气中燃烧,发出黄色的火焰,生成淡黄色固体。D实验现象描述正确。 能准确描述实验现象是认真做好实验的结果。透过实验现象去分析发生化学反应的实质就能把化学反应学活而不用去死记背化学方程式。因此出这样的考题很有必要。 2007年海南省化学高考试卷 第9题 9.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是 A.②④⑤③① B.③②④①⑤ C.③④②⑤① D.②④③⑤① 点评: 由海水制备无水氯化镁,进而电解熔融氯化镁制取金属镁。 分析制备无水氯化镁的主要步骤可以用逆推法。要从纯净的氯化镁制取无水氯化镁必须要经过脱水干燥。制取出纯净的氯化镁溶液必须经过浓缩结晶才能得到氯化镁晶体。纯净的氯化镁溶液不是从海水中直接得到的,它是用盐酸与从海水提取出的氢氧化镁中和而生成。从海水中提取氯化镁,必须先加入热石灰制取氢氧化镁,氢氧化镁不溶于水,便可以通过过滤的方法除去杂质。由此分析可得出制取无水氯化学镁的主要步骤是2加熟石灰4过滤3加盐酸5浓缩结晶1一定条件下脱水干燥。D为正确选项。 该题靠死记硬背制取步骤是很难得分的。从天然矿产资源制取纯净物,必须经过除杂质分离提纯。既要常握除杂质进行分离提纯的一般方法,又要会对具体产品做具体的分析。因此这样的考题能考查出学生的真实知识水平和分析问题解决问题的能力。 2007年海南省化学高考试卷 第13题 13.下表为元素周期表的一部分,请回答有关问题: IA IIA IIIA IVA VA VIA VIIA 0 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ ⑩ (1)⑤和⑧的元素符号是 和 ; (2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号) (3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式: , ; (4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。 点评: (1)从5在元素周期表中的位置第三周期第ⅣA族可知5为元素硅Si;从8在元素周期表中的位置第三周期零族可知8为元素氩Ar。 (2)表中最活泼的金属应从元素周期表的左下角去找9应为元素钾K。非金属性最强的元素应从元素周期表的右上角去找,2应为元素氟F。 (3)表中能形成两性氢氧化物的元素是4元素铝Al,6元素为S最高价氧化物的水化物为H2SO4,它与Al(OH)3反应的化学方程式为: 2Al(OH)3+3H2SO4= Al2(SO4)3+6H2O或Al(OH)3+KOH=KAl (OH)4 (4)元素7为氯,元素10为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强。将氯水加入到溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。 关于元素周期律的考题一般难度都不大,得好分的关键是要准。要在头脑中有一个完整准确的元素周期表,这样就能准确判断元素,尽而回答出相关的问题。该题设计实验虽然简单,但体现了新课标的要求。 2007年海南省化学高考试卷 第14题 14.依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。 请回答下列问题: (1)电极X的材料是 ;电解质溶液Y是 ; (2)银电极为电池的 极,发生的电极反应为 ; X电极上发生的电极反应为 ; (3)外电路中的电子是从 电极流向 电极。 点评: 根据氧化还原反应:2Ag++Cu=Cu2++2Ag 设计的原电池,Cu为还原剂失电子必为负极。 (1)电极X的材料是铜;电解质溶液Y是硝酸银溶液。 (2)银电极为电池的正极,发生的电极反应为2Ag++2e-=2Ag;X电极上发生的电极反应为Cu-2e-=Cu2+; (3)外电路中的电子是从铜电极流向银电极。 该题给出的是有盐桥的原电池就更能考查出学生对原最池工作原理的理解。对氧化还原反应和原电池的内在联系的深入理解是解好题的基础。一定要牢记:电子流出的一极是原电池的负极。铜与银的活泼性相比也一定是铜失电子,从给出CuSO4 溶液也暗示X为铜失电子,抓住这一解题关键其他问题就可以迎刃而解了。 2007年海南省化学高考试卷 第13题 13.下表为元素周期表的一部分,请回答有关问题: IA IIA IIIA IVA VA VIA VIIA 0 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ 4 ⑨ ⑩ (1)⑤和⑧的元素符号是 和 ; (2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号) (3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式: , ; (4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。 点评: (1)从5在元素周期表中的位置第三周期第ⅣA族可知5为元素硅Si;从8在元素周期表中的位置第三周期零族可知8为元素氩Ar。 (2)表中最活泼的金属应从元素周期表的左下角去找9应为元素钾K。非金属性最强的元素应从元素周期表的右上角去找,2应为元素氟F。 (3)表中能形成两性氢氧化物的元素是4元素铝Al,6元素为S最高价氧化物的水化物为H2SO4,它与Al(OH)3反应的化学方程式为: 2Al(OH)3+3H2SO4= Al2(SO4)3+6H2O或Al(OH)3+KOH=KAl (OH)4 (4)元素7为氯,元素10为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强。将氯水加入到溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。 关于元素周期律的考题一般难度都不大,得好分的关键是要准。要在头脑中有一个完整准确的元素周期表,这样就能准确判断元素,尽而回答出相关的问题。该题设计实验虽然简单,但体现了新课标的要求。 2007年海南省化学高考试卷 第14题 14.依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。 请回答下列问题: (1)电极X的材料是 ;电解质溶液Y是 ; (2)银电极为电池的 极,发生的电极反应为 ; X电极上发生的电极反应为 ; (3)外电路中的电子是从 电极流向 电极。 点评: 根据氧化还原反应:2Ag++Cu=Cu2++2Ag 设计的原电池,Cu为还原剂失电子必为负极。 (1)电极X的材料是铜;电解质溶液Y是硝酸银溶液。 (2)银电极为电池的正极,发生的电极反应为2Ag++2e-=2Ag;X电极上发生的电极反应为Cu-2e-=Cu2+; (3)外电路中的电子是从铜电极流向银电极。 该题给出的是有盐桥的原电池就更能考查出学生对原最池工作原理的理解。对氧化还原反应和原电池的内在联系的深入理解是解好题的基础。一定要牢记:电子流出的一极是原电池的负极。铜与银的活泼性相比也一定是铜失电子,从给出CuSO4 溶液也暗示X为铜失电子,抓住这一解题关键其他问题就可以迎刃而解了。 2007年海南省化学高考试卷 第17题 17.下表是稀硫酸与某金属反应的实验数据: 实验序号 金属 质量/g 金属状态 C(H2SO4) /mol·L-1 V(H2SO4) /mL 溶液温度/℃ 金属消失的时间/s 反应前 反应后 1 0.10 丝 0.5 50 20 34 500 2 0.10 粉末 0.5 50 20 35 50 3 0.10 丝 0.7 50 20 36 250 4 0.10 丝 0.8 50 20 35 200 5 0.10 粉末 0.8 50 20 36 25 6 0.10 丝 1.0 50 20 35 125 7 0.10 丝 1.0 50 35 50 50 8 0.10 丝 1.1 50 20 34 100 9 0.10 丝 1.1 50 20 44 40 分析上述数据,回答下列问题: (1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号); (2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号); (3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。 (4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。 点评: (1) 从实验4和5的数据可知金属的质量相同,H2SO4溶液的体积和浓度相同,反应开始时温度也相同。但金属消失的时间即反应速率不相同。金属呈丝状的反应时间长,呈粉末状的反应速率快。这说明固体反应物的表面积对反应速率有影响,而且是表面积越大反应速率越快,能表明同一规律的实验还有1和2。 (2)仅表明反应物浓度对反应速率产生影响的实验有1、3、4、6、8;2、5。从数据显示,在其他条件完全相同的情况下,H2SO4溶液的浓度越大,反应速率越快即金属消失的时间越短。 (3)本实验中影响反应速率的基他因素还有反应温度;其实验序号是6和7;8和9。从数据显示,在其他条件相同的情况下,反应温度越高,反应速率越快即金属消失的时间越短。 (4)实验中的所有反应,反应前后溶液的温度变化值相近,推测其原因:因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,所以温度变化值相近。 该题给出9组实验数据,每组又有7项内容,没有耐心就不能答好此题。不做实验,不会仔细分析实验数据也不能答好此题。题目考查的是影响化学速率的因素及反应热。该题对新课标新教材中知识与技能、过程与方法、情感与世界观三个维度的统一有所体现。教师要通过实验使学生掌握分析实验数据的方法,会找出每两组实验中的相同与不同之处。会综合分析会总结归纳。 2007年海南省化学高考试卷 第21题 21.根据图示回答下列问题: (1)写出A、E、G的结构简式:A ,E ,G ; (2)反应②的化学方程式(包括反应条件)是 , 反应④化学方程式(包括反应条件)是 ; (3)写出①、⑤的反应类型:① 、⑤ 。 点评: 从图示分析可知C2H4与Cl2发生加成反应生成1,2-二氯乙烷C,C在强碱的醇溶液中加热发生消去反应生成氯乙烯D,D在催化剂的作用下发生加聚反应生成高分子化合物E即为聚氯乙烯。加热C的强碱的水溶液发生水解反应生成乙二醇F,F与G已二酸发生缩聚反应成聚已二酸乙二酯。 (1) 结构简式A:CH2=CH2, E , G (2)反应2 的化学方程式 ClCH2CH2Cl + NaOH CH2=CHCl +NaCl +H2O 反应4 的化学方程式是 ClCH2CH2Cl +2NaOHHOCH2CH2OH +2NaCl (3)1是加成反应、5是缩聚反应 以乙烯为原料进行合成,考查了乙烯最重要的化学性质就是发生加成反应,还考查了卤化烃的最重要的两条化学性质,还考查了合成高分子化合物两种反应类型:加聚反应和缩聚反应。考查了书写有机物结构简式和化学反应方程式的能力。总之该题综合考查了有机化学应掌握的核心知识内容和能力,而且合成路线与现在的工业生产实际相符合。 2007年海南省化学高考试卷 第25题 25.A、B、C、D、E代表5种元素。请填空: (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ; (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ; (3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。 (4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。 点评: (1) A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素最外层还有2个2S电子,因此A元素应为氮N。 (2) B元素负一价离子与氩电子层结构相同B元素为氯Cl,C元素正一价离子与氩电子层结构相同,C元素为钾K。 (3) D元素的正三价离子的3d亚层为丰充满则D原子就应为3d64S2即26号元素铁Fe,铁基态原子的电子排布式为 1S22S22P63S23P63d64S2。 (4) E元素基态原子的M层全充满,N层没有成对电子,只有1个未成对电子,则E原子就应为3d104S1即29号铜元素Cu,铜基态原子的电子排布式为1S22S22P63S23P63d104S1。 对于主族元素的原子结构要以零族元素为中心找出与它们电子层结构相同的离子。如与10号元素氖电子层结构相同的阴离子有F-、O2-、N3-,阳离子有Na+、Mg2+、Al3+等。与18号元素氩电子层结构相同的阴离子有Cl-、S2-、P3-,阳离子有K+、Ca2+等。 对于过渡元素的电子层结构要抓住重点抓典型。铁和铜就是应重点掌握的典型结构。该题的考查突出,难度适宜。 2007年海南省化学高考试卷 第29题 29.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题: (1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ; (2)写出“联合制碱法”有关反应的化学方程式: ; (3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同? ; (4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式: 原子利用率(%)= 。 点评: (1) 氨碱法中为回收氨而使石灰乳与副产物氯化铵反应,从而产生大量CaCl2废渣。 2NH4Cl + Ca(OH)2=CaCl2+2H2O+2NH3↑ (2)联合制碱法的主要化学反应为 NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+H2O+CO2↑ (3)氨碱法的CO2来源于石灰石的煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。 (4)联合制碱法原子利用率的表达式: 从原子利用率的表达式可以看出“联合制碱法”使原料得到充分利用,优于氨碱法。联合制碱法的创始人侯德榜早在上世纪初就具有绿色化学的思想观念就更值得我们学习。目前制碱工业采用“氨碱法”工艺的按照绿色化学的原则就应努力将CaCl2变为有用的产品,如用它生产“溶雪剂”、“干燥剂”等产品。该题既考查了教材中的核心知识又考查了对不同生产工艺进行分析比较的能力,而且融合了化学工业最新的发展理念。 2007年广东省化学高考试卷 第5题 5.氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是 A 若管道漏气遇氨就会产生白烟 B 该反应利用了Cl2的强氧化性 C 该反应属于复分解反应 D 生成1molN2有6mol电子转移 点评: A、说法正确,管通漏气Cl2就会与NH3发生反应并生成HCl,HCl与NH3化合生成NH4Cl就会有白烟产生。 B、说法正确,该反应利用了Cl2的强氧化性,Cl2将NH3氧化生成N2,HCl为还原产物。 C、说法错误为正确选项。该反应不属于复分解反应,该反应属于氧化还原反应。 D、生成1molN2有6mol电子转移说法正确。 该题密切联系工业生产实际,有利于学生对相关化学知识的理解。重点考查了氧化还原反应的核心知识内容,也考查了NH3和HCl气的鉴别,以及对于基本化学反应类型的理解 2007年广东省化学高考试卷 第10题 10.下列实验操作完全正确的是 编号 实验 操作 A 钠与水反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 B 配制一定浓度的氯化钾溶液1000mL 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 C 排除碱式滴定管尖嘴部分的气泡 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 D 取出分液漏斗中所需的上层液体 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 点评: A、 钠与水反应,用镊子从煤油中取出金属钠,必须用滤纸吸去表面的煤油,再切下绿豆大小的钠,剩余部分再放回试剂瓶中,将切下的钠放入盛有水(不能盛满水也不能水太少)的烧杯中。A给出的实验操作不完全也不准确。 B、 配制一定浓度的氯化钾溶液1000ml。称取的KCl固体必须放入500ml烧杯中溶解,不能在容量瓶中溶解。溶解后将溶液转移到容量瓶中,还要用少量蒸馏水洗涤燃杯和玻璃棒,并将洗涤溶液也注入到容量瓶中以保证溶质量不损失。再加入蒸馏水至接近刻度线,最后用胶头滴管滴加蒸馏水至凹液面与刻度线相切。最后振荡摇匀,定容。B实验操作既不完全也不准确。 C、 排除碱式滴定管尖嘴部分的气泡,实验操作完全正确,为正确选项。 D、 取出分液漏斗中所需的上层液体。下层液体从分液漏斗下端管口放出,关闭活塞,上层液体应倒入另一接收容器而不应再从分液漏斗的下端放出。否则漏斗管内壁的下层溶液会与上层溶液相混,达不到完全分离的目的。故D实验操作出不完全正确。 该实验题的考查细致入微,不亲自认真做实验认真思考实验步骤的学生都不可能答好这样的题目。题目的导向性很好,新教材就是要引导学生亲自动手做好实验,在做中学化学。在黑板上讲实验做实验和死背实验的学习方法必须要改变。 2007年广东省化学高考试卷 第12题 12.为了避免青铜器生成铜绿,以下方法正确的是 A.将青铜器放在银质托盘上 B.将青铜器保存在干燥的环境中 C.将青铜器保存在潮湿的空气中 D.在青铜器的表面覆盖一层防渗的高分子膜 点评: 青铜是铜跟锡的合金,生成的绿铜锈为碱式碳酸铜Cu(OH)2CO3. A、 将青铜器放在银质托盘上,不能避免青铜器生锈。若接触电解质溶液,由于铜与银的活泼性不同还易发生电化学腐蚀。 B、 将青铜器保存在干燥的环境中。B方法正确为正确选项。任何金属制品为防止锈蚀都应存在干燥的环境中。 C、 将青铜器保存在潮湿的空气中,不仅不能避免生锈,还会加快锈蚀速度。绿铜锈就是在有水有CO2和O2的条件下生成的。 2Cu +CO2 +H2O +O2=Cu2(OH)2CO3(绿铜锈) D、 在青铜器的表面覆盖一层防渗的高分子膜。这是现代化的防锈蚀技术。高分子膜使铜与空气中的CO2、H2O、O2隔绝当然能达到防锈蚀的目的。D也为正确选项。 青铜器远在奴隶社会就开始使用,用最现代化的高分子膜防腐蚀,跨越几千年的时空,激发人的兴趣,有利于学好关于合金及金属防腐蚀的知识内容。 2007年广东省化学高考试卷 第18题 下述实验能达到预期目的的是 编号 实验内容 实验目的 A 将SO2通入酸性KMnO4溶液中 证明SO2具有氧化性 B 将Cl2通入NaBr溶液中 比较氯与溴的氧化性强弱 C 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 研究温度对化学平衡的影响 D 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 研究催化剂对H2O2分解速率的影响 点评: A、将SO2通入酸性KMnO4溶液中,SO2被KMnO4氧化能证明的是SO2的还原性,不能证明SO2具有氧化性,A实验不能达到预期的实验目的。 B、将Cl2通入NaBr溶液中,Cl2将Br-氧化成Br2能比较出氯与溴的氧化性强弱。B能达到预期实验目的为正确选项。 C、将铜与浓硝酸反应生成NO2气体,NO2气体能双聚生成N2O4是放热反应,用冰水混合物降温可以使化学平衡向生成N2O4的方向移动,气体颜色变浅,此实验能达到研究温度对化学平衡影响的目的,C也是正确选项。 D、两支试管中加入的H2O2溶液体积相同浓度不同,其中1支加入少量的MnO2,研催化剂对H2O2分解速率的影响,达不到实验目的。要研究催化剂对反应速率的影响,溶液浓度相同。 把实验内容和实验目的联系在一起,是要求学生真正理解实验的全部过程,理解发生反应实质,而不是只记表面现象和结论。SO2既有氧化性又有还原性,必须深入理解发生氧化还原反应的实质,才能明确用什么实验证明其氧化性,用什么实验证明其还原性。认真做好实验,深入思考达到真正理解才是学习好化学理论知识的关键。 2007年广东省化学高考试卷 第19题 19.下列说法正确的是 A 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 B 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 C Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 D 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 点评: A、 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物。A说法不正确。其中纯碱碳酸钠不是碱而是盐。 B、 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质。B说法正确,为正确选项。 C、 Mg 、Al、 Cu可以分别用置换法、直接加热法和电解法冶炼得到。C说法不正确。Mg 、Al均为活泼金属,工业上都用电解法冶炼。 D、 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源。D说法正确,为正确选项。 该题考查了多种重要概念和金属冶炼的方法。不少概念是容易弄混的。如硫酸钡难溶于水,但它是强电解质,溶解的再少只要溶解的完全电离就是强电解质。煤、石油、天然气都是化石能源,也是一次能源。化石能源是不可再生能源,必须树之节约能源的意识。沼气是可再生能源,现在要大力推广使用。水煤气是二次能源,它是利用煤跟水在高温下反应生成CO和H2的混合可燃气。是将固体燃料煤转化为气体燃料的方法之一查看更多