- 2021-05-26 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习探究性综合实验题作业
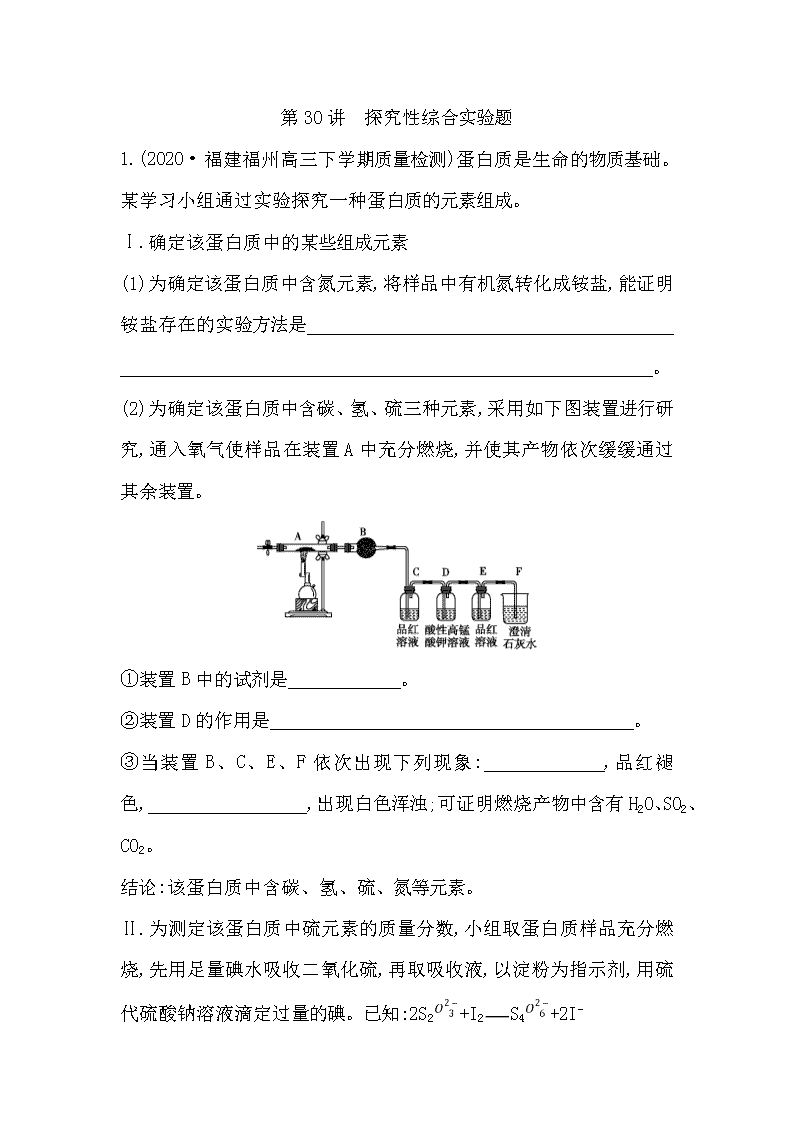
第30讲 探究性综合实验题 1.(2020·福建福州高三下学期质量检测)蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。 Ⅰ.确定该蛋白质中的某些组成元素 (1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是 。 (2)为确定该蛋白质中含碳、氢、硫三种元素,采用如下图装置进行研究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。 ①装置B中的试剂是 。 ②装置D的作用是 。 ③当装置B、C、E、F依次出现下列现象: ,品红褪色, ,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。 结论:该蛋白质中含碳、氢、硫、氮等元素。 Ⅱ.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2S2+I2S4+2I- (3)写出二氧化硫与碘水反应的化学方程式: 。 (4)滴定终点的现象为 。 (5)取蛋白质样品m g进行测定,采用c1 mol/L的碘水 V1 mL进行吸收,滴定过量的碘时消耗c2 mol/L硫代硫酸钠溶液V2 mL。该蛋白质中的硫元素的质量分数为 。 (6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值 (填“偏大”或“偏小”或“无影响”)。 解析:Ⅰ.(1)注入氢氧化钠溶液,加热,生成能使湿润的红色石蕊试纸变蓝色的气体,则证明存在铵盐。(2)蛋白质中含碳、氢、硫三种元素,通入氧气使样品在装置A中充分燃烧,生成二氧化碳、水、二氧化硫;B装置中盛放无水硫酸铜检验水、C装置中的品红检验二氧化硫、D装置中的酸性高锰酸钾溶液除二氧化硫,E装置中的品红检验二氧化硫是否除尽、F中的澄清石灰水检验二氧化碳;所以①装置B中的试剂是无水硫酸铜。②装置D的作用是除去SO2,避免对CO2的检验造成干扰。③当装置B、C、E、F依次出现下列现象:粉末由白色变蓝色,C中品红褪色,E中品红不褪色(或仍显红色),F中出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。Ⅱ.(3)二氧化硫与碘水反应生成硫酸、氢碘酸,反应方程式是I2+SO2+2H2OH2SO4+2HI。(4)达到滴定终点时碘单质完全被还原为I-,现象是当滴入最后一滴Na2S2O3 溶液后,溶液的蓝色褪去,且半分钟内不恢复原色。(5)设m g样品中硫元素的质量是x g,根据电子守恒+=c1 mol/L×V1×10-3 L,x=32c1 mol/L×V1×10-3 L-16c2 mol/L×V2×10-3 L,该蛋白质中的硫元素的质量分数为×100%=%。(6)过量氧气进入吸收液中,部分二氧化硫被氧气氧化,消耗硫代硫酸钠溶液的体积偏大,所以蛋白质中的硫元素的质量分数测定值偏小。 答案:(1)注入氢氧化钠溶液,加热,生成能使湿润的红色石蕊试纸变蓝色的气体 (2)①无水硫酸铜 ②除去SO2,避免对CO2的检验造成干扰 ③粉末由白色变蓝色 不褪色(或仍显红色) (3)I2+SO2+2H2OH2SO4+2HI (4)当滴入最后一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色 (5)% (6)偏小 2.(2020·浙江绍兴月考)某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下: Ⅰ.将光亮铜丝插入浓硫酸中,加热; Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热; Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。 查阅文献:检验微量Cu2+的方法:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。 (1)该同学假设黑色沉淀是CuO。检验过程如下: ①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。 ②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。 由该检验过程所得结论是 。 (2)再次假设,黑色沉淀是铜的硫化物。实验如下: 实验装置 现象 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 ①现象2说明黑色沉淀具有 性。 ②能确认黑色沉淀中含有S元素的现象是 ,相应的离子方程式是 。 ③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是 。 (3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是 。 解析:(1)由①、②两个对照实验可知黑色固体中不含CuO。 (2)① 由黑色沉淀与稀硝酸混合现象:A试管中黑色沉淀逐渐溶解;A试管内上方出现红棕色气体,说明黑色沉淀具有还原性,能将稀硝酸还原生成NO,NO遇氧气生成红棕色的NO2;②B试管中出现白色沉淀,则为稀硝酸将黑色沉淀中的S元素氧化生成SO2,SO2与NO2共同通入BaCl2溶液,NO2与水反应生成的硝酸将SO2氧化为S,S与Ba2+反应生成BaSO4沉淀,离子方程式为2N+3SO2+3Ba2++2H2O3BaSO4↓+ 2NO+4H+(或NO2+SO2+Ba2++H2OBaSO4↓+NO+2H+);③为确认黑色沉淀是铜的硫化物,还需确认铜离子,故需取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物。 (3)浓硫酸具有强氧化性,将CuS氧化为SO2。 答案:(1)黑色沉淀中不含有CuO (2)①还原 ②B试管中出现白色沉淀 2N+3SO2+3Ba2++2H2O 3BaSO4↓+2NO+4H+(或NO2+SO2+Ba2++H2OBaSO4↓+NO+2H+) ③取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物 (3)CuS+4H2SO4(浓)CuSO4+4SO2↑+4H2O 3.(2020·浙江绍兴月考)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。 Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢; 与盐酸反应产生的气体最多。 (2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 。 (3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: , ; Ⅱ.利用图装置可验证同主族元素非金属性的变化规律。 (4)干燥管D的作用为 ; (5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶。 解析:Ⅰ.(1)金属性:K>Na>Mg>Al,金属越活泼,与酸反应越剧烈,则将钠、钾、镁、铝各1 mol分别投入足量同浓度的盐酸中,钾与盐酸反应最剧烈,铝与盐酸反应的速度最慢,钠、钾、镁、铝均为1 mol时Al失去电子最多,则铝与盐酸反应产生的气体最多。 (2)向Na2 S溶液中通入氯气出现黄色浑浊,说明生成单质S,证明Cl的非金属性比S强,该反应的离子方程式为S2-+Cl2S↓+2Cl-。 (3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,可以说明NaOH的碱性大于NH3·H2O,但不能说明Na的金属性大于N,因为要验证金属性的强弱,必须通过比较最高价氧化物对应水化物的碱性来进行比较,而 NH3·H2O 不是氮元素的最高价氧化物的水化物。 Ⅱ.(4)球形干燥管D能够防止倒吸,避免C中液体进入锥形瓶中。 (5)二氧化碳与硅酸钠溶液反应生成硅酸白色沉淀,因氯化氢具有挥发性,会干扰实验结果,需将二氧化碳中混有的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶。 答案:(1)钾 铝 铝 (2)S2-+Cl2S↓+2Cl- (3)不合理 用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而NH3·H2O不是氮元素的最高价氧化物的水化物 (4)防止倒吸 (5)有白色沉淀生成 饱和NaHCO3 4.(2020·河北石家庄高三下学期一模)AgNO3是中学化学常用试剂,某兴趣小组设计如下实验探究其性质。 Ⅰ.AgNO3的热稳定性 AgNO3受热易分解,用如图装置加热AgNO3固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。 (1)实验室检验气体a的方法为 。 (2)已知B中只生成一种盐,据此判断AgNO3受热分解的化学方程式为 。 (3)从安全角度考虑,上述实验装置存在一处明显缺陷,改进措施为 。 Ⅱ.AgNO3与盐溶液的反应 (4)甲同学认为试管②中产生银镜是Fe2+所致,其离子方程式为 ; 乙同学认为要判断该观点正确,需增加如下实验,取2 mL 0.5 mol/L AgNO3溶液于试营中,向其中滴加几滴 ,若只产生白色沉淀,证明甲同学观点正确。 (5)已知:AgSCN为白色沉淀。试管③中红色褪去的原因为 (请从平衡移动的角度解释)。 (6)设计实验证明Ksp(AgI)查看更多