- 2021-05-26 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习鲁科版氯及其重要化合物作业
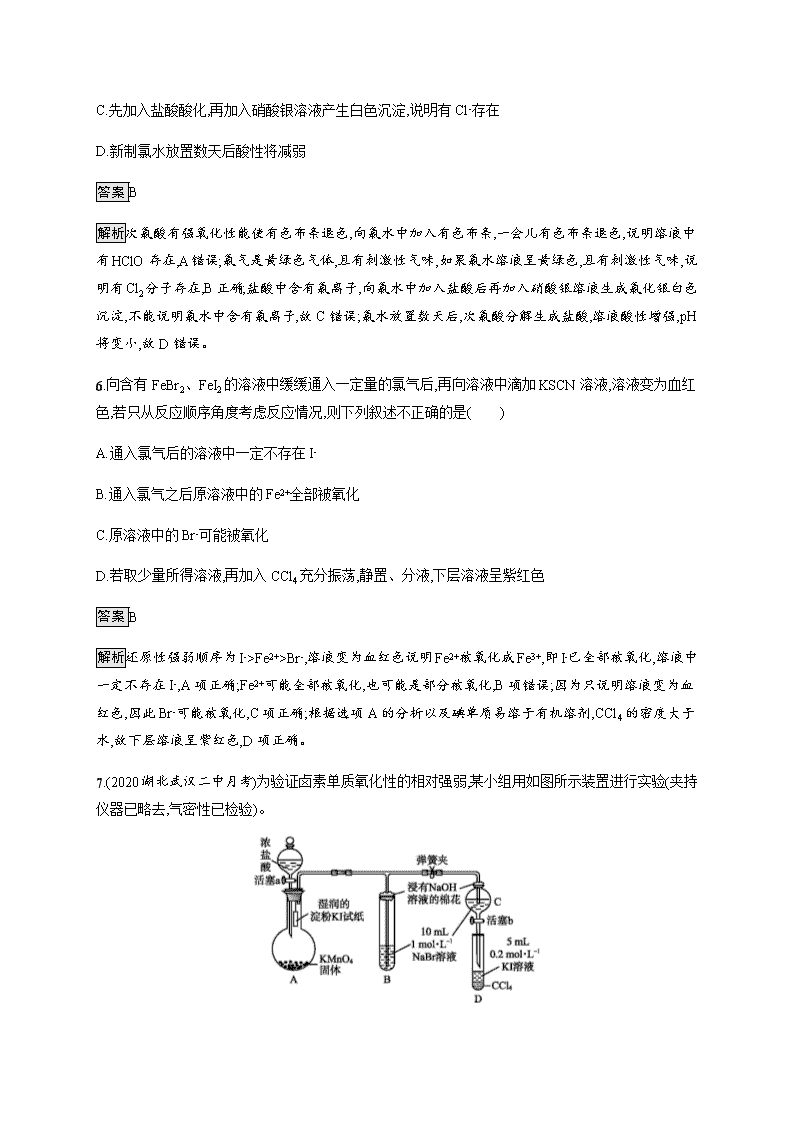
氯及其重要化合物 基础巩固 1.有关Cl2的性质,下列说法不正确的是( ) A.Cl2有毒但可用于自来水消毒 B.能与NaOH溶液反应生成两种正盐 C.能与Fe反应生成FeCl2 D.一定条件下与H2反应产生苍白色火焰 答案C 解析氯气可用于自来水消毒,A项正确;反应Cl2+2NaOHNaCl+NaClO+H2O生成两种正盐为NaCl和NaClO,B项正确;因为氯气具有强氧化性,与Fe反应时生成FeCl3,C项错误;氢气在氯气中燃烧发出苍白色火焰,D项正确。 2.下列说法不正确的是( ) A.漂白粉可用于生活用水的消毒 B.石蕊溶液滴入氯水中,溶液变红,随后迅速退色,不涉及氧化还原反应 C.氯水具有较强的氧化性,可用于漂白纸张、织物等 D.清洗碘升华实验所用试管,先用酒精清洗,再用水清洗 答案B 解析B项,红色退去是HClO表现强氧化性,错误;D项,碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗即可洗净,正确。 3.(2020东北育才中学模拟)下列物质能使紫色石蕊溶液由紫色变红又退色的是( ) ①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉溶液 ⑤木炭 ⑥Na2O2 A.①③④ B.①②③⑥ C.②③④ D.①③④⑤⑥ 答案A 解析①Cl2与水反应生成盐酸和次氯酸,盐酸能使紫色石蕊溶液由紫色变红,次氯酸的强氧化性能使溶液退色;②盐酸能使紫色石蕊溶液由紫色变红,不能退色;③氯水中含盐酸和次氯酸,能使紫色石蕊溶液由紫色变红,后退色;④盐酸酸化的漂白粉溶液中含有盐酸和次氯酸,能使紫色石蕊溶液由紫色变红,后退色;⑤木炭不能使紫色石蕊溶液变红;⑥Na2O2与水反应生成碱,使紫色石蕊溶液变蓝,Na2O2过量时溶液会退色。 4.(2020江苏无锡调研)下列装置应用于实验室制取氯气并回收二氧化锰的实验,能达到实验目的的是( ) A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.用装置丙分离二氧化锰和浓盐酸反应后的溶液 D.用装置丁蒸干反应后的溶液制MnCl2·4H2O 答案C 解析用二氧化锰与浓盐酸反应制取氯气需要加热,A不能达到实验目的;气体通过乙装置时应长进短出,除杂试剂应选用饱和食盐水,B不能达到实验目的;二氧化锰不溶于水,C能达到实验目的;蒸干溶液会引起MnCl2·4H2O分解,D不能达到实验目的。 5.(2020福建三明调研)在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是( ) A.加入有色布条,退色,说明溶液中有Cl2存在 B.溶液呈现黄绿色,且有刺激性气味,说明有Cl2存在 C.先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 D.新制氯水放置数天后酸性将减弱 答案B 解析次氯酸有强氧化性能使有色布条退色,向氯水中加入有色布条,一会儿有色布条退色,说明溶液中有HClO存在,A错误;氯气是黄绿色气体,且有刺激性气味,如果氯水溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在,B正确;盐酸中含有氯离子,向氯水中加入盐酸后再加入硝酸银溶液生成氯化银白色沉淀,不能说明氯水中含有氯离子,故C错误;氯水放置数天后,次氯酸分解生成盐酸,溶液酸性增强,pH将变小,故D错误。 6.向含有FeBr2、FeI2的溶液中缓缓通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变为血红色,若只从反应顺序角度考虑反应情况,则下列叙述不正确的是( ) A.通入氯气后的溶液中一定不存在I- B.通入氯气之后原溶液中的Fe2+全部被氧化 C.原溶液中的Br-可能被氧化 D.若取少量所得溶液,再加入CCl4充分振荡,静置、分液,下层溶液呈紫红色 答案B 解析还原性强弱顺序为I->Fe2+>Br-,溶液变为血红色说明Fe2+被氧化成Fe3+,即I-已全部被氧化,溶液中一定不存在I-,A项正确;Fe2+可能全部被氧化,也可能是部分被氧化,B项错误;因为只说明溶液变为血红色,因此Br-可能被氧化,C项正确;根据选项A的分析以及碘单质易溶于有机溶剂,CCl4的密度大于水,故下层溶液呈紫红色,D项正确。 7.(2020湖北武汉二中月考)为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。 实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。 Ⅳ.…… (1)A中产生 色气体。 (2)验证氯气的氧化性强于碘的实验现象是 。 (3)B中溶液发生反应的离子方程式是 。 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。 (5)过程Ⅲ实验的目的是 。 (6)氯、溴、碘单质的氧化性逐渐减弱,是因为同主族元素从上到下 ,得电子能力逐渐减弱。 答案(1)黄绿 (2)湿润的淀粉KI试纸变蓝 (3)Cl2+2Br-Br2+2Cl- (4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色 (5)确认C的溶液中反应后无Cl2,排除Cl2对溴置换碘实验的干扰 (6)原子半径逐渐增大 解析(1)A中产生的黄绿色气体为Cl2。 (2)Cl2遇湿润的淀粉KI试纸时,发生反应Cl2+2KII2+2KCl,产生的I2使淀粉变蓝,可以证明Cl2的氧化性强于I2。 (3)B中Cl2与NaBr发生置换反应,离子方程式为Cl2+2Br-2Cl-+Br2。 (4)C中NaBr与Cl2反应生成NaCl和Br2,将C中溶液滴入D中,振荡时发生反应Br2+2KII2+2KBr,静置后D中溶液分层,下层为碘的CCl4溶液,显紫红色,可以说明溴的氧化性强于碘。 (5)过程Ⅲ的B中溶液由黄色变为红棕色说明仍有Br2生成,由于B与C中溶液相同,故C中通入Cl2不足,NaBr过量,则C的黄色溶液中无Cl2,可排除对溴置换碘实验的干扰。 (6)氯、溴、碘单质的氧化性逐渐减弱,是因为从Cl到I,原子半径逐渐增大,得电子能力逐渐减弱。 能力提升 8.下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl(浓)2KCl+5Cl2↑+2MnCl2+8H2O 对实验现象的“解释或结论”正确的是( ) 选项 实验现象 解释或结论 A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2 B c处先变红,后退色 氯气与水生成了酸性物质 C d处立即退色 氯气与水生成了漂白性物质 D e处变红色 还原性:Fe2+>Cl- 答案D 解析a处变蓝、b处变红棕色,说明Cl2分别与KI、NaBr反应生成I2、Br2,可证明氧化性:Cl2>I2,Cl2>Br2,无法证明I2与Br2的氧化性的强弱,A错误;c处先变红,证明Cl2与水反应生成酸性物质,后退色,证明Cl2与水反应生成具有漂白性的物质,B错误;d处立即退色,也可能是因为Cl2与水生成酸性物质中和了NaOH,C错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D正确。 9.(2020四川广安质检)溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生反应IBr+H2OHBr+HIO,下列有关IBr的叙述不正确的是( ) A.在很多反应中IBr是强氧化剂 B.IBr与水反应时既作氧化剂,又作还原剂 C.IBr与AgNO3溶液反应会生成AgBr沉淀 D.IBr与NaOH溶液反应时,生成NaBr和NaIO 答案B 解析IBr中碘为+1价,溴为-1价,IBr是一种强氧化剂。故A正确;IBr与水的反应不是氧化还原反应,故B错误;已知IBr与水的反应生成HBr和HIO,推测可知IBr与AgNO3溶液反应会生成AgBr沉淀,故C正确;已知IBr与水的反应生成HBr和HIO,推测可知IBr与NaOH溶液反应时生成NaBr和NaIO,故D正确。 10.将一定量的氯气通入30 mL浓度为10 mol·L-1的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( ) A.与NaOH反应的氯气一定为0.3 mol B.n(Na+)∶n(Cl-)可能为7∶3 C.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 D.若反应中转移的电子为n mol,则0.15查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档