- 2021-05-26 发布 |
- 37.5 KB |
- 22页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省太原市2020届高三模拟试题(二)理科综合化学试题 Word版含解析
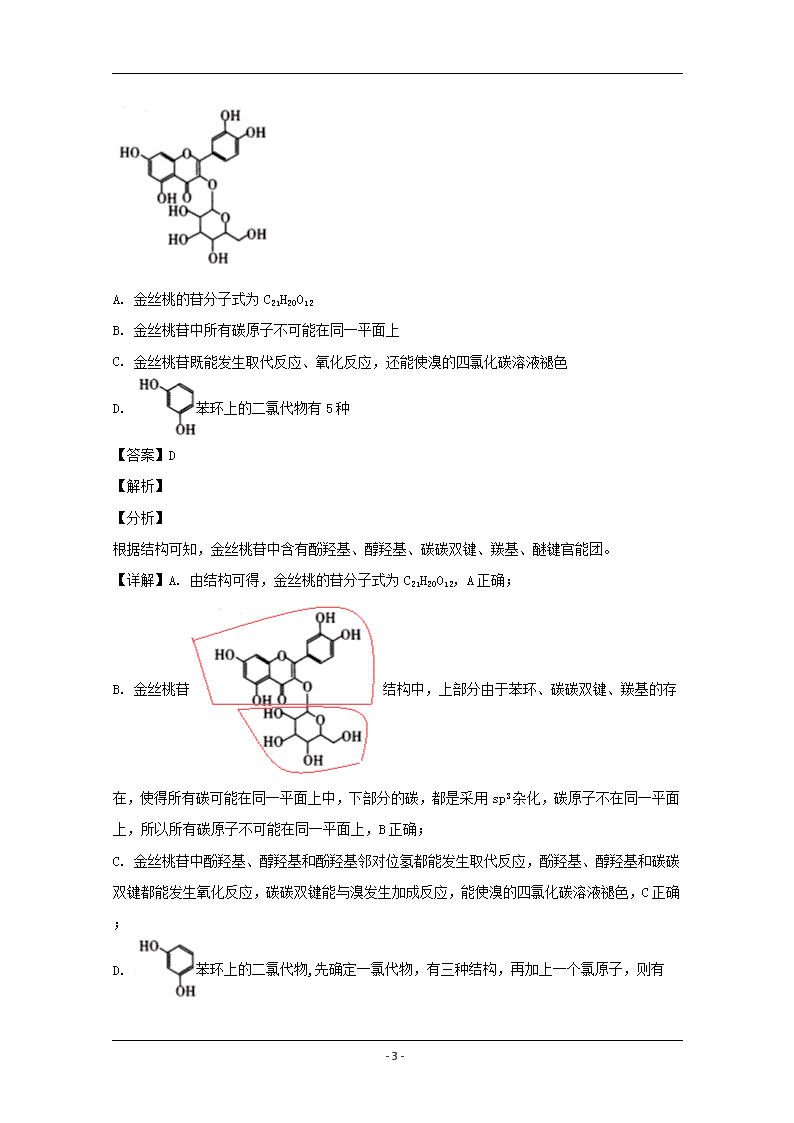
- 1 - 太原市 2020 年高三年级模拟试题(二) 理科综合能力测试化学试题 注意事项: 1.答题前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改 动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在 本试卷上无效。 3 考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H-1 Li-7 O-16 Al-27 V-51 一、选择题:本题共 13 小题,每小题 6 分。在每小题给出的四个选项中,只有一项是符合题 目要求的。 1.2019 年江西南昌“海昏侯墓”出土了一件青铜白酒蒸馏器。下列说法不正确的是( ) A. 在实验室进行蒸馏时,必须使用圆底烧瓶、直形冷凝管、酒精灯、锥形瓶等仪器 B. 我国古代人民常用明水矾除去铜器表面的铜绿(铜锈) C. 青铜文物和铁质文物在潮湿的土壤环境中容易发生电化学腐蚀 D. 与火法冶铜(以 Cu2S 为原料)相比,采用湿法冶铜(以 CuSO4 为原料)的优点是减少了环 境污染和能源的消耗 【答案】A 【解析】 【详解】A.实验室进行蒸馏时,须使用蒸馏烧瓶、温度计、直形冷凝管、酒精灯、羊角管、 锥形瓶等仪器,A 选项错误; B.明矾中含有铝离子,铝离子水解使溶液显酸性,Cu(OH)2CO3 能与酸性溶液反应,所以可用 明水矾除去铜器表面的铜绿(铜锈),B 选项正确; C.青铜文物和铁质文物,在潮湿环境中易形成原电池发生电化学腐蚀,腐蚀速率更快,C 选 项正确; D.火法冶铜(以 Cu2S 为原料)会产生 SO2,对环境造成污染,同时高温条件下耗能较高,而湿 法冶铜(以 CuSO4 为原料)采用电化学原理,相比火法冶铜减少了环境污染和能源的消耗,D 选 项正确; 答案选 A。 2.我国科学家将 LiClO4 溶于有机溶剂作为惰性电解质,使用溶剂热合成法将钌(Ru)纳米颗粒 - 2 - 沉积在导电碳黑(SuperP)上。所得材料 RuSuperP 用作 Li—CO2 二次电池中的正极。电池的总 反应为:3CO2+4Li=2Li2CO3+C。下列说法正确的是( ) A. 放电时,ClO - 4 向正极移动 B. 充电时.阳极反应为:2Li2CO3+C-4e-=3CO2↑+4Li+ C. 该电池电解液中的 LiClO4 可以用 LiCl 水溶液替换 D. 放电时溶液中每转移 4mol 电子时吸收 CO2 气体 67.2L 【答案】B 【解析】 【分析】 根据电池总反应可知,电池放电时,Li 失去电子发生氧化反应生成 Li+,则 Li 作负极,CO2 得 到电子发生还原反应生成 C,作正极,充电时为电解池,原电池正极对应阳极,负极对应阴极, 据此分析解答。 【详解】A.放电时为原电池,原电池中阴离子向负极移动,因此 ClO - 4 向负极移动,A 选项错 误; B.充电时,阳极 C 失去电子与 Li2CO3 结合生成 CO2 和 Li+,电极反应为 2Li2CO3+C-4e-=3CO2↑+4Li+, B 选项正确; C.由于 Li 会与 H2O 发生反应,若将电解液中的 LiClO4 用 LiCl 水溶液替换,会腐蚀 Li 电极, C 选项错误; D.未指明标准状况,不能准确计算吸收 CO2 气体的体积,D 选项错误; 答案选 B。 3.研究表明连花清瘟制剂中的金丝桃苷是对新冠病毒主要蛋白酶最可能的抑制剂。其结构如 图所示。下列说法错误的是( ) - 3 - A. 金丝桃的苷分子式为 C21H20O12 B. 金丝桃苷中所有碳原子不可能在同一平面上 C. 金丝桃苷既能发生取代反应、氧化反应,还能使溴的四氯化碳溶液褪色 D. 苯环上的二氯代物有 5 种 【答案】D 【解析】 【分析】 根据结构可知,金丝桃苷中含有酚羟基、醇羟基、碳碳双键、羰基、醚键官能团。 【详解】A. 由结构可得,金丝桃的苷分子式为 C21H20O12,A 正确; B. 金丝桃苷 结构中,上部分由于苯环、碳碳双键、羰基的存 在,使得所有碳可能在同一平面上中,下部分的碳,都是采用 sp3 杂化,碳原子不在同一平面 上,所以所有碳原子不可能在同一平面上,B 正确; C. 金丝桃苷中酚羟基、醇羟基和酚羟基邻对位氢都能发生取代反应,酚羟基、醇羟基和碳碳 双键都能发生氧化反应,碳碳双键能与溴发生加成反应,能使溴的四氯化碳溶液褪色,C 正确; D. 苯环上的二氯代物,先确定一氯代物,有三种结构,再加上一个氯原子,则有 - 4 - 、 、 、 ,共有 4 种,D 错误; 答案选 D。 【点睛】二氯代物同分异构体的判断,先确定一氯代物可能的结构,再加上一个氯原子变成二 氯代物,一定要注意相同的结构要排除。 4.一种玉石主要成分的化学式为 Z2X10W12Y30,其中 X、Y、Z、W 均为短周期主族元素且原子序数 依次增大,X 与 Z 位于同一主族,Y 与 X 位于同一周期。X、W、Z 原子的最外层电子数之和等 于 Y 原子的最外层电子数,且 Y 是地壳中含量最多的元素。下列说法错误的是( ) A. 原子半径:Z>W>Y B. 最高价氧化物对应水化物的碱性:Z>X C. 这四种元素与氢元素只能形成 4 种二元化合物 D. Y、W 组成的常见化合物中只含有极性键且能与 NaOH 溶液反应 【答案】C 【解析】 【分析】 由题干可知,一种玉石主要成分的化学式为 Z2X10W12Y30,X、Y、Z、W 为原子序数依次增大的短 周期主族元素,Y 是地壳中含量最多的元素,则 Y 为 O 元素,X 与 Z 位于同一主族,Y 与 X 位 于同一周期,X、W、Z 原子的最外层电子数之和等于 Y 原子的最外层电子数,则 X 为 Li 元素, Z 为 Na 元素,W 为 Si 元素,则该玉石为 Na2Li10Si12O30,据此分析解答。 【详解】A.根据上述分析,Y 为 O,Z 为 Na,W 为 Si,则原子半径:Na>Si>O,即 Z>W>Y, A 说法正确; B.元素金属性越强,最高价氧化物对应水化物的碱性越强,金属性 Na>Li,则碱性:NaOH >LiOH,B 说法正确; C.Si 和 C 形成的氢化物有很多种,O 元素能形成 2 种氢化物,C 说法错误; D.Si 和 O 组成的常见化合物为 SiO2,SiO2 中只含有极性键,能与 NaOH 溶液反应生成 Na2SiO3, D 说法正确; 答案选 C。 - 5 - 5.“化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。 已知:①Cu2++4NH3•H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为 H2O2的催化剂);②已知装置 A、C 中所用硫酸的浓度相同,装置 B、D 中所用金属锌的质量完全相同 下列说法错误的是( ) A. 该实验成功的关键条件是整套装置的气密性良好 B. 因为形成原电池,所以装置 D 中生成氢气的反应速率一定大于 B C. 导管 a 的作用是平衡 A 和 B 内气压 D. 装置 H 中出现浅黄色浑浊,可证明非金属性:O>S 【答案】B 【解析】 【分析】 B 中稀硫酸和锌反应生成 H2,H2 进入 C 中,C 中压强增加,把 C 中的硫酸和硫酸铜混合溶液挤 压到 D 中,D 中 Zn 和硫酸铜、硫酸反应生成 Cu 和 H2,H2 进入 E 中,E 中压强增加,把 E 中的 硫酸铜溶液挤压到 F 中,Cu2+ 和氨水生成蓝色 Cu( OH)2 沉淀,但随后转化为可溶性的 [Cu(NH3)4]2+ ,被挤入到 G 中,促使 H2O2 分解,H2O2 分解生成的 O2 进入 H 中和过量 H2S 溶液反应, 生成淡黄色的 S 沉淀,挥发出的 H2S 气体被 NaOH 溶液吸收,避免污染空气。 【详解】A.该实验是通过改变装置内气压引发后续反应,在装置气密性良好的前提下才能进 行,A 正确; B.由于铜离子的氧化性强于氢离子,故锌先和铜离子发生反应而生成铜,铜离子反应后才可 以和氢离子反应放出氢气,所以刚开始没有氢气产生,故 D 中生成氢气的反应速率不一定大 于 B,B 错误; C.B 中稀硫酸和锌反应生成 H2,压强增加,在 A 和 B 之间增设了导管 a,其作用是平衡 A 和 B 内气压,使稀硫酸顺利流下,C 正确; D.根据分析可知 G 中生成的 O2 进入 H 中和过量 H2S 溶液反应,生成淡黄色的沉淀,则发生了反 - 6 - 应:2H2S+ O2=2S↓+2H2O,此反应中 O2 为氧化剂,S 为氧化产物,根据氧化还原反应强弱规律, 氧化性:氧化剂>氧化产物,即氧化性:故 O2>S,根据单质的氧化性越强,元素的非金属性越 强,所以非金属性 O>S,D 正确。 答案选 B。 【点睛】本题利用压强的变化引发了后续反应,如若装置气密性不好,则不能引发后面的反 应,所以该实验成功的关键是整套装置的气密性良好;本题难点是在 B 选择,虽然形成原电 池能加快反应速率,但是要考虑谁先反应的问题,锌与铜离子反应时是没有氢气产生的。 6.2020 年 3 月 10 日,习近平总书记赴湖北武汉考察新冠疫情工作,给奋战在抗疫一线的战士 们、武汉乃至全国人民极大的鼓舞。下列说法错误的有( ) ①用于消毒的酒精、“84”消毒液、双氧水、过氧乙酸(CH3COOOH)等均属于有机物 ②95%的酒精比 75%的酒精杀菌效果好 ③“84”消毒液露置在空气中不会变质 ④双氧水能使酸性高锰酸钾溶液和溴水褪色,其褪色原理均为氧化还原反应 ⑤修建“火神山”医院所用的 HDPE(高密度聚乙烯)膜是一种无毒、无味的高分子材料 ⑥医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色 ⑦科研人员积极研发抗击新型冠状病毒的疫苗,疫苗一般应冷藏存放,以避免蛋白质变性 ⑧N95 口罩用 0.3µmNaCl 颗粒进行测试,阻隔率达 95%以上,戴 N95 口罩可有效阻隔 PM2.5 ⑨过氧乙酸和乙酸属于同系物 A. 6 项 B. 5 项 C. 4 项 D. 3 项 【答案】B 【解析】 【详解】①用于消毒的酒精、过氧乙酸(CH3COOOH)属于有机物,“84”消毒液的主要成分为 NaClO,双氧水为 H2O2,两者属于无机物,①错误; ②乙醇溶液消毒原理是乙醇分子通过细胞膜,使内部蛋白质变性,浓度过高不易进入细胞内 部,75%的乙醇溶液消毒效果最佳,②错误; ③“84”消毒液露置在空气中,空气中的 CO2 和 H2O 会使 NaClO 生成 HClO,HClO 不稳定,见光 易分解,从而“84”消毒液变质,③错误; ④双氧水能使酸性高锰酸钾溶液和溴水褪色,前者双氧水体现还原性,后者双氧水体现氧化, 两者的褪色原理均为氧化还原反应,④正确; ⑤修建“火神山”医院所用的 HDPE(高密度聚乙烯)膜属于乙烯的加聚产物,是一种无毒、无 - 7 - 味的高分子材料,⑤正确; ⑥医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯不含有碳碳双键,不能使 溴水褪色,⑥错误; ⑦科研人员积极研发抗击新型冠状病毒的疫苗,疫苗的主要成分是蛋白质,蛋白质受热易变 形失活,因此疫苗一般应冷藏存放,以避免蛋白质变性,⑦正确; ⑧N95 型口罩,“N”的意思是不适合油性的颗粒;“95”是指在 NIOSH(美国国家职业安全 卫生研究所)标准规定的检测条件下,0.3 微米氯化钠颗粒过滤效率达到 95%。PM2.5,指环 境空气中空气动力学当量直径小于等于 2.5 微米的颗粒物,因 2.5 微米大于 0.3 微米,戴 N95 口罩可有效阻隔 PM2.5,⑧正确; ⑨过氧乙酸分子式为 CH3COOOH,乙酸分子式为 CH3COOH,两者不属于同系物,⑨错误; 综上所述,①②③⑥⑨共 5 项错误,B 选项正确。 7.室温下,用 0.1000mol•L-1NaOH 溶液滴定 20mL0.1000mol•L-1H3PO4 溶液,溶液的 pH 与所加 NaOH 溶液的体积关系如图所示。下列说法不正确的是( ) A. H3PO4 的电离平衡常数 Ka1 约为 10-2 B. 当 V(NaOH 溶液)=40mL 时,c(PO 3- 4 )+c(OH-)=c(H+)+c(H2PO - 4 )+2c(H3PO4) C. 当 pH=7 时,c(Na+)=c(H2PO - 4 )+2c(HPO 2- 4 )+3c(PO 3- 4 ) D. 当 V(NaOH 溶液)=20mL 时,c(Na+)>c(H2PO - 4 )>c(H3PO4)>c(HPO 2- 4 ) 【答案】D 【解析】 【分析】 0.1000mol•L-1NaOH 溶液滴定 20mL0.1000mol•L-1H3PO4 溶液,由图像可知,加入 NaOH 溶液的体 积为 20mL 时,pH=4.7,溶液中的溶质主要为 NaH2PO4,加入 NaOH 溶液的体积为 40mL 时,pH=9.7, 溶液中的溶质主要为 Na2HPO4,据此结合三大守恒分析解答问题。 - 8 - 【详解】A.根据图像分析可知,未加入 NaOH 溶液时,H3PO4 溶液的 pH=1.6,则 H3PO4 的电离平 衡常数 2+ - -1.6 2 4 -2 a1 -1 -1.6 3 4 c H c H PO 10 = = 10c H PO 10 -10K ,A 选项正确; B.当 V(NaOH 溶液)=40mL 时,溶液中的溶质主要为 Na2HPO4,则存在物料守恒 c(Na+)=2c(PO 3- 4 )+2c(HPO 2- 4 )+2c(H2PO - 4 )+2c(H3PO4),电荷守恒有 c(Na+)+c(H+)=3c(PO 3- 4 )+2c(HPO 2- 4 )+c(H2PO - 4 )+c(OH-),两式相减有 c(PO 3- 4 )+c(OH-)=c(H+)+c(H2PO - 4 )+2c(H3PO4),B 选项正确; C.pH=7 时,c(H+)=c(OH-),又存在电荷守恒: c(Na+)+c(H+)=3c(PO 3- 4 )+2c(HPO 2- 4 )+c(H2PO - 4 )+c(OH-),所以 c(Na+)=c(H2PO - 4 )+2c(HPO 2- 4 )+3c(PO 3- 4 ),C 选项正确; D.当 V(NaOH 溶液)=20mL 时,溶液中的溶质为 NaH2PO4,pH=4.7,溶液显酸性,则 H2PO - 4 电离 大于水解,因此 c(HPO 2- 4 )>c(H3PO4),D 选项错误; 答案选 D。 二、选择题:本题共 8 小题,每小题 6 分。在每小题给出的四个选项中,第 14--18 题只有一 项符合题目要求,第 19-21 题有多项符合题目要求。全部选对得 6 分,选对但不全得 3 分, 有选错的得 0 分。 8.目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题: (1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含 NH + 4 )的不同方法,过程如 下:①甲同学采用 Ca(ClO)2 作为氧化剂。将废水中的 NH + 4 转化为无毒气体。他在实验中发现 其他条件相同时,Ca(ClO)2 的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO - 2 )的浓度也随 之变大,写出该反应的离子方程式:___。 ②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取 wg 废水样品,注入如所图示的仪器中,然后逐滴加入足量 10%NaOH 溶液,通入水蒸气。将样 品液中的氨全部蒸出,用 V1mLc1mol·L-1 盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用 c2mol•L-1NaOH 标准溶液滴定过剩的 HCl,到终点时消耗 V2mLNaOH 溶液。 - 9 - NH4Cl 的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是 ___;冰盐水的作用是___。 (2)某工厂利用 NaClO2/(NH4)2CO3 溶液脱除烟气中的 SO2 和 NO。①保持溶液中 NaClO2 的浓度不 变,研究(NH4)2CO3 的浓度对 NO 和 SO2 脱除效率的影响[已知:(NH4)2CO3 溶液显碱性;NaClO2 的氧化性随 pH 增加而下降,酸性条件下会生成 ClO2]。实验结果如图所示,随着(NH4)2CO3 溶液 浓度的增大造成 NO 脱除效率下降的主要原因是___。 ②NO 脱除效率总是小于 SO2 脱除效率的主要原因是___。(写出一点) (3)某工厂采用微生物硝化法处理氨氮废水,过程如图: 下列有关说法正确的是___(填标号)。 ①微生物硝化法处理废水后会导致水体的 pH 升高 ②若微生物保持活性的 pH 范围为 7~9,则适宜用来调节水体 pH 的是 CO2 ③不能采用电解法在阴极将 NH + 4 直接转化为 NO - 3 【答案】 (1). 3ClO-+NH + 4 +2OH-=NO - 2 +3Cl-+3H2O (2). (3). 三颈烧瓶 (4). 当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气 - 10 - 压) (5). 冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收) (6). (NH4)2CO3 浓度增加,溶液的碱性越强,NaClO2 的氧化性下降 (7). NO 的溶解度较低(或脱 硝反应的活化能较高) (8). ③ 【解析】 【分析】 【详解】(1)①Ca(ClO)2 的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO - 2 )的浓度也随之 变大,说明 NH + 4 被氧化成 NO - 2 ,该反应的离子方程式:3ClO-+NH + 4 +2OH-=NO - 2 +3Cl-+3H2O。故答 案为:3ClO-+NH + 4 +2OH-=NO - 2 +3Cl-+3H2O; ②NH4Cl 是离子化合物,电子式为 。盛放样品液的仪器是三颈烧瓶;圆底 烧瓶中长玻璃导管的作用是当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或 平衡气压);冰盐水的作用是冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收)。 故答案为: ;三颈烧瓶;当烧瓶中压力过大时,安全管中液面上升,使 烧瓶中压力稳定(或平衡气压);冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的 吸收); (2)①已知:(NH4)2CO3 溶液显碱性,NaClO2 的氧化性随 pH 增加而下降,酸性条件下会生成 ClO2,根据图中实验结果,随着(NH4)2CO3 溶液浓度的增大,造成 NO 脱除效率下降的主要原因 是:(NH4)2CO3 浓度增加,溶液的碱性越强,NaClO2 的氧化性下降。故答案为:(NH4)2CO3 浓度增 加,溶液的碱性越强,NaClO2 的氧化性下降; ②根据 NO 的性质,NO 脱除效率总是小于 SO2 脱除效率的主要原因是:NO 的溶解度较低(或脱 硝反应的活化能较高)。故答案为:NO 的溶解度较低(或脱硝反应的活化能较高); (3)采用微生物硝化法处理氨氮废水,由图可得反应:NH4 ++2O2=NO3 -+H2O+2H+, ①微生物硝化法处理废水后会导致水体的 pH 降低,故错误; ②若微生物保持活性的 pH 范围为 7~9,调节水体 pH 可加入碱性物质,但不能引入新杂质,且 加强碱易使微生物变性,可加入石灰石来调节水体的 pH,故 B 错误; ③电解时,阳极发生氧化反应,不能采用电解法在阴极将 NH + 4 直接转化为 NO - 3 ,故正确; 故答案为:③。 - 11 - 9.V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶 炼铝生成的固体废料一一赤泥(主要成分为 Fe2O3、Al2O3、V2O5 及少量稀土金属氧化物)提取 V2O5 其工艺流程图如图: 已知:①NH4VO3 是白色粉末,微溶于冷水,可溶于热水。 ②NH4VO3 V2O5+2NH3↑+H2O ③V2O5 是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。 ④部分稀土金属氯化物在乙醇中溶解度较小。 (1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液 1 中通入足量 CO2 时所发生主要反应 的离子方程式:___。 (2)将磁性产品加入稀硝酸溶解,取上层清液再加入 KSCN 溶液后未见红色,写出该磁性产 品与稀硝酸反应的离子方程式:___。 (3)“洗涤”操作时可选用的洗涤剂有___。(填字母) A.冷水 B.热水 C.1%NH4Cl 溶液 D.乙醇 (4)需在流动空气中灼烧的原因可能是___。 (5)将 0.253g 产品溶于强碱溶液中,加热煮沸,调节 pH 为 8~8.5,向反应后的溶液中加入 硫酸酸化的 KI 溶液(过量),溶液中的还原产物为 V3+离子,滴加指示剂,用 0.250mol•L-1Na2S2O3 溶液滴定,达到终点时消耗 Na2S2O3 标准溶液 20.00mL,则该产品的纯度为___。 (已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字) (6)水系锌离子电池是一种新型二次电池,以 Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作 原理如图。放电时 V2O5 电极上的电极反应式为___。 - 12 - 【 答 案 】 (1). 加 快 碱 浸 速 率 并 使 氧 化 铝 充 分 溶 解 (2). AlO - 2 +2H2O+CO2=Al(OH)3↓+HCO - 3 (3). 3Fe+8H++2NO - 3 =3Fe2++2NO↑+4H2O (4). AC (5). 把生成的 NH3 及时带走,防止 V2O5 与 NH3 发生氧化还原反应,影响纯度与产率 (6). 89.9% (7). V2O5+xZn2++2xe-=ZnxV2O5 【解析】 【分析】 赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。滤渣 1 系列 操作得到 V2O5,可知滤渣 1 中含有 Fe2O3、V2O5 及少量稀土金属氧化物,进行还原、磁选,磁性 产品中含有 Fe 等,非磁性产品含有 V 元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以 VO2 +和 VO3 -的形式存在,再加入氯化铵转化为 NH4VO3,焙烧得到 V2O5,由溶液中存在平衡 VO2 + +H2O VO3 -+2H+,盐酸过量会抑制生成 NH4VO3,盐酸溶解时不易过量。 【详解】(1)赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。 “碱浸”时对赤泥进行粉碎的目的是:加快碱浸速率并使氧化铝充分溶解。滤液 1 中通入足 量 CO2 时所发生主要反应的离子方程式:AlO - 2 +2H2O+CO2=Al(OH)3↓+HCO - 3 。故答案为:加快碱 浸速率并使氧化铝充分溶解;AlO - 2 +2H2O+CO2=Al(OH)3↓+HCO - 3 ; (2)将磁性产品加入稀硝酸溶解,取上层清液再加入 KSCN 溶液后未见红色,说明生成的是 亚铁离子,该磁性产品与稀硝酸反应的离子方程式:3Fe+8H++2NO - 3 =3Fe2++2NO↑+4H2O。故答案 为:3Fe+8H++2NO - 3 =3Fe2++2NO↑+4H2O; (3)NH4VO3 是白色粉末,微溶于冷水,可溶于热水,NH4VO3 在 NH4Cl 溶液中溶解度较小,“洗 涤”操作时可选用的洗涤剂有冷水或 1%NH4Cl 溶液,虽然 NH4VO3 不溶于乙醇,但 NH4VO3 表面杂 质,如 NH4Cl 不溶于乙醇,使用乙醇不能洗去沉淀表面的杂质,不选用乙醇。故答案为:AC; (4)根据信息,NH4VO4 灼烧生成 V2O5,因为 V2O5 具有强氧化性,能与具有还原性 NH3 发生反应, - 13 - 从而影响产物的纯度及产率。需在流动空气中灼烧的原因可能是把生成的 NH3 及时带走,防止 V2O5 与 NH3 发生氧化还原反应,影响纯度与产率。故答案为:把生成的 NH3 及时带走,防止 V2O5 与 NH3 发生氧化还原反应,影响纯度与产率; (5)根据 I2 和 Na2S2O3 发生反应的方程式 I2+2Na2S2O3═Na2S4O6+2NaI 可知,消耗 n(I2)= 1 2 n (Na2S2O3)= 1 2 ×20.00×10-3L×0.250mol·L-1=2.5×10-3mol,根据得失电子数目守恒,n(V2O5) ×2×2=n(I2)×2,解得:n(V2O5)=1.25×10-3mol,则 m(V2O5)=1.25×10-3×182g=0.2275g, 则该产品的纯度为: 0.2275 0.253 g g ×100%=89.9%; 故答案为:89.9%; (6)放电时,锌作负极,失电子,V2O5 在正极上得电子,发生还原反应,生成 ZnxV2O5,放电 时 V2O5 电极上的电极反应式为 V2O5+xZn2++2xe-=ZnxV2O5。 故答案为:V2O5+xZn2++2xe-=ZnxV2O5。 【点睛】难点(5),根据 I2 和 Na2S2O3 发生反应的方程式 I2+2Na2S2O3═Na2S4O6+2NaI 可求出消耗 n(I2),再根据得失电子数目守恒求 n(V2O5),最后计算产品的纯度。 10.CO2 是地球上取之不尽用之不竭的碳源,将 CO2 应用于生产中实现其综合利用是目前的研究 热点。 (1)CO2 加氢制备甲酸(HCOOH,熔点 8.4℃沸点 100.8℃)是利用化学载体进行 H2 储存的关键 步骤。 已知:H2(g)+CO2(g) HCOOH(l) △H1=-30.0kJ•mol-1 2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ•mol-1 则表示 HCOOH 燃烧热的热化学方程式为___。 (2)在催化作用下由 CO2 和 CH4 转化为 CH3COOH 的反应历程示意图如图。 ①在合成 CH3COOH 的反应历程中,下列有关说法正确的是___。填(字母) a.该催化剂使反应的平衡常数增大 - 14 - b.CH4→CH3COOH 过程中,有 C—H 键发生断裂 c.由 X→Y 过程中放出能量并形成了 C—C 键 ②该条件下由 CO2 和 CH4 合成 CH3COOH 的化学方程式为___。 (3)CO2 与 H2 在一定条件下反应可生成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0。 改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L 密闭容器)。 实验过程中的部分数据见下表: 反应时间 n(CO2)/mol n(H2)/mol n(CH3OH)/mol n(H2O)/mol 实验 I 恒温恒容 0min 2 6 0 0 10min 4.5 20min 1 30min 1 实验 II 绝热恒 容 0min 0 0 2 2 ①实验 I,前 10min 内的平均反应速率υ(CH3OH)=___。 ②平衡时 CH3OH 的浓度:c(实验 I)___c(实验 II)(填“>”、“<”或“=”,下同)。实验 I 中 当其他条件不变时,若 30min 后只改变温度为 T2℃,再次平衡时 n(H2)=3.2mol,则 T1___T2。 ③已知某温度下该反应的平衡常数 K=160,开始时在密闭容器中只加入 CO2 和 H2,反应 10min 时测得各组分的浓度如下表,则此时υ正___υ逆。 物质 H2 CO2 CH3OH H2O 浓度/(mol·L-1) 0.2 0.2 0.4 0.4 【答案】 (1). HCOOH(1)+ 1 2 O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1 (2). bc - 15 - (3). CH4+CO2 CH3COOH (4). 0.025mol•L-1·min-1 (5). < (6). < (7). > 【解析】 【详解】(1)①H2(g)+CO2(g) HCOOH(l) △H1=-30.0kJ•mol-1 ②2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ•mol-1 根据盖斯定律:②× 1 2 -①得:HCOOH(1)+ 1 2 O2(g)=CO2(g)+H2O(1) △H= 1 2 × (-571.6kJ•mol-1)-(-30.0kJ•mol-1)=-255.8kJ·mol-1,表示 CH3COOH 燃烧热的热化学方程 式为 HCOOH(1)+ 1 2 O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1,故答案为: HCOOH(1)+ 1 2 O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1; (2)①a.催化剂改变反应速率,不影响平衡,反应的平衡常数不变,故错误; b.CH4→CH3COOH 过程中,第一步甲烷与二氧化碳中的 C=O 双键发生加成反应,有 C—H 键发生 断裂,故正确; c.由 X→Y 过程中,甲烷的碳与二氧化碳中有碳相连,形成了 C—C 键并放出能量,故正确; 故答案为:bc; ②该条件下甲烷与二氧化碳中的 C=O 双键发生加成反应,甲烷的碳与二氧化碳中有碳相连, 氢原子与氧原子相连,由 CO2 和 CH4 合成 CH3COOH 的化学方程式为 CH4+CO2 CH3COOH,故 答案为:CH4+CO2 CH3COOH; (3)①实验 I,前 10min 内的平均反应速率υ(H2)= 6 4.5 2 10 mol/(L·min)=0.075mol/ (L·min),υ(CH3OH)= 1 3 υ(H2)=0.025mol•L-1·min-1,故答案为:0.025mol•L-1·min-1; ②如果条件相同,实验 I 和 II 是等效平衡,但实验 II 逆向进行,吸收热量,平衡时温度低, 与实验 I 相比,相当于降温,平衡正向移动,平衡时 CH3OH 的浓度:c(实验 I)查看更多