- 2021-05-26 发布 |
- 37.5 KB |
- 25页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学选修5课件 第2章 第1节 脂肪烃 第2课时 炔烃 脂肪烃的来源及其应用
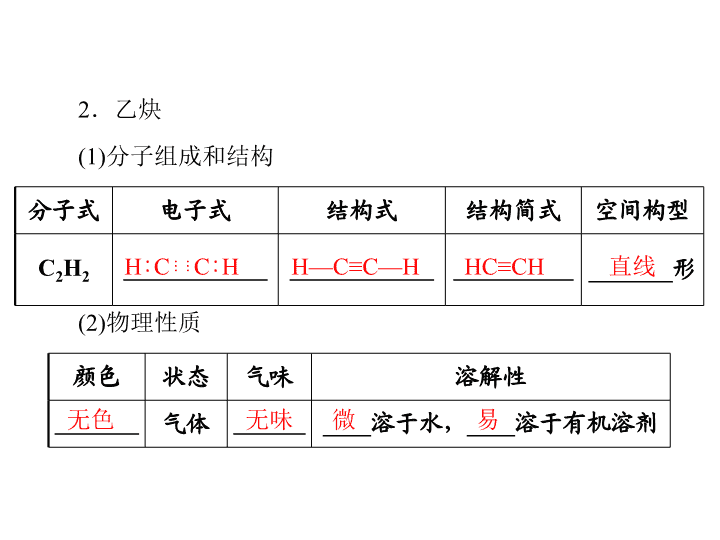
第 2 课时 炔烃 脂肪烃的来源及其应用 一、炔烃 碳碳三键 CnH2n-2 1.炔烃的概念及通式 分子里含有_____________的一类脂肪烃称为炔烃。通式为 ____________。 分子式 电子式 结构式 结构简式 空间构型 C2H2 ____________ ____________ __________ _______形 颜色 状态 气味 溶解性 _______ 气体 ______ ____溶于水,____溶于有机溶剂 2.乙炔 H∶ C⋮ ⋮ C∶ H H—C≡C—H (1)分子组成和结构 HC≡CH 直线 (2)物理性质 无色 无味 微 易 (3)实验室制法 CaC2 饱和食盐水①药品:_______、__________________。 ②反应原理:_______________________________。 图 2-1-1 ③发生装置:使用“固+液→气”的装置(见图 2-1- 1)。 CaC2+2H2O→Ca(OH)2+C2H2↑ ④收集方法:_______________。排水集气法 (4)化学性质 明亮 浓烟 含碳量高 ①氧化反应 a.燃烧:乙炔燃烧时,火焰________并伴有_________, 这是由于乙炔___________________的缘故。燃烧的化学方程式 为______________________________。 b.乙炔易被氧化剂氧化,如使酸性 KMnO4 溶液褪色。 ②加成反应 a.使溴的 CCl4 溶液褪色 CH≡CH+Br2→_______________;CHBr CHBr CHBr2CHBr2CH≡CH+2Br2→______________。 b.与 H2 加成 CH≡CH+H2 CH2 CH2 CH≡CH+2H2 CH3—CH3 c.与 HCl 加成 CH≡CH+HCl CH2 CHCl _________________;催化剂 _________________。催化剂 __________________。催化剂 二、脂肪烃的来源及其应用 1.来源 石油 天然气(1)脂肪烃的来源有________、__________、_____等。 (2)石油通过常压分馏可以得到石油气、汽油、________、 ________等;而减压分馏可以得到滑润油、________等相对分 子质量较大的烷烃;通过石油的催化裂化及裂解可以得到较多 的轻质油和______________;催化重整是获得__________的主 要途径。 气态烯烃 芳香烃 2.应用:燃料、化工原料。 煤 煤油 柴油 石蜡 乙烷 乙烯 乙炔 结构简式 CH3—CH3 HC≡CH 结构特点 全部单键; 饱和链烃; 四面体结构 含碳碳双键;不饱 和链烃;平面形分 子,键角 120° 含碳碳三键;不饱 和链烃;直线形分 子,键角 180° 物理性质 无色气体,难溶于水而易溶于有机溶剂 乙烷、乙烯、乙炔的比较 乙烷 乙烯 乙炔 化 学 性 质 化学活 动性 稳定 活泼 活泼 取代 反应 光照发生卤代 加成 反应 能与 H2、X2、HX、H2O、HCN 等发 生加成反应 续表 乙烷 乙烯 乙炔 化 学 性 质 氧化 反应 燃烧火焰较明 亮 燃烧火焰明亮,带 黑烟 燃烧火焰很明 亮,带浓黑烟 不与酸性 KMnO4 溶液 反应 使酸性 KMnO4 溶 液褪色 使酸性 KMnO4 溶液褪色 加聚 反应 不能发生 能发生 能发生 鉴别 溴水不褪色; 酸性 KMnO4 溶液不褪色 溴水褪色;酸性 KMnO4 溶液褪色 续表 实验室制取乙炔的注意事项 1.因电石与水反应很剧烈,应选用分液漏斗,以便控制水 的流速。 2.为获得平稳的乙炔气流,常用饱和食盐水代替水。 3.不能用启普发生器制取乙炔。因该反应剧烈,放出大量 的热,会损坏启普发生器,且生成的 Ca(OH)2 是糊状物,会堵 塞反应容器,使水面难以升降。 4.由于电石制得的乙炔中往往含有 H2S、NH3 等杂质,使 混合气体通过盛有 CuSO4 溶液的洗气瓶可使杂质除去。 炔烃的性质 【例 1】下列有关乙炔性质的叙述中,既不同于乙烯又不 同于乙烷的是( )。 A.能燃烧生成二氧化碳和水 B.能发生加成反应 C.能与酸性高锰酸钾溶液发生氧化反应 D.能与氯化氢反应生成氯乙烯 【解析】乙炔、乙烯、乙烷都能燃烧生成二氧化碳和水; 乙炔、乙烯都能与溴水发生加成反应;乙炔、乙烯都能与酸性 KMnO4 溶液发生氧化反应;只有乙炔可与 HCl 发生加成反应生 成氯乙烯。 【答案】D 1.既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔 的方法是( )。 A.通入足量的溴的四氯化碳溶液 B.与足量的氢氧化钠溶液反应 C.点燃 D.在一定条件下与氢气加成 解析:A 项,乙烷不能与溴反应,乙炔能与溴反应生成 CHBr2CHBr2 而被吸收,A 正确;乙烷、乙炔都不能与 NaOH 溶液反应,二者点燃时都能燃烧,B、C 项均错误;D 项,乙炔 与氢气反应条件要求高,且会引入新的杂质氢气,D 项错误。 答案:A 2.用乙炔为原料制取 CH2Br—CHBrCl,可行的反应途径 是( )。D A.先加 Cl2,再加 Br2 B.先加 Cl2,再加 HBr C.先加 HCl,再加 HBr D.先加 HCl,再加 Br2 乙炔的实验室制备 【例 2】用电石制备的乙炔气体中常混有少量 H2S 气体。 请用图 2-1-2 中的仪器和药品组成一套制备、净化、验证乙 炔性质的装置,并通过测定乙炔的量,从而计算电石的纯度。 图 2-1-2 (1)进行实验时,所制气体从左向右的流向,仪器的正确连 接顺序是_________________________________(填接口字母)。 (2)为了使实验中气流平稳,甲中分液漏斗里的液体 X 通常 用__________________。 (3)若在标准状况下溴水与乙炔完全反应生成 C2H2Br4,已 知称取电石 m g,测得量筒内液体体积为 V mL,则电石纯度可 表示为______________________。 (4) 若没有除 H2S 的装置,测定结果将会______( 填“偏 高”、“偏低”或“不变”),理由是______________________ _____________________________________________________。 【解析】电石与足量水反应生成乙炔,其中混有的 H2S 可 用 NaOH 溶液吸收,乙炔气体被溴水吸收后剩余部分通过排水 法测量体积。若无除 H2S 装置,则排出水的体积偏大,计算出 的结果偏高。设电石中 CaC2 的物质的量为 x。 【答案】(1)A→G→H→E→F→D→C→B (2)饱和 NaCl 溶液 (3) (4)偏高 若没有除 H2S 的装置,其中的 H2S 会与 Br2 发生 反应,消耗部分 Br2,使得排水法测得的乙炔体积增大,而在计 算中将与 H2S 反应掉的 Br2 忽略,使得计算结果偏高 A.为了加快反应速率可用饱和食盐水代替水反应 B.此反应是放热反应 C.为了除去杂质气体,除了用硫酸铜溶液外还可用氢氧 化钠溶液 D.反应中不需要加碎瓷片或沸石 解析:由于 CaC2 与 H2O 反应太剧烈,为减缓反应速率, 主要措施有:以饱和食盐水代替水;通过分液漏斗向反应器中 滴加饱和食盐水。 A 4.在室温和大气压强下,用图 2-1-3 所示的装置进行实 验,测得 a g 含 CaC2 90%的样品与水完全反应产生的气体体积 为 b L。现欲在相同条件下,测定某电石试样中 CaC2 的质量分 数,请回答下列问题: 图 2-1-3 (1)CaC2 与水反应的化学方程式是____________________。 (2)若反应刚结束时,观察到的实验现象如图 2-1-3 所示, 这时不能立即取出导气管,理由是________________________ _______________________________________________。 (3)本实验中测量气体体积时应注意到的事项有________ _______________________________________________。 (4)如果电石试样质量为 c g。测得气体体积为 d L,则电石 试样中 CaC2 的质量分数计算式 w(CaC2)=_______________。 (杂质所生成的气体体积忽略不计) b×c 答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑ (2)因为装置内气体的温度没有恢复到室温,气体压强还不 等于大气压强 (3)待装置内气体的温度恢复到室温后,调节量筒使其内外 液面持平 a×d(4) ×90%查看更多