- 2021-05-25 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习铁及其化合物作业
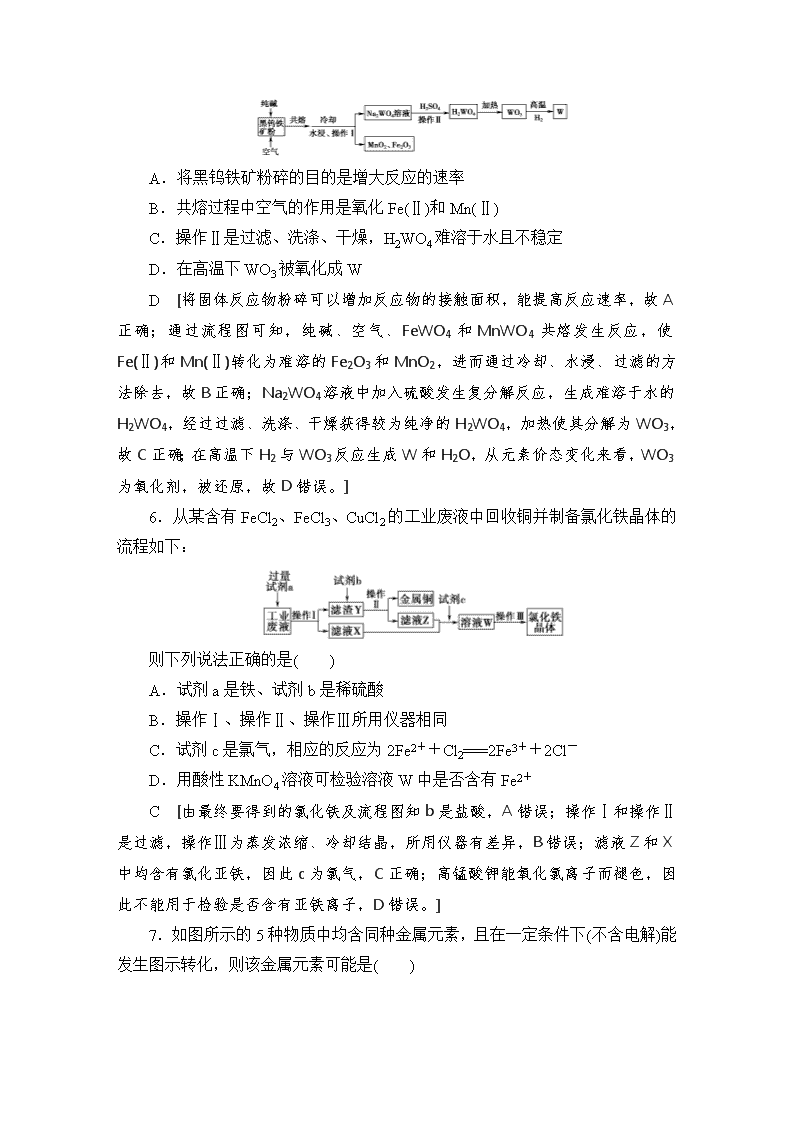
铁及其化合物 (建议用时:35分钟) 1.我国早期科技丛书《物理小识·金石类》记有“青矾厂气熏人,衣服当之易烂,载木不盛”,“青矾”即绿矾(FeSO4·7H2O),强热绿矾,得红色固体,气体冷凝得“矾油”。下列说法不正确的是( ) A.“青矾厂气”属于混合物 B.“红色固体”属于碱性氧化物 C.“矾油”能使滴有酚酞的溶液呈红色 D.“强热绿矾”发生了分解反应 C [绿矾受热发生分解反应,反应的化学方程式为2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O,因此“青矾厂气”应为SO2和SO3的混合气体,“红色固体”是Fe2O3,Fe2O3属于碱性氧化物,A、B、D项正确;“矾油”的主要成分是硫酸(SO3和H2O反应生成),不能使滴有酚酞的溶液呈红色,C项错误。] 2.向下列物质分别与少量氯水反应所得的溶液中滴入KSCN溶液,不显红色的是 ( ) A.氧化铁 B.铜铁合金 C.Fe(OH)3 D.FeCl2 B [过量的Cu、Fe均与Fe3+反应,溶液中不含Fe3+,滴入KSCN溶液,不显红色。] 3.下列关于铁及其化合物的叙述正确的是( ) A.2Fe3++Fe===3Fe2+成立,说明氧化性:Fe3+>Fe2+ B.25 ℃,pH=0的溶液中,Al3+、NH、NO、Fe2+可以大量共存 C.5.6 g铁与足量的氯气反应失去电子为0.2 mol D.硫酸亚铁溶液中加入氯水:Fe2++Cl2===Fe3++2Cl- A [B项,酸性(pH=0)条件NO氧化Fe2+;C项,n(e-)=×3 mol=0.3 mol;D项,电荷不守恒。] 4.(2019·绵阳诊断)下列有关0.2 mol·L-1 Fe(NO3)2溶液的叙述正确的是 ( ) A.该溶液中Na+、K+、[Fe(CN)6]3-、I-可以大量共存 B.滴加稀硫酸,充分振荡无现象 C.通入H2S气体,发生反应的离子方程式为Fe2++S2-===FeS↓ D.50 mL该溶液与过量Zn充分反应,生成0.56 g Fe D [Fe2+会与[Fe(CN)6]3-反应生成蓝色沉淀,因此不能大量共存,故A项错误;滴加稀硫酸,使溶液呈酸性,在酸性条件下,NO能将Fe2+氧化为Fe3+,溶液由浅绿色变为黄色,故B项错误;通入H2S气体,溶液显酸性,硝酸根在酸性条件下具有氧化性,能将硫离子氧化成硫单质、Fe2+被氧化成Fe3+,故C项错误;50 mL 0.2 mol·L-1 Fe(NO3)2溶液与过量Zn充分反应,离子方程式为Zn+ Fe2+===Zn2++Fe,计算可知生成Fe的质量为0.56 g,故D项正确。] 5.(2019·福州质检)如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( ) A.向溶液B中滴加KSCN溶液,溶液可能变为血红色 B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O C.溶液酸性:A>B>C D.加氧化亚铁可以使溶液C转化为溶液A A [溶液A转化为溶液B发生反应:2Fe3++2H2O+SO2===2Fe2++SO+ 4H+;溶液B转化为溶液C发生反应:4Fe2++O2+4H+===4Fe3++2H2O。向溶液B中滴加KSCN溶液,未与SO2反应的Fe3+与SCN-反应,有血红色出现,A项正确;溶液B转化为溶液C的离子方程式电荷不守恒,B项错误;根据反应方程式可知,溶液酸性:B>C>A,C项错误;溶液C转化为溶液A,可加入三价铁的氧化物,不能加入二价铁的氧化物,D项错误。] [教师用书独具] 钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( ) A.将黑钨铁矿粉碎的目的是增大反应的速率 B.共熔过程中空气的作用是氧化Fe(Ⅱ)和Mn(Ⅱ) C.操作Ⅱ是过滤、洗涤、干燥,H2WO4难溶于水且不稳定 D.在高温下WO3被氧化成W D [将固体反应物粉碎可以增加反应物的接触面积,能提高反应速率,故A正确;通过流程图可知,纯碱、空气、FeWO4和MnWO4共熔发生反应,使Fe(Ⅱ)和Mn(Ⅱ)转化为难溶的Fe2O3和MnO2,进而通过冷却、水浸、过滤的方法除去,故B正确;Na2WO4溶液中加入硫酸发生复分解反应,生成难溶于水的H2WO4,经过过滤、洗涤、干燥获得较为纯净的H2WO4,加热使其分解为WO3,故C正确;在高温下H2与WO3反应生成W和H2O,从元素价态变化来看,WO3为氧化剂,被还原,故D错误。] 6.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下: 则下列说法正确的是( ) A.试剂a是铁、试剂b是稀硫酸 B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同 C.试剂c是氯气,相应的反应为2Fe2++Cl2===2Fe3++2Cl- D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+ C [由最终要得到的氯化铁及流程图知b是盐酸,A错误;操作Ⅰ和操作Ⅱ是过滤,操作Ⅲ为蒸发浓缩、冷却结晶,所用仪器有差异,B错误;滤液Z和X中均含有氯化亚铁,因此c为氯气,C正确;高锰酸钾能氧化氯离子而褪色,因此不能用于检验是否含有亚铁离子,D错误。] 7.如图所示的5种物质中均含同种金属元素,且在一定条件下(不含电解)能发生图示转化,则该金属元素可能是( ) ①Na ②K ③Ca ④Fe ⑤Cu A.①② B.③④ C.④⑤ D.①⑤ C [①硝酸钠(硝酸钾、硝酸钙)无法一步转化成氢氧化钠(氢氧化钾、氢氧化钙),氢氧化钠(氢氧化钾、氢氧化钙)溶液中也无法一步生成氧化钠(氧化钾、氧化钙),氧化钠(氧化钾、氧化钙)也无法一步生成金属钠(钾、钙)(除电解方法),故①②③错误。] 8.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: 请回答下列问题: (1)证明步骤①滤液中含有Fe2+的方法:取样,先滴加KSCN溶液,再滴加________,该过程的现象为_____________________________________________ ___________________________________________________________________。 (2)步骤②加入过量H2O2的目的是____________________________________ ____________________________________________________________________。 (3)步骤③中反应的离子方程式是____________________________________ ___________________________________________________________________。 (4)步骤④中一系列处理的操作步骤:过滤、__________、灼烧、________、称量。 (5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________ g。 [答案] (1)氯水或双氧水 滴加KSCN溶液不变红,滴加氯水或双氧水后,溶液变红 (2)将Fe2+氧化为Fe3+ (3)Fe3++3NH3·H2O===Fe(OH)3↓+3NH (4)洗涤 冷却 (5)×2×56×或 9.(2019·成都模拟)某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理: 注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见表。 氢氧 化物 Fe(OH)3 Fe(OH)2 Mg(OH)2 Al(OH)3 Cr(OH)3 pH 3.7 9.6 11.1 8 9(>9溶解) (1)氧化过程中可代替H2O2加入的试剂是________(填字母,下同)。 A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4 (2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填字母,下同);已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是________。 A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+ (3)还原过程中,每消耗172.8 g Cr2O转移4.8 mol e-,该反应的离子方程式为___________________________________________________________________ ___________________________________________________________________。 [答案] (1)A (2)AB CD (3)3S2O+4Cr2O+13H2O===6SO+8Cr(OH)3↓+2OH- 10.(2019·沧州质量监测)为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( ) 溶液1 溶液2 甲 含Fe3+、Fe2+ 含SO 乙 含Fe3+,无Fe2+ 含SO 丙 含Fe3+,无Fe2+ 含Fe2+ A.只有甲 B.甲、乙 C.甲、丙 D.甲、乙、丙 C [甲、溶液1中含有Fe3+、Fe2+,说明发生反应2Fe2++Cl2===2Fe3++ 2Cl-,且Cl2反应完全,可证明还原性Fe2+>Cl-;溶液2中含有SO,则说明发生反应2Fe3++SO2+2H2O===2Fe2++SO+4H+,可证明还原性SO2>Fe2+,故甲能证明还原性SO2>Fe2+>Cl-;乙、溶液1中含有Fe3+,无Fe2+剩余,则还原性Fe2+>Cl-,但Cl2可能过量,再通入SO2,可能发生的反应是Cl2+SO2+2H2O===2Cl-+SO+4H+,不能比较SO2与Fe2+的还原性强弱,故乙不能验证;丙、溶液1中含有Fe3+,没有Fe2+,通入SO2后溶液中又含有Fe2+,说明SO2将Fe3+还原得到 Fe2+,证明还原性SO2>Fe2+,故丙实验结论能证明还原性SO2>Fe2+>Cl-。 ] 11.(2019·郑州市第一中学高三质检)常温时,将0.1 mol Fe(NO3)3和2 mol HCl溶于水得2 L混合溶液,然后向该溶液投入m g铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是 ( ) A.由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+===3Fe2+ B.当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 C.在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 D.m≥28,反应过程中溶液的质量一直在减小 B [酸性条件下,NO有强氧化性,因此首先发生的反应是Fe+NO+4H+===NO↑+Fe3++2H2O,然后发生反应:Fe+2Fe3+===3Fe2+,Fe+2H+===Fe2++H2↑,A错误;当加入16.8 g铁粉时,刚好发生上述第一个反应,生成标准状况下6.72 L NO气体,此时消耗1.2 mol H+,B正确;滴加KSCN溶液不变红色说明溶液不含Fe3+,C错误;当恰好第二个反应结束时。根据方程式计算则至少消耗铁16.8+(0.1+0.3)×0.5×56=28(g),但反应过程中溶液的质量一直在增大,D错误。] 12.(2019·甘肃重点中学联考)以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2 等)为原料制备二草酸铬钾的实验步骤如下: 已知NaFeO2遇水强烈水解:NaFeO2+2H2O===NaOH+Fe(OH)3↓。 (1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为__________________________________________ ___________________________________________________________________。 (2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl及NaFeO2等,步骤①的具体操作为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________。 (3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为_________ __________________________________________________________。 (4)由步骤③可知,溶解度:Na2Cr2O7________(填“>”“<”或“=”)K2Cr2O7。 (5)步骤④包含的具体操作有________、________、过滤并洗涤,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示) (6)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。 (7)采用热重分析法测定K[Cr(C2O4)2]·nH2 O样品所含结晶水数,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O中n=________。 [解析] (1)“熔融”时Na2CO3和NaOH均能与二氧化硅反应,而陶瓷和玻璃中均含有二氧化硅,因此只能用铁坩埚;分析反应物及生成物中各元素化合价,根据得失电子守恒、原子守恒配平该反应为6FeO·Cr2O3+7KClO3+12Na2CO3 3Fe2O3+7KCl+12Na2CrO4+12CO2↑。(2)Fe2O3难溶于水,而NaFeO2在水溶液中强烈水解生成Fe(OH)3,其他物质都易溶于水且不发生化学反应,因此水浸后过滤,滤渣的主要成分为Fe2O3和Fe(OH)3。(3)对比步骤②前后的物质可知,加入稀硫酸后Na2CrO4转化成了Na2Cr2O7,发生的反应为2CrO+2H+Cr2O+H2O。(4)加入KCl粉末,可使得Na2Cr2O7转化成K2Cr2O7,所以Na2Cr2O7的溶解度大于K2Cr2O7的溶解度。(5)根据溶解度曲线知,K2Cr2O7的溶解度随温度变化较大,则从混合溶液中得到K2Cr2O7晶体需经过加热浓缩、冷却结晶、过滤、洗涤、干燥。(6)根据题目中提到的“两种固体混合物”“研磨”,可知该仪器是研钵。(7)样品失掉全部结晶水时失重16.8%,则×100%=16.8%,解得n≈3。 [答案] (1)铁 6FeO·Cr2O3+12Na2CO3+7KClO312Na2CrO4+3Fe2O3+7KCl+12CO2↑ (2)Fe2O3、Fe(OH)3 (3)2CrO+2H+Cr2O+H2O (4)> (5)加热浓缩 冷却结晶 (6)研钵 (7)3 13.(2019·武汉模拟)某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如图所示工艺流程,制得纯净的CeO2和硫酸铁铵晶体。 已知:CeO2通常既不溶于强酸,也不溶于强碱。 回答下列问题: (1)A的化学式是________。 (2)“滤渣1”的成分是________。 (3)“反应2”中加入H2O2溶液的目的是_______________________________ ___________________________________________________________________。 (4)某同学设计实验证明“滤液1”中含有Fe2+,其操作是_______________ ___________________________________________________________________。 (5)硫酸铁铵晶体[NH4Fe(SO4)2·12H2O]广泛用于水的净化,请用离子方程式解释其净水原理:_____________________________________________________ ____________________________________________________________________, 2 mol硫酸铁铵晶体与1 mol硫酸铁相比,前者在去除废水中的悬浮物时效率______ (填“高于”“低于”或“等于”)后者。 (6)“反应3”的离子方程式为_______________________________________ ___________________________________________________________________。 [解析] 流程图中各步主要转换如下: [答案] (1)H2SO4 (2)CeO2、SiO2 (3)将CeO2还原为Ce3+,便于与SiO2分离 (4)取少量滤液1于洁净试管中,滴加K3[Fe(CN)6]溶液(或取少量滤液1于洁净试管中,滴加酸性高锰酸钾溶液) (5)Fe3++3H2OFe(OH)3(胶体)+3H+ 低于 (6)4Ce3++O2+12OH-+2H2O===4Ce(OH)4↓查看更多