- 2021-05-26 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
陕西高考化学报告会
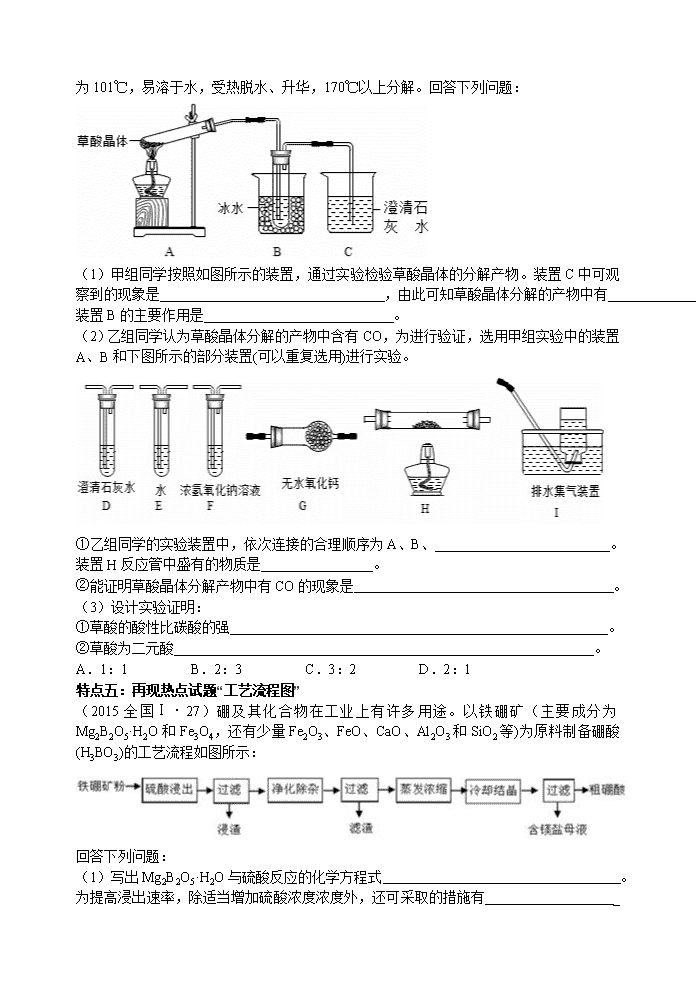
陕西2016高考(化学)报告会 西北工业大学附属中学 特级教师 彭晓泉 报告提纲 n 2015年全国卷分析 n 2016年命题趋势 n 2016年备考方案及复习建议 n 高考热点及试题分析 一、2015年高考全国卷分析 (一)2015年全国课标卷Ⅰ、Ⅱ化学试题概述 1.试卷结构 必 考 部 分 选择题 7个(42分,单选) 非选择题 3个(43分) 占总分比例 85% 选考 部 分 选择题 无 非选择题 1个(15分) 选修模块2、3、5 (3选1) ①化学与技术 ②物质结构与性质 ③有机化学基础 必修部分占比例 53%,48% 选修部分占比例 47%,52% 2.知识点分布——全国卷Ⅰ 题号 考查内容 均分 7 硝酸的强氧化性 6 8 有关NA的讨论 6 9 有机物的分子组成和结构 6 10 金属及其化合物、实验现象及结论 6 11 原电池的工作原理 6 12 物质结构、元素周期律 6 13 电解质的强弱判断及强弱电解质溶液的稀释分析 6 26 实验基础知识:草酸分解产物的检验 14 27 工艺流程图、元素及其化合物的性质、物质结构 14 28 化学平衡及平衡常数的计算、键能与焓变、有关Ksp的计算 15 36 工业制取CuCl的流程分析 15 37 电子云、化学键、原子轨道的杂化、晶体结构、晶胞的计算 15 38 官能团的名称、有机反应类型、有机物的结构和性质、简单有机流程的设计、原子共面的判断、同分异构体的判断 15 3.知识点分布——全国卷Ⅱ 题号 考查内容 分值 7 食品干燥剂的选择 6 8 酯水解产物的判断 6 9 物质结构、元素周期律 6 10 有关NA的讨论 6 11 同分异构体数目的判断 6 12 海水提溴、海水提镁 6 13 实验方案的设计与评价、元素化合物的性质 6 26 原电池、物质的分离和提纯、电化学的计算、有关Ksp的计算 13 27 键能与焓变、盖斯定律、影响化学平衡的因素、平衡常数表达式的书写 15 28 实验:物质的制备、实验方案的设计、氧化反应反应、电解原理及其应用、计算 15 36 工业上可用异丙苯氧化法生产苯酚和丙酮的工艺流程图分析 15 37 元素推断、核外电子排布、电负性、空间构型、杂化轨道及晶胞结构与计算等 15 38 有机反应类型、有机物的结构和性质、研究有机物的方法、有机物的命名、 同分异构体数目的判断、聚合度的计算 15 5. 试题特点 u 总体评价、夯实基础、回归课本、提升能力、难度降低、元素化合物量大 特点一:试题以传统文化为背景 (2015全国Ⅰ·7)我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( ) A.氨水 B. 硝酸 C.醋 D.卤水 特点二:经典题型常考常新 第8题有关NA的讨论,第10题实验基础知识,第11题原电池的工作原理,第12题物质结构、元素周期律。 特点三:必考有机题设问角度发生变化 (2015全国Ⅰ·9)乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )A.1:1 B.2:3 C.3:2 D.2:1 特点四:实验题由有机物的制备变为无机实验的探究 (2015全国Ⅰ·26)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O) 无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题: (1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 。装置B的主要作用是 。 (2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。 ①乙组同学的实验装置中,依次连接的合理顺序为A、B、 。装置H反应管中盛有的物质是 。 ②能证明草酸晶体分解产物中有CO的现象是 。 (3)设计实验证明: ①草酸的酸性比碳酸的强 。 ②草酸为二元酸 。 A.1:1 B.2:3 C.3:2 D.2:1 特点五:再现热点试题“工艺流程图” (2015全国Ⅰ·27)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 回答下列问题: (1)写出Mg2B2O5·H2O与硫酸反应的化学方程式 。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有 _ (写出两条)。 (2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(化学式)。 (3)“净化除杂”需先加H2O2溶液,作用是_______。然后在调节溶液的pH约为5,目的是 。 (4)“粗硼酸”中的主要杂质是 (填名称)。 (5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为 。 (6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程 。 解题方法: 一、搞清生产目的: 二、挖掘有效信息:“题干、路线、文献、资料、设问”一并看;“前后信息”对比看。 特点六:理在书中,题在书外 复习时一定要夯实基础、回归课本,对书中主干知识的理解一定要深刻,对知识的描述一定要准确、完整。 老师命不出高考题,学生也刷不出高考题,所以不要过渡训练,沉在题海中。复习中一定要注重对知识的归纳和整理,提炼方法、提升能力。 二、2016年高考化学试题的命题趋势 u 基础、能力、陌生度、综合度、区分度 三、2016年高考化学备考方案及复习建议 1.提前准备、周密计划,缜密安排 ⑴要求教师和学生在暑期做2015年全国各地高考化学试题。开学第一周备课组召开研讨会,对比分析高考试题,尤其是全国课标卷Ⅰ、Ⅱ;找出试题特点,把握高考试题的命题方向。 ⑵与上一届教师交流,结合学生实际情况,制订出2016年高考化学学科备考方案。具体方案如下: 复习时间安排 具体要求 2015年暑期 做高考试题,召开研讨会,制订三轮复习计划 2015年9月1日至 2016年3月30日 一轮复习—— 整合模块、章节推进,扎实有序,夯实基础。 2016年4月1日 至2016年5月10日 二轮复习——专题训练,强化主干,查漏补缺。 2016年5月16日 2016年5月30日 三轮复习——自主复习真题模拟、归纳技巧。 考前一周 考前休整——调整心态、提高信心 2.认真研读考纲,研究高考试题,但不能拘泥于考纲,要按教材、按《课程标准》该讲到的,逐一讲到,拓展到。 3.建议选修模块“结构”和“有机”均复习。 4. 要命制高质量的模拟题、理综训练题,试题的素材背景要新、要有陌生度,选择题的备选项要有迷惑性、要有干扰,要有思维含量。 5.大练习题的题量不要太大,一定要精,要留给学生思维的空间。 6.真题模拟及理综练习:11月初开始,交叉进行,大约16次~18次,2016年元月开始选择题专项训练每周一次共10次。 Ø 如何审题? Ø 看→标→析→写 “标”正确、不正确、错误、一定、可能、序号、字母、名称、符号、化学式、结构简式、化学方程式、离子方程式、热化学方程式、原子、离子……质量、物质的量……等 慢看,快写;写工整,写规范,写要点。 审没审,标了算;没有标,易出错。只有真懂,才能分析对。 四、高考热点、试题分析 热点一:化学用语与STSE (2015江苏·2)下列有关氯元素及其化合物的表示正确的是( ) A.质子数为17、中子数为20的氯原子: B.氯离子(Cl-)的结构示意图: C.氯分子的电子式: D.氯乙烯分子的结构简式:H3C-CH2Cl (2015全国Ⅱ·7)食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是 A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 H2、Cl2、N2、氢化物、 H2O2 、CO2;NaCl、MgCl2、K2O、NaOH、Na2O2、CaC2; 羟基、氢氧根离子、简单有机物等的电子式一定要会写! 热点二:化学计量 (2015全国Ⅰ·8)NA为阿伏伽德罗常数的值。下列说法正确的是( ) A.18gD2O和18gH2O中含有的质子数均为10NA B.2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA (2015全国Ⅱ·10)NA代表阿伏加德罗常数的值。下列叙述正确的是 A.60g丙醇中存在的共价键总数为10NA B.1L 0.1mol·L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1NA C.钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1NA D.235g核素U发生裂变反应:U+nSr+U+10n净产生的中子(n)数为10NA (2015全国Ⅱ·7)食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是 A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 有关NA的讨论题,应注意: 1.体积→状态→温度和压强。如标准状况下的水、HF、溴、SO3、 NO2、CCl4、CH3Cl、己烷、苯等。 2.给出非标准状况下气体的物质的量、质量或粒子数均与温度、压强等外界条件无关。 3.弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系。常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子,及O3、P4、18O2、D2O、Na2O2、CH4、CO2、C2H4……等。 4.溶液中的隐含条件: (1)是否有弱离子的水解。 (2)是否指明了溶液的体积。 (3)所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液c(H+)=0.1 mol·L-1,与电解质的组成无关;0.05 mol·L-1的Ba(OH)2溶液,c(OH-)=0.1 mol·L-1,与电解质的组成有关。 5. “隐含反应”,如: (1)2SO2+O2 2SO3 N2+3H2 2NH3 2NO2N2O4 (2)Cl2+H2OHCl+HclO (3)NH3+H2ONH3·H2ONH4++OH- 6.氧化还原反应中转移电子数目判断的“陷阱”: (1)特殊的电子转移:如Cl2与水或与碱、Na2O2与水或与CO2,H2O2的分解,NO2与水,S与Fe和Cu,Cl2与Fe和Cu,NaH与水等。 (2)量不同,生成产物的价态不同,转移的电子数不同。如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。 ⑶注意氧化还原的顺序。如向FeI2和FeBr2的混合液中,通入Cl2,首先氧化I-,再氧化Fe2+,最后氧化Br-。 热点三:氧化还原反应 方法:标变价、分升降、判类型。 标变价、分升降、求相等、再计算。 标变价、分升降、求相等、填系数、观其它、再配平。 (2015上海)工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中( ) A.硫元素既被氧化又被还原 B.氧化剂与还原剂的物质的量之比为1:2 C.每生成1molNa2S2O3,转移4mol电子 D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2 热点四:离子反应 (2015安徽·10)下列有关NaClO和NaCl混合溶液的叙述正确的是: A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存 B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为: 2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 (2015四川·2)下列有关CuSO4溶液的叙述正确的是 A.该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 B.通入CO2气体产生蓝色沉淀 C.与H2S反应的离子方程式:Cu2++ S2-=CuS↓ D.与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ 热点五 物质结构 元素周期律 (2015全国Ⅰ·12)W、X、Y、Z均为的短周期元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的( ) A.单质的沸点:W>X B.阴离子的还原性:W>Z C.氧化物的水化物的酸性:Y查看更多