- 2023-09-15 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版物质的分离、提纯和检验学案
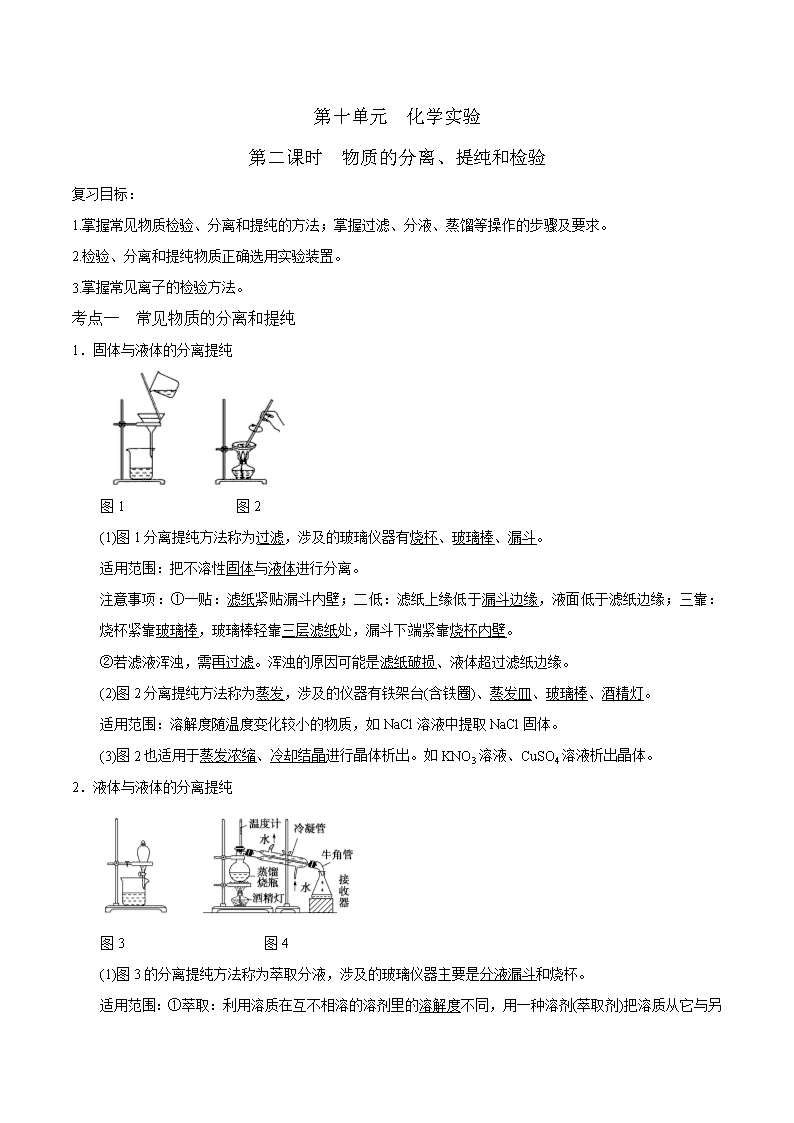
第十单元 化学实验 第二课时 物质的分离、提纯和检验 复习目标: 1.掌握常见物质检验、分离和提纯的方法;掌握过滤、分液、蒸馏等操作的步骤及要求。 2.检验、分离和提纯物质正确选用实验装置。 3.掌握常见离子的检验方法。 考点一 常见物质的分离和提纯 1.固体与液体的分离提纯 图1 图2 (1)图1分离提纯方法称为过滤,涉及的玻璃仪器有烧杯、玻璃棒、漏斗。 适用范围:把不溶性固体与液体进行分离。 注意事项:①一贴:滤纸紧贴漏斗内壁;二低:滤纸上缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。 ②若滤液浑浊,需再过滤。浑浊的原因可能是滤纸破损、液体超过滤纸边缘。 (2)图2分离提纯方法称为蒸发,涉及的仪器有铁架台(含铁圈)、蒸发皿、玻璃棒、酒精灯。 适用范围:溶解度随温度变化较小的物质,如NaCl溶液中提取NaCl固体。 (3)图2也适用于蒸发浓缩、冷却结晶进行晶体析出。如KNO3溶液、CuSO4溶液析出晶体。 2.液体与液体的分离提纯 图3 图4 (1)图3的分离提纯方法称为萃取分液,涉及的玻璃仪器主要是分液漏斗和烧杯。 适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度 不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层的分离方法。 注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应;④分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。 (2)图4的分离提纯方法称为蒸馏。 适用范围:分离沸点相差较大的互溶液体混合物。 注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处; ②蒸馏烧瓶内要加沸石防止液体暴沸;③冷凝管水流方向应为“下口进,上口出”。 3.固体与固体的分离 图5 图6 (1)图5适用于固体加热分离法,管口朝下倾斜,防止生成的液体水回流使管底炸裂,如除去Na2CO3中混有的NaHCO3固体。 (2)图6的分离提纯法称为升华法。 适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下使之分离的方法。如NaCl与I2混合物。 4.气体与气体的分离提纯 (1)固体吸收法——干燥管或U形管。如用碱石灰干燥NH3。 (2)溶液吸收法——洗气瓶。如用浓H2SO4干燥HCl、SO2等。 (3)固体加热吸收法——硬质玻璃管。如用Cu丝加热除去N2中的O2。 【深度思考】在测定Na2SO4和NaCl的混合物中Na2SO4的质量分数时,可以在混合物中加入过量BaCl2溶液,沉淀SO,然后过滤、洗涤、烘干、称量得到BaSO4的质量,试问: (1)怎样判断SO是否沉淀完全? 【答案】取上层清液少许于试管中,再加入BaCl2溶液,若产生白色沉淀,说明SO未沉淀完全,反之则沉淀完全。 (2)沉淀的洗涤方法? 【答案】 沿玻璃棒向漏斗中注水至浸没沉淀,待水自然流下后,再重复2~3次。 (3)怎样判断沉淀是否洗净? 【答案】 取最后一次洗涤液少许于试管中,滴加稀HNO3酸化的AgNO3溶液,若产生白色沉淀,说明沉淀未洗净,反之已洗净。 例1、下列实验操作能达到实验目的的是( ) A.用长颈漏斗分离出乙酸与乙醇反应的产物 B.用向上排空气法收集铜粉与稀硝酸反应产生的NO C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 【答案】C 【解析】A项在浓硫酸、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,并用饱和Na2CO3溶液吸收,由于乙酸乙酯难溶于Na2CO3溶液,吸收液中出现分层现象,最后用分液漏斗进行分液。B项NO易与空气中的O2反应生成NO2,故不能用向上排空气法收集NO,应用排水法收集。C项FeCl3易发生水解反应,故配制FeCl3溶液时,应将其固体溶于较浓的盐酸中再加水稀释,以抑制FeCl3的水解反应。D项将Cl2和HCl的混合气体通过饱和食盐水,可除去其中的HCl,但同时会混入水蒸气,欲得到纯净的Cl2,应先通过饱和食盐水,再通过盛有浓硫酸的洗气瓶进行干燥。 【发散类比1】下列实验中,所采取的分离方法与对应原理都正确的是( ) 选项 实验目的 分离方法 原理 A 除去CO2中的HCl 通入饱和Na2CO3溶液洗气 HCl与Na2CO3溶液反应生成CO2 B 除去乙醇中少量的乙酸 加入足量生石灰蒸馏 乙醇和乙酸钙的沸点相差较大 C 除去KNO3固体中的NaCl 冷却热饱和溶液重结晶 NaCl在水中的溶解度很大 D 分离乙酸乙酯和乙醇 用分液漏斗分液 乙酸乙酯和乙醇的密度不同 【答案】B 【解析】饱和Na2CO3溶液可吸收CO2,A项错误;用重结晶法除去KNO3固体中的NaCl是因为KNO3在水中的溶解度受温度的影响大,C项错误;乙酸乙酯和乙醇互溶,不能采取分液的方法分离,D项错误。 【归纳总结】 1. 物质分离提纯的“八”大化学方法 方法 原理 杂质成分 沉淀法 将杂质离子转化为沉淀 Cl-、SO、CO及能形成弱碱的阳离子 气化法 将杂质离子转化为气体 CO、HCO、SO、HSO、S2-、NH 杂转纯法 将杂质转化为需要提纯的物质 杂质中含不同价态的相同元素(用氧化剂或还原剂)、同一种酸的正盐与酸式盐(用对应的酸或碱) 氧化还原法 用氧化剂(还原剂)除去具有还原性(氧化性)的杂质 如用酸性KMnO4溶液除去CO2中的SO2,用热的铜粉除去N2中的O2 热分解法 加热使不稳定的物质分解除去 如除去NaCl中的NH4Cl等 酸碱溶解法 利用物质与酸或碱溶液反应的差异进行分离 如用过量的NaOH溶液可除去Fe2O3中的Al2O3 电解法 利用电解原理除去杂质 含杂质的金属作阳极、纯金属(M)作阴极,含M的盐溶液作电解质溶液 调pH法 加入试剂调节溶液pH使溶液中某种成分生成沉淀而分离 如向含有Cu2+和Fe3+的溶液中加入CuO或Cu(OH)2等调节pH使Fe3+转化为Fe(OH)3而除去 2.物质分离与提纯的基本原则 (1)“四原则”:不增(提纯过程中不增加新的杂质);不减(不减少被提纯的物质);易分离(被提纯物质与杂质容易分离);易复原(被提纯物质转化后要易复原)。 (2)“四必须”:除杂试剂必须过量;过量试剂必须除尽(因为过量试剂带入新的杂质);选最佳除杂途径;除去多种杂质时必须考虑加入试剂的顺序。 3.气体除杂的三个要点 (1)选择除杂试剂的依据:主体气体和杂质气体性质的差异,如溶解性、熔沸点、酸碱性、氧化性、还原性等。 (2)气体除杂的四个原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置中进行;④先除易除去的气体。 (3)常用的除杂装置:洗气瓶、干燥管、U形管、硬质玻璃管等。 考点二 物质的检验 自主梳理 1、常见阳离子的检验:根据离子检验时生成物所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。 常见阳离子 试剂或方法 实验现象 Na+ 焰色反应 黄色火焰 K+ 焰色反应 紫色火焰(透过蓝色钴玻璃) Fe2+ ①NaOH溶液 ① 白色沉淀→灰绿色→红褐色 ②先加KSCN溶液,再加氯水 ②先无明显变化,再变血红色 Fe3+ ①NaOH溶液 ①生成红褐色沉淀 ②KSCN溶液 ②溶液呈血红色 ③苯酚溶液 ③溶液呈紫色 NH4+ NaOH溶液,加热 产生使湿润的红色石蕊试纸变蓝的气体 2、常见阴离子的检验 ①OH-:能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 ②Cl-:能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。 ③Br-:能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。④I-:能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。 ⑤SO42-:能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。 ⑥SO32-:浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。 ⑦CO32-:能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。 ⑧HCO3-:取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。 ⑨NO3-:浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。 3、常见气体的检验:检验气体是根据气体的特性,一般从以下5方面考虑:①气体的颜色和气味;②水溶液的酸碱性;③助燃、可燃及燃烧现象和产物;④遇空气的变化;⑤其他特性。 待检物 操作步骤 现 象 O2 用试管或集气瓶取待检气体,然后向试管或集气瓶中插入带有火星的木条 带火星的木条复燃 H2 使待检气体通过尖嘴玻璃导气管并点燃,在火焰上方罩一个干而冷的烧杯 有浅蓝色火焰,烧杯里有水雾生成 NH3 ①用湿润的红色石蕊试纸检验 变蓝色 ②把待检气体收集在集气瓶里,盖上玻璃片,用玻璃棒蘸取浓盐酸,开启玻璃片放在瓶上方 生成白烟 SO2 在洁净试管里加入5 mL品红溶液,再通入待检气体 品红溶液褪色,加热后又红恢复红色 CO2 通入澄清石灰水中 石灰水变浑浊,继续通入后变澄清 Cl2 用湿润的KI-淀粉试纸靠近集气瓶口 变蓝色 【深度思考】设计实验证明Fe3O4中含有+2价和+3价铁元素。 【答案】取待测物于试管中加入足量稀H2SO4充分溶解,将溶液分装两支试管A和B,向A试管中加入KSCN溶液,溶液变红色,证明含有Fe3+,然后再向B试管中加入酸性KMnO4溶液,紫色褪去(其他合理答案均可)。 例2、下列实验的有关叙述正确的是________(填序号) (1)向某溶液中加入NaOH溶液,有白色沉淀生成,则原溶液中一定含有Al3+ (2)向某溶液中加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液中一定含有Cl- (3)向某溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO或SO (4)某无色溶液焰色反应呈黄色,则该溶液中一定含有Na+ (5)将光亮的镁条放入pH为8.6的NaOH溶液中有气泡产生,可以说明弱碱性溶液中的OH-氧化了Mg (6)向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色可以得出溶液中一定含Fe2+ (7)在未知液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知液中存在SO或SO (8)某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- (9)在溶液中加NaOH溶液有红褐色沉淀,说明溶液含Fe3+不含Mg2+、Fe2+、Al3+ 【答案】(4) 【解析】(1)可能含Mg2+;(2)不能加稀HCl检验Cl-;(3)可能含HCO或HSO;(5)H+氧化了Mg;(6)Fe3+干扰;(7)Ag+干扰;(8)原溶液含I2;(9)可能含Mg2+、Fe2+、Al3+。 例3、下列关于气体的检验不正确的是( ) A.能使品红溶液褪色且使澄清石灰水变浑浊的无色气体为SO2 B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 C.能使湿润的红色石蕊试纸变蓝的气体为NH3 D.能使酸性KMnO4溶液、溴水均褪色的气体为乙烯 【答案】D 【发散类比2】在允许加热的条件下,只用一种试剂就可以鉴别氯化钾、碳酸钾、偏铝酸钾、氢氧化钾、氢氧化钡、氯化钡6种溶液,这种试剂是( ) A.H2SO4 B.(NH4)2SO4 C.NH3·H2O D.NH4HSO4 【答案】D 【解析】A项无法将KCl、KOH区别开;B项无法将KCl和K2CO3鉴别开;C项均无法区别;D项加入NH4HSO4溶液后有气体生成的是K2CO3,有白色沉淀的是KAlO2、Ba(OH)2、BaCl2三种,加热后有NH3放出的是Ba(OH)2,另两种继续加NH4HSO4,溶解的是Al(OH)3沉淀,对应原KAlO2,不溶解的对应BaCl2。另两种加入少量NH4HSO4,加热有NH3生成的是KOH,另一种为KCl。 【归纳总结】 1.物质检验的一般答题模板 (1)分别取固体少许于试管中加热或加入……试剂,现象是……,是……物质。 (2)分别取固体少许于试管中溶于水形成溶液,加……试剂,现象是……,是……物质。 (3)分别取溶液少许于试管中,分别加入……试剂,现象是……,为……物质。 (4)分别取溶液少许于试管中,分别加入……试剂,现象是……,继续加入……试剂,现象是……,为……物质。 注意:①不能原瓶操作;②不能“指名道姓”,应取“待测物”。 2.限用一种试剂的物质鉴别方法 ①先分析被鉴别物质的水溶性、密度、溶液的酸碱性,确定能否选用水或指示剂进行鉴别。 ②在鉴别多种酸、碱、盐的溶液时,可依据“相反原理”确定试剂进行鉴别。即被鉴别的溶液多数呈酸性时,可选用碱或水解呈碱性的盐溶液作试剂;若被鉴别的溶液多数呈碱性时,可选用酸或水解呈酸性的盐溶液作试剂。 ③常用溴水、新制氢氧化铜悬浊液等作试剂鉴别多种有机物。 3.不另加试剂鉴别的一般分析思路 ①先依据外观特征,鉴别出其中的一种或几种,然后再利用它们去鉴别其他物质。 ②若均无明显外观特征,可考虑能否用加热或焰色反应区别开来。 ③若以上两种方法都不能鉴别时,可考虑两两混合或相互滴加,记录混合后的反应现象,分析确定。 ④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同、现象不同而进行鉴别。 ⑤若采用上述方法鉴别出一种物质后,可用它作试剂鉴别余下的其他物质。 例4、某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为( ) A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO4 【答案】C 【解析】A项中,NaHCO3、Al(OH)3加入足量水中,NaHCO3溶解,Al(OH)3不溶解;加入稀盐酸,固体全部溶解,且有气泡产生;NaHCO3、Al(OH)3均能与H2SO4反应,最后不会有固体剩余。B项中,NaHCO3溶于水,AgCl不溶于水,加入足量稀盐酸,AgCl仍不溶解。C项中Na2SO3溶于水,BaCO3不溶于水,BaCO3能溶于稀盐酸:BaCO3+2HCl===BaCl2+H2O+CO2↑,Na2SO3、BaCO3均能与稀H2SO4反应:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O、BaCO3+H2SO4===BaSO4+H2O+CO2↑。D项中,CuSO4和Na2CO3都能溶于稀硫酸。 【发散类比3】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH、Mg2+、Al3+、SO、NO、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验: 已知:3NO+8Al+5OH-+2H2O3NH3↑+8AlO 根据以上的实验操作与现象,该同学得出的结论不正确的是( ) A.试样中肯定存在NH、Mg2+、SO和NO B.试样中一定不含Al3+ C.试样中可能存在Na+、Cl- D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4 【答案】B 【解析】由气体1使湿润红色试纸显蓝色的现象,确定气体1为氨气,溶液中一定存在NH;由沉淀2与酸反应的现象判断其成分中一定有碳酸钡,可能存在氢氧化铝,所以B项错误;由溶液2与Al/OH-反应:3NO+8Al+5OH-+2H2O3NH3↑+8AlO确定溶液中一定存在NO;由沉淀1加酸后,沉淀部分溶解,确定其中沉淀溶解的部分为氢氧化镁,未溶解的部分为硫酸钡,所以确定溶液中存在SO和Mg2+,A项正确;Na+、Cl-无法确定是否存在,C、D项正确。 【归纳总结】离子推断中的“四项基本原则”查看更多