- 2023-09-01 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020北京市高考压轴卷 化学
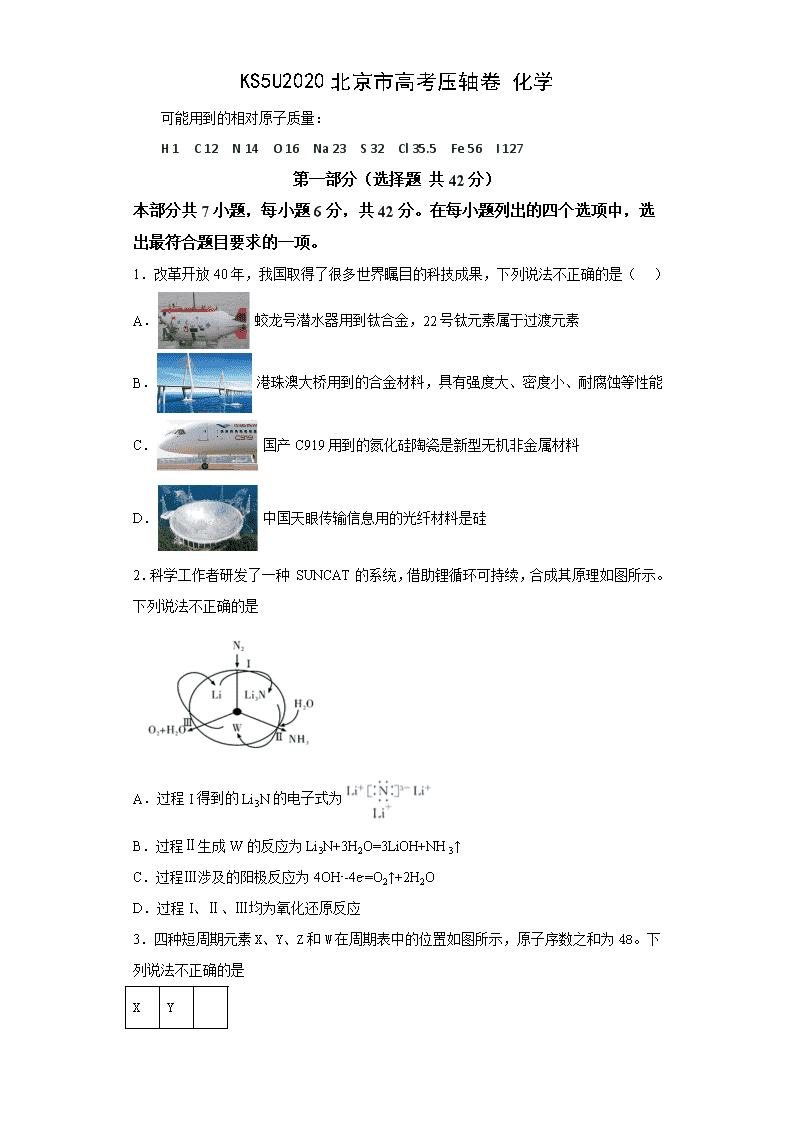
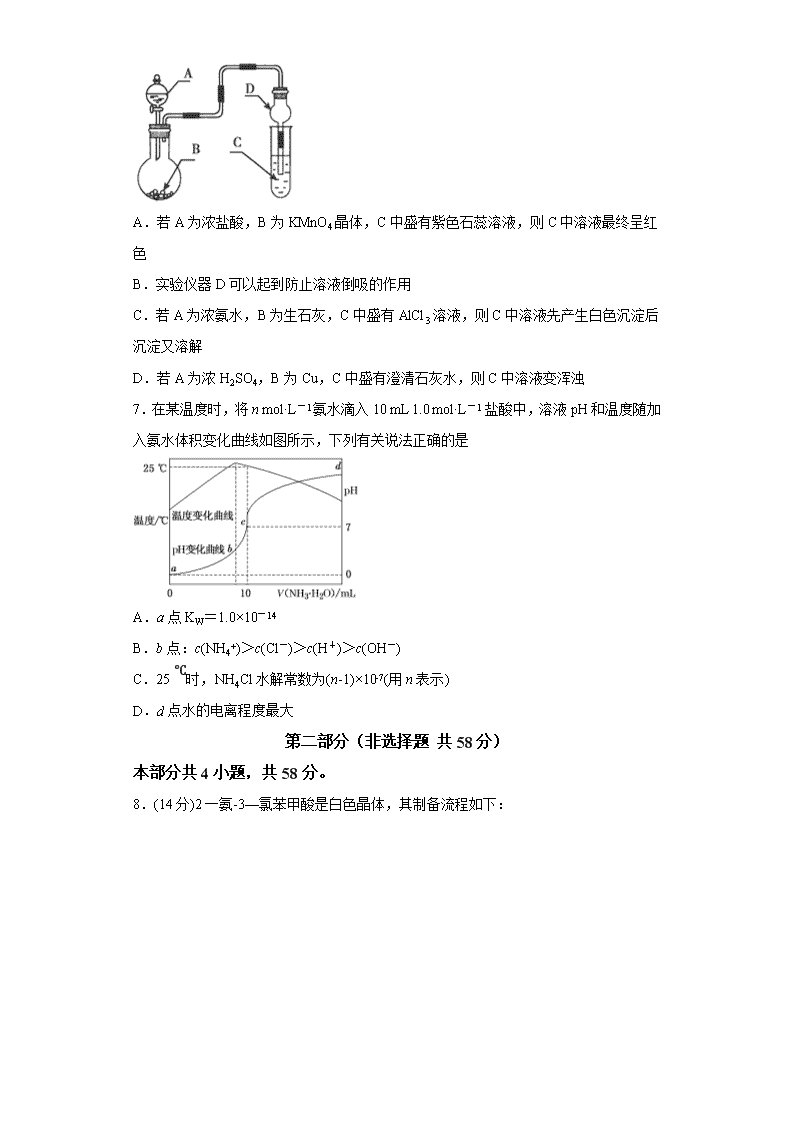
KS5U2020北京市高考压轴卷 化学 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 I 127 第一部分(选择题 共42分) 本部分共7小题,每小题6分,共42分。在每小题列出的四个选项中,选出最符合题目要求的一项。 1.改革开放40年,我国取得了很多世界瞩目的科技成果,下列说法不正确的是( ) A. 蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素 B. 港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能 C. 国产C919用到的氮化硅陶瓷是新型无机非金属材料 D. 中国天眼传输信息用的光纤材料是硅 2.科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续,合成其原理如图所示。下列说法不正确的是 A.过程I得到的Li3N的电子式为 B.过程Ⅱ生成W的反应为Li3N+3H2O=3LiOH+NH3↑ C.过程Ⅲ涉及的阳极反应为4OH--4e-=O2↑+2H2O D.过程I、Ⅱ、Ⅲ均为氧化还原反应 3.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是 X Y Z W A.原子半径(r)大小比较r(X)>r(Y) B.X和W可形成共价化合物XW3 C.W的非金属性比Z的强,所以W氢化物的沸点比Z的高 D.Z的最低价单核阴离子的失电子能力比Y的强 4.乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图: 下列说法正确的是( ) A.反应①、②均是取代反应 B.反应③、④的原子利用率均为100% C.与乙酸乙酯互为同分异构体的酯类化合物有2种 D.乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别 5.将一定量的SO2通人FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是 选项 操作 现象 A 加入NaOH溶液 有红褐色沉淀 B 加入Ba(NO3)2溶液 有白色沉淀 C 加入3酸性KMnO4溶液 紫色褪去 D 加入K3[Fe(CN)6](铁氰化钾)溶液 有蓝色沉淀 A.A B.B C.C D.D 6.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( ) A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色 B.实验仪器D可以起到防止溶液倒吸的作用 C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解 D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊 7.在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是 A.a点KW=1.0×10-14 B.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) C.25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示) D.d点水的电离程度最大 第二部分(非选择题 共58分) 本部分共4小题,共58分。 8.(14分)2一氨-3—氯苯甲酸是白色晶体,其制备流程如下: 回答下列相关问题 (1) 的名称是___________,2-氨-3-氯苯甲酸中含N官能团的电子式为___________。 (2)反应①中R代表的是___________,反应②的反应类型为___________。 (3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式___________。 (4)A的结构简式为___________,⑥的反应条件为___________。 (5)符合下列条件的同分异构体的结构简式为___________。 a 式量比大42的苯的同系物; b 与酸性KMnO4反应能生成二元羧酸 c 仅有3种等效氢 (6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。 分析产率提高的原因是___________。 9.(14分)聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁()的工艺流程如下: (1)酸浸时最合适的酸是_____(写化学式)。 (2)酸浸后溶液中主要的阳离子有_____。 (3)加入KClO3的目的是_____________________________(结合离子方程式说明)。 (4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。 _____Fe2(SO4)3+_____H2O______Fe2(OH)x(SO4)3-+ _____ ______ (5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。 (6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作: ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。 ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。 ①该聚合硫酸铁样品中n(OH-) =_________mol。 ②已知该样品中Fe的质量分数w,则盐基度B=_______________。 10.(15分)尿素[CO(NH2)2] 是首个由无机物合成的有机化合物,通常用作植物的氮肥。合成尿素的主要反应如下: i. 2NH3(l) + CO2(g) (l)(氨基甲酸铵) △H=-a kJ/mol ii. (l) (l) + H2O(l) △H=+b kJ/mol iii. 2(缩二脲)+NH3 (副反应,程度较小) (1)实验室制取氨气的化学方程式是__________________。 (2)CO(NH2)2中C为+4价,N的化合价_______。 (3)CO2和NH3合成尿素的热化学方程式为___________________________。 (4)工业上提高氨碳比(),可以提高尿素的产率,结合反应i~iii,解释尿素产率提高的原因______。 (5)某科研小组模拟工业合成尿素,一定条件下,在0.5L的密闭容器中投入4molNH3和1molCO2,测得反应中各组分的物质的量随时间变化如图1所示: ①反应进行到10min时,用CO2表示反应i的速率υ(CO2)=________。 ②合成总反应的快慢由慢的一步决定,则合成尿素的总反应的快慢由第______步反应决定(填“i”或“ii”)。 (6)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图2)。总反应为:CO(NH2)2+H2O3H2↑+N2↑+CO2↑。 ①A电极连接电源的_______极(填“正”或“负”)。 ②A电极的电极反应为______。 11.(15分)KI用于分析试剂、感光材料、制药和食品添加剂等。 制备原理如下:反应① 3I2 +6KOH = KIO3 +5KI +3H2O反应② 3H2S +KIO3 =3S↓+KI+3H2O 按照下列实验过程,请回答有关问题。 (1)启普发生器中发生的化学方程式为______________________________,用该装置还可以制备_________(填一种气体化学式)。 (2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到 _____________(填现象),停止滴入KOH溶液;然后______(填操作),待KIO3 混合液和NaOH溶液气泡速率接近相同时停止通气。 (3)滴入硫酸溶液,并对KI混合液水浴加热,其目的是________________________。 (4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和_________,其中加入碳酸钡的作用是_______________。合并滤液和洗液,蒸发至析出结晶。滤出经干燥得成品。 (5)如果得到3.2g硫单质,则理论上制得的KI为_________g。 答案和解析 1.【KS5U答案】D 【KS5U解析】 A. 蛟龙号潜水器用到钛合金,22号钛元素,位于第四周期,第IVB族,属于过渡元素,故A正确; B.合金材料,一般具有强度大、密度小、耐腐蚀等性能,故B正确; C.氮化硅陶瓷是新型无机非金属材料,故C正确; D. 中国天眼传输信息用的光纤材料是二氧化硅,故D错误;答案选D。 2.【KS5U答案】D 【KS5U解析】 A. Li3N是离子化合物,Li+与N3-之间通过离子键结合,电子式为,A正确; B.Li3N与水发生反应产生LiOH、NH3,反应方程式为:Li3N+3H2O=3LiOH+NH3↑,B正确; C.在过程Ⅲ中OH-在阳极失去电子,发生氧化反应,阳极的电极反应为4OH--4e-=O2↑+2H2O,C正确; D.过程Ⅱ的反应为盐的水解反应,没有元素化合价的变化,不属于氧化还原反应,D错误; 故合理选项是D。 3.【KS5U答案】C 【KS5U解析】 X、Y、Z、W四种短周期元素,由位置可知,X、Y在第二周期,Z、W在第三周期,设Y的原子序数为y,则X的原子序数为y-1,Z的原子序数为y+8,W的原子序数为y+9,X、Y、Z和W的原子序数之和为48,则y-1+y+y+8+y+9=48,解得y=8,所以Y为O,W为S,Z为Cl,X为N,据此解答。 A项,在同一周期内,自左向右原子核吸引核外电子的能力越强,半径逐渐减小,故A项正确; B项,X为N元素,W为Cl元素,可以形成共价化合物NCl3,故B项正确; C项,熔沸点为物质的物理性质,与分子间作用力有关,与非金属性无关,故C项错误; D项,非金属性Z查看更多