- 2021-05-24 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017中考化学推断题汇编
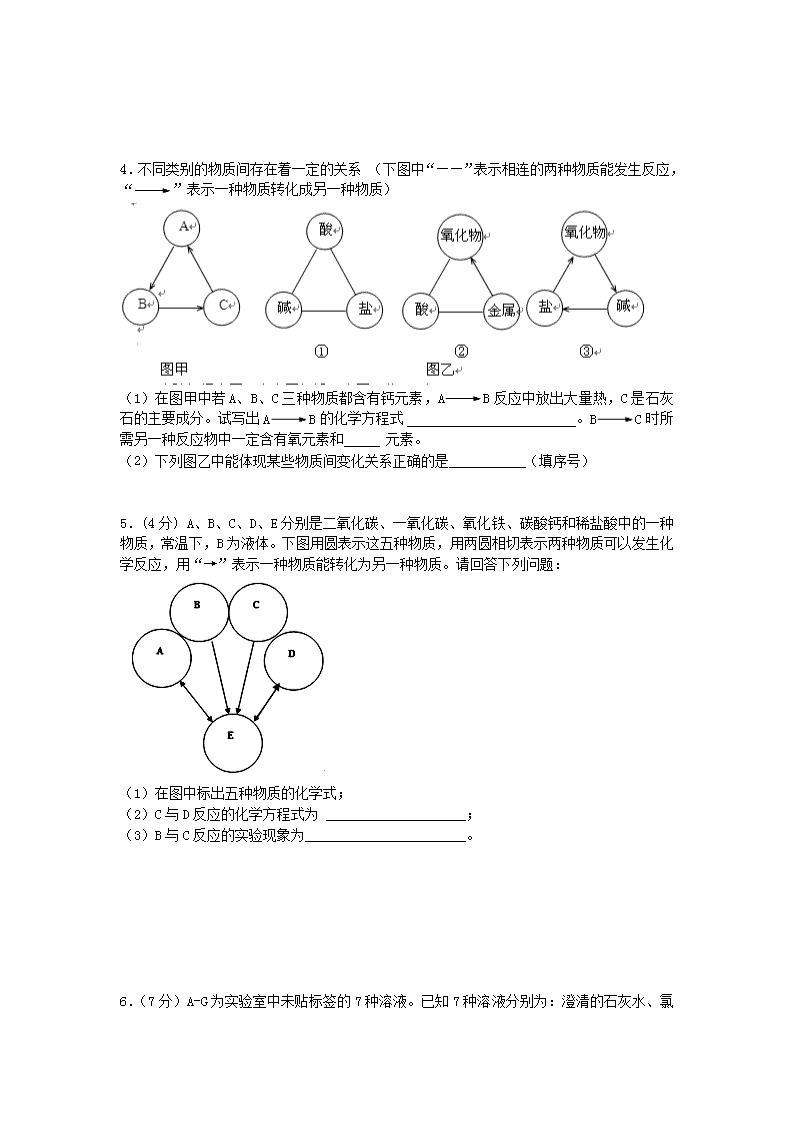
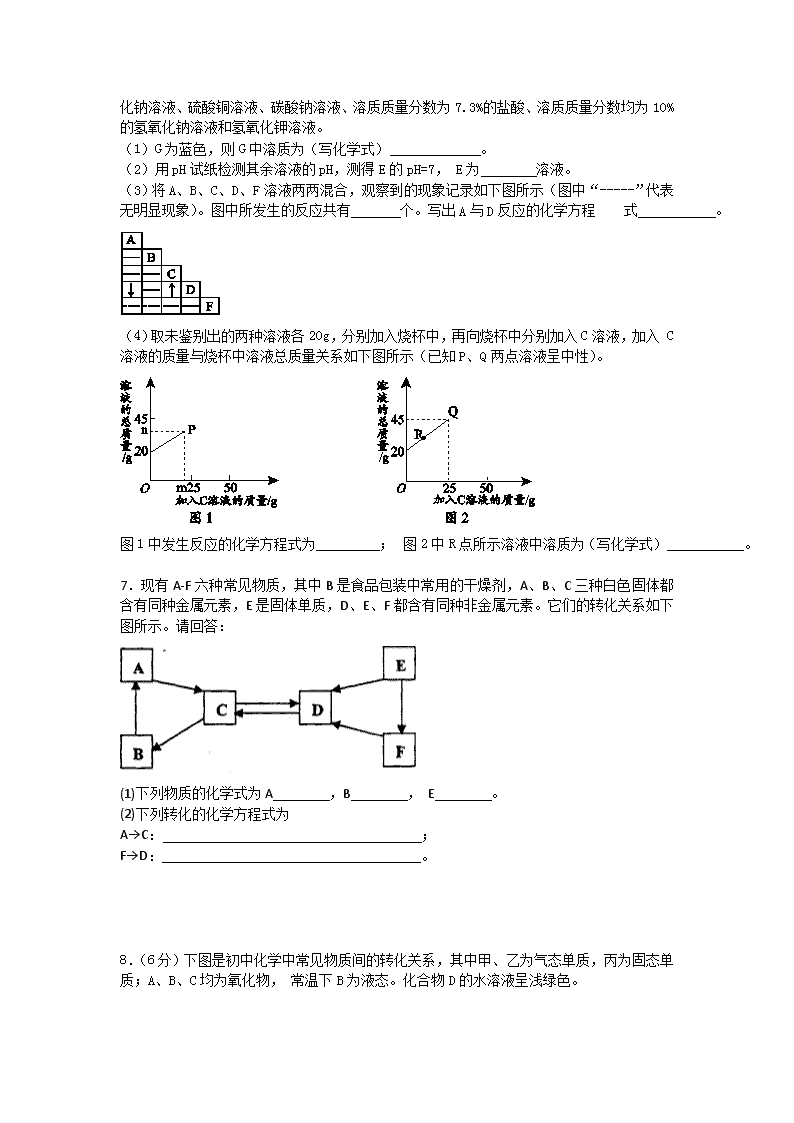
推断题1 1.下列物质均由C、Na、Cl、O、H、Ca六种元素中的两种或三种组成。根据要求回答问题: (1)上述元素中属于金属元素的是 。 (2)胃液中含有的酸 (写化学式,下同);能做为燃料的无机化合物 。 (3)A、B、C、D、E、F、G、H是初中化学常见的物质,其转化关系如图所示。 写出反应①、③的化学方程式 、 ;属于复分解反应的有 (填数字序号)。 2.已知A、B、C、D、E分别是稀盐酸、氢氧化钠溶液、硫酸铜溶液 、氧化铁和一氧化碳中的一种,E是实验室一种常见溶液,它们之间的关系如图所示,“——”两端的物质在一定条件下可以反应。请回答: E D A B C (1)C的一种用途是 ;D、E反应的化学方程式为 。 (2)上述各物质间的反应均可用“甲+乙→丙+丁”表示,其中不属于四种基本反应类型,但能用上式表示的一个化学方程式是 。 (3)若B、C、D、E都不变,五种物质之间的关系也不变,A还可能是 _。 3.A﹣F和X都是初中化学中的常见物质,其中A、C是无色气体,B、F是红色固体,它们的转化关系如图所示(部分生成物已省略): (1)写出反应①的化学方程式 。 (2)写出反应②的化学方程式 ,该反应属于 (填写基本反应类型)反应。 (3)含D的生产、生活用品腐蚀的过程,实际上是D与空气中的 发生化学反应的过程。 4.不同类别的物质间存在着一定的关系 (下图中“——”表示相连的两种物质能发生反应,“”表示一种物质转化成另一种物质) (1)在图甲中若A、B、C三种物质都含有钙元素,AB反应中放出大量热,C是石灰石的主要成分。试写出AB的化学方程式 。BC时所需另一种反应物中一定含有氧元素和 元素。 溶解度(g/100g水) 压强(Pa) t1 t2 0 (2)下列图乙中能体现某些物质间变化关系正确的是 (填序号) 5.(4分) A、B、C、D、E分别是二氧化碳、一氧化碳、氧化铁、碳酸钙和稀盐酸中的一种物质,常温下,B为液体。下图用圆表示这五种物质,用两圆相切表示两种物质可以发生化学反应,用“→”表示一种物质能转化为另一种物质。请回答下列问题: (1)在图中标出五种物质的化学式; (2)C与D反应的化学方程式为 ____________________; (3)B与C反应的实验现象为_______________________。 6.(7分)A-G为实验室中未贴标签的7种溶液。已知7 种溶液分别为:澄清的石灰水、氯化钠溶液、硫酸铜溶液、碳酸钠溶液、溶质质量分数为7.3%的盐酸、溶质质量分数均为10%的氢氧化钠溶液和氢氧化钾溶液。 (1)G为蓝色,则G中溶质为(写化学式) 。 (2)用pH试纸检测其余溶液的pH,测得E的pH=7, E为 溶液。 (3)将A、B、C、D、F溶液两两混合,观察到的现象记录如下图所示(图中“-----”代表无明显现象)。图中所发生的反应共有 个。写出A与D反应的化学方程 式 。 (4)取未鉴别出的两种溶液各20g,分别加入烧杯中,再向烧杯中分别加入C溶液,加入 C溶液的质量与烧杯中溶液总质量关系如下图所示(已知P、Q两点溶液呈中性)。 图1中发生反应的化学方程式为 ; 图2中R点所示溶液中溶质为(写化学式) 。 7.现有A-F六种常见物质,其中B是食品包装中常用的干燥剂,A、B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素。它们的转化关系如下图所示。请回答: (1)下列物质的化学式为A ,B , E 。 (2)下列转化的化学方程式为 A→C: ; F→D: 。 8.(6分)下图是初中化学中常见物质间的转化关系,其中甲、乙为气态单质,丙为固态单质;A、B、C均为氧化物, 常温下B为液态。化合物D的水溶液呈浅绿色。 (1)写出有关物质的化学式: A 、X ; (2)指出反应④在生产实际中的应用: (举一例说明); (3)将A、C两种氧化物区别开来,可使用的一种溶液为 (填名称); (4)写出下列反应的化学方程式:④ 。 ⑤ 9.(11分)(13分) 单质B是一种常见且用途广泛的金属,B元素在地壳中含量仅次于铝,已知金属B能发生如下一系列变化:试推断: (1)写出A—E的名称:A_______ B._____ C.______ D.______ E.________。 (2)写出①—④各步反应的化学方程式: ①___________;②_______③_____④_______ 10 .通过学习化学,我们了解了某些物质的性质以及物质之间的相互转化关系。如图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是空气中含量最多的物质;常温下,丁为黑色固体,戊为紫色金属;G是一种具有刺激性气味的气体,其水溶液显碱性,工业上用甲和丙化合制备G;农业上常用F改良土壤(如图中部分反应条件已省略)。回答下列问题: (1)D为 ;G为 . (2)H和E反应生成C和戊的化学方程式为 : 11.(5分)A、B是初中化学实验室常见的两种溶液,用四个圆表示四种物质。用两圆相切表示两种物质可以发生反应,用“”表示通过一步反应能转化成该物质,请回答下列问题: (1)请写出A、B两种溶液中溶质的化学式是 A___________;B_____________; (2)写出A与B反应的实验现象为:________________; (3)写出B与铁反应的化学方程式__________________。 12.已知A、B、C、D、E是初中化学中常见的五种物质。其中A、D是黑色固体,B、C、E是无色气体,B的相对分子质量小于C,D中含有使用最广泛的金属元素,它们在一定条件下的转化关系如图所示(其他反应物和生成物已略去)。 请回答下列问题: ⑴C是 (填化学式); ⑵写出E转化成D的化学方程式 ; ⑶写出B在高温条件下还原D的化学方程式 _; ⑷评述B物质的“利”与“弊”: 13.初中常见A、B、C、D、E五种物质中均含铜元素,它们之间的相互转化关系如图.已知A在空气中加热生成黑色物质B;E溶液与铁反应可得到A,与氯化钡溶液反应可得到D ,同时有白色沉淀生成;D溶液中加入少量的氢氧化钠溶液得到C,结合信息推断: (1)B的化学式是 _________ . (2)D→C的反应基本类型是 _________ . (3)写出以下转化的化学方程式: C→E: _________ ; E→A: _________ ; E→D: _________ . 14.A~H都是初中化学常见物质,已知,B为黑色固体,D为红色固体的单质,F为红色固体的化合物,它们的转化关系如下图所示: +H ④ D G E ③ +F 高温 C +A高温 ② 高温 ① A B ④ ③ ⑴ C物质的化学式分别是:C ; ⑵ 反应①的化学方程式为 15.如图所示A~G是初中化学常见的物质.图中“→”表示转化关系,“﹣”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B和C含有相同的元素. (1)写出F的化学式并标出各元素的化合价 ; (2)C和D之间的反应需要高温条件,且观察到黑色 固体变为光亮的紫红色,写出它们发生反应的化学方程式: . (3)A和E发生反应的化学方程式是 ,该反应属于四种基本反应类型中的 反应. 16.(8分) A~G 是初中常见的物质。其中 E 为黑色固体。下图为这些物质的转化关系图,其中部分生成物和反应条件已省略。 (1)写出下列物质的化学式:E ,G 。 (2)化学反应常伴有能量变化。B 与水反应时会 ( 填“吸收”或“放出”)热量。 (3)实验室不用 A 与稀硫酸反应来制取 C,原因是 。 (4)写出 F+G 的化学方程式: 。 (5)写出E→G反应的化学方程式: 17.下图是常见物质转化关系图(个别产物可能略去),其中A、B常温下均为液态,且组成元素相同;Y为氧化物,Z是紫红色固体。 (1)在反应①中,物质X起的可能是 作用。 (2)A是 (填化学式,下同);Z是 (3)反应④、⑤的化学方程式分别为 、 (4)反应①~⑥涉及的基本反应类型共有 种。 18.A、B、C、D、E、X、Y、Z都是初中化学中的常见物质,其中A是天然气的主要成分,X、Y、Z是单质,B、C、D、E是氧化物,常温下C是液体,Y是黑色固体,E是红棕色粉末。它们之间有如下反应关系: 请根据以上信息回答下列问题: (1)有关物质的化学式:A为 ,C为 。 (2)B与Y反应的化学方程式为 , D与E反应的化学方程式为 。 19.(7分)A、B、C、D、E、F、G、H、I都是初中化学学过的物质。其中B为红色固体,D为混合物,E、H均为黑色固体,F是一种无色气体。它们之间有下图的转化关系( 部分生成物已省去)。 △ ① (1)用化学式表示D的组成 、 。 (2)F→G的反应类型为 。图中①表示的反应条件是: (3)指出B的用途 。(写一种); (4)写出F→E的化学方程式 。 20.将化学反应进行分类有助于学习. (1)甲物质与盐酸反应时生成物中有NaCl和H2O,甲物质可以是 、 (填两种不同类别物质的化学式);上述转化中,属于中和反应的化学方程式是 . (2)乙物质与O2反应生成CO2和H2O,乙物质可以是 、 (填常温常压下不同状态的两种物质). (3)A、B、C、D、E 都是初中化学常见的物质,它们之间的转化关系如图所示(部分生成物略去). ①若图中E为一种酸,则反应A+B→C+D 的化学方程式是 . ②若图中E不属于酸类物质,则反应A+B→C+D 的化学方程式是 . 21.如图是中学常见物质的转换关系图,其中A、B常温下都为无色液体,且组成元素相同.A、B、X、Y、E都为氧化物,X、E都为黑色固体,Y可用作干燥剂,F是大理石的主要成分,I为蓝色沉淀,L为不溶于稀硝酸的白色沉淀.请回答: (1)X在反应①中起 作用. (2)写出反应⑥的化学方程式 . (3)写出L的化学式 . (4)写出G在空气中变质发生反应的化学方程式 . 22.(4分)下图中的A~K分别代表初中化学中的常见物质。已知:G的浓溶液能使小木棍变黑,E、J为金属单质,K为蓝色不溶物,图中部分反应物或生成物及反应条件未标出。 请回答下列问题: (1)G的化学式为 ,K的化学式为 。 (2)写出 J与I反应的化学方程式: ; 23.(4分)A-G和X都是初中化学中的常见物质,其中A、C、E是无色气体,B是红棕色固体,X为蓝色溶液,它们的转化关系如下图所示(部分反应物、生成物已省略): (1)G的化学式是 ; (2)写出反应①的化学方程 ; (3)写出在自然界普遍存在反应②,其名称为 (4)D与X充分反应后过滤后得滤渣F,在滤渣F中加入稀盐酸,有气泡产生,则滤渣的成分是 ____ 。 24.(7分)某学习小组的同学以盖房子的游戏来建立几种重要物质之间的联系,如图,游戏规则是上、下相邻的物质间均可发生反应。 (1)根据规则从CaCO3、CuSO4、KOH、CuO、CO2中为右图①、②、③处选出合适的物质并填空。 ①是 、②是 、③是 。 (2)写出图中涉及到的两个反应的化学方程式: 置换反应 ; 复分解反应 。 25.A~G均为初中常见的化学物质(“→”表示物质 间的转化关系,“—”表示两端的物质能发生化学反应),其中A、F是初中阶段常见的两种氧化物;B、D是初中阶段常见的两种碱; G是一种常见的建筑材料,E是人体胃液中的一种酸,它们之间有如下图的相互转化关系(图中部分生成物已略去)。请回答下列问题: (1)B物质的俗称是_ , (2)C的化学式为__ 。 (3)写出化学反应①和②的化学方程式: ①__ ____;②____ _______。 26.甲、乙、丙、X是初中化学常见的四中物质.它们的转化关系如图所示(部分产物略去,图中“”表示甲和丙都能与X反应生成乙). (1)若甲为二氧化碳,乙为一氧化碳,丙为氧气. ①X的化学式为 . ②甲、乙、丙三种气体中有毒的是 . (2)若甲为碳酸氢钠,乙为氯化钠,丙为碱. ①丙的名称为 . ②物质X (“能”或“不能”)清除铁制品表面的锈. (3)若X为石灰水,甲为碳酸钠,丙为气体. ①X与甲的溶液反应,其反应的类型是 . ②丙与足量X反应的化学方程式为 . 27.在下面关系图中,A、B、C、D是初中化学中常见的单质,甲、乙分别是酒精燃烧时一定会产生的两种物质,丁是建筑材料的主要成分,G为无色有刺激性气味的气体,能使紫色石蕊变蓝,J是赤铁矿的主要成分。 (1)写出化学式:甲是 ,G是 ; (2)写出H与J反应的化学方程式: ; (3)J溶解于稀盐酸中,溶液呈黄色,反应完全后,再向溶液中加入纯净的D的粉末,溶液逐渐变成浅绿色,写出有关变化的化学方程式: 。 28.已知A由一种或几种金属组成,为确定A的组成,进行如下图所示的实验(部分产物巳略去)。已知B、E均为只含一种溶质的溶液,E溶液呈蓝色,C、D均为纯净物。 (1)G是___________(填名称)。 (2)①处发生的反应属于____________(填基本反应类型)。 (3)写出有关反应的化学方程式: ②______________________________________________________; ④______________________________________________________。 (4)根据以上信息,对A的组成作出的判断正确的是___________(填序号)。 A.A中只含有Cu B.A中一定含Cu和X C.A可能是铜锌合金 D.A中一定含有Fe 参考答案 1.(1)Na、Ca (2)HCl CO (3)2NaOH+CO2=Na2CO3+H2O Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3↓ ③④ 2.(1)用于金属表面除锈或制造药物等;2NaOH + CuSO4 = Cu(OH)2 ↓+ Na2SO4 (2)3CO + Fe2O3 2Fe + 3CO2 (3)C或H2 3.(1)3CO+Fe2O32Fe+3CO2(2)Fe+CuSO4=FeSO4+Cu、置换 (3)氧气和水(写化学式也可) 4.⑴、碳;⑵①②③ 5.(1)A、CaCO3 B、HCl C、Fe2O3 D、CO E、CO2 (2)3CO+ Fe2O3 高温 2Fe + 3CO2 或CaCO3+2HCl==CaCl2+H2O+CO2↑ (3)溶液变为黄色 6.(1)CuSO4 (2)NaCl (3)5 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH (4)HCl + KOH = KCl + H2O NaCl 、NaOH (2分 7.(1) Ca(OH)2 CaO C (2) Ca(OH)2+CO2==CaCO3↓+H2O 8. (1) A CO、 X CH4 (2)工业炼铁(3) 氢氧化钙 (4) ④ 3CO+Fe2O3高温2Fe+3CO2 (Fe3O4等亦可)⑤ Fe+2HCl===FeCl2+ H2 ↑(H2SO4亦可 9.(1)氧化铁,铁,四氧化三铁,氢气,铜 (2)3CO+Fe2O32Fe+3CO2,Fe+H2SO4==FeSO4+H2↑,Fe+CuSO4==FeSO4+Cu,3Fe+2O2 Fe3O4 10.(1)CaO ;NH3;(2) CO + CuO Cu + CO2。 11.(1)HCl,AgNO3; (2)(无色)溶液中有白色沉淀产生(3)2AgNO3+Fe==Fe(NO3)2+2Ag 12.⑴CO2 ⑵3Fe +2O2 Fe 3O4 ⑶Fe3O4 + 4CO 3Fe + 4 CO2 ⑷有毒、燃料(冶炼金属、还原剂等) 13.(1)CuO (2)复分解反应 (3)Cu(OH)2 + H2SO4 =CuSO4 +2H2O CuSO4 +Fe = Cu+FeSO4 CuSO4 +BaCl2 = CuCl2+BaSO4↓ 14.⑴ C:CO2 ⑵2CuO+C2Cu+CO2↑ 15.故答案为:(1)2. (2)CO+CuOCu+CO2.(3)Ca(OH)2+2HCl=CaCl2+2H2O;复分解 16.(1)E:CuO ;G:CuSO4 ;(2)放出。 (3)生成的硫酸钙微溶于水会附着在大理石表面,阻止反应继续进行。 (4)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ ; (5)CuO+H2SO4=CuSO4+H2O ; 17.化学反应的过程就是分子分解成原子,原子重新组合的过程。水通电分解前后,氢、氧原子种类、数目、质量都没有发生改变,所以参加化学反应的水的质量,等于的反应后生成的氢气和氧气的质量总和。 18.(1)CH4;H2O;(2)CO2+C高温 = 2CO;(3)Fe2O3+3CO高温 = 2Fe+3CO2 19.(1)Cu(OH)2 BaSO4(2)化合反应;点燃(3)做导线等 (4)3CO+ Fe2O3 高温 2Fe + 3CO2 20.(1)NaOH Na2CO3,NaOH+HCl=NaCl+H2O;(2)甲烷,乙醇;(3)①Zn+FeSO4=Fe+ZnSO4;② Ca(OH)2+Na2CO3=CaCO3↓+2NaOH. 21.(1)催化;(2)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;(3)BaSO4;(4)2NaOH+CO2=Na2CO3+H2O. 22.(1)H2SO4 Cu(OH)2 (2)Fe + Cu SO4 =Cu +Fe SO4 (合理给分) 23.(1) (2) (3) 光合作用 (4) 24.(1)①CuO ②CuSO4 ③CO2 (2)Fe + H2SO4 == FeSO4 + H2↑或Fe + CuSO4 FeSO4 + Cu或C+2CuO2Cu + CO2↑ CuO + H2SO4 == CuSO4 + H2O 或CuSO4+2NaOH == Na2SO4 + Cu(OH)2↓ 25.(4分,每空1分) (1)烧碱 (2)Na2CO3 (3)CO2 + Ca(OH)2==CaCO3↓+ H2O Na2CO3 + Ca(OH)2==CaCO3↓+ 2NaOH 26.(1)①C;②一氧化碳(或乙或CO) (2)①氢氧化钠;②能 (3)①复分解反应;②CO2+Ca(OH)2=CaCO3↓+H2O 推断题2 1.从铜、氧化铜的混合粉末中回收铜的具体流程如下: 回答下列问题: (1)操作1是 。 (2)滤液Ⅰ中加入过量铁粉所发生的反应的化学方程式是 。 (3)试剂A的作用是 。 (4)此实验过程中,下列哪些做法会导致回收到的Cu不纯 A.往混合粉末中加入的稀H2SO4不足 B.往滤液Ⅰ中加入铁粉不足 C.往滤渣Ⅱ中加入试剂A不足 (5)请写出铜的一种用途: 。 2.(12分)利用海水(含氯化钠、氯化镁)处理含二氧化硫废气的方法如下: Ⅰ.海水处理流程: (1)写出生成Mg(OH)2沉淀的化学反应方程式 ; (2)经操作a得到的Mg(OH)2沉淀需要洗净,为证明是否洗净,可取洗涤液少量,向其 中加入下列试剂中的 ,即可达到实验目的。 A. Na2CO3溶液 B.石灰水 C. 硝酸银溶液 Ⅱ.处理二氧化硫流程: (3)上图中最终得到“NaCl”的过程属于 (填“物理变化”或“化学变化”); (4)图中反应①、③、④属于化合反应的是 (填序号); (5)①中反应的化学方程式为 ; (6)④中反应的化学方程式为 。 3.(8分)X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验。 (1)x中含有的金属元素是__ ____(填元素符号)。 (2)写出X中一种成分与盐酸反应的化学方程式:_________ 。 (3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________ ; 若Y 为气体,Y还可以是___ ______(填化学式),写出其中一个反应的化学方程式: 。 4.氯化钠是日常生活中的必需品,某氯化钠样品中除含氯化钠外,还含有少量的CaCl2和MgCl2以及不溶性杂质.以下是提纯该样品的操作流程图. 请回答下列问题: (1)操作X的名称是 . (2)Y溶液中溶质的化学式是 . (3)上述操作流程中共发生 个复分解反应. 5.下图是工业生产纯碱的工艺流程示意图。 纯碱 沉淀 粗盐水 固体C 过滤 NH3 氨化 CO2 碳酸化 NH4Cl溶液 过滤 煅烧 气体D 已知:①粗盐水中含有MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解。 完成下列填空: (1)粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为 ,书写其中一个反应的化学方程式 ; (2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 ,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式 。 (3)“碳酸化”后过滤获得的NH4Cl可用作 肥,也可先 (填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是 ; (4)“煅烧”时,NaHCO3分解生成的气体D是 ,若将气体D直接排入空气不合理的理由是 。 (5)鉴别产品纯碱中是否含有碳酸氢钠的方法是 。 6.(10分)某粗盐中主要成分为NaCl ,还含有的少量MgCl2、CaCl2和少量泥沙。为了除去杂 质,得到纯净的氯化钠,进行如下实验。 (1)除难溶性杂质。将5g的粗盐溶解于足量水中,需用玻璃棒不断搅拌,目的是 ;进行过滤操作时,需要的玻璃仪器有烧杯、玻璃棒和 ;过滤后,将滤液转移到 (填仪器名称)进行加热蒸发,得到固体精盐4g。若所得精盐的产率偏低,可能的原因是 (填字母)。 A.部分粗盐未溶解 B.蒸发时未使用玻璃棒进行搅拌,导致液滴飞溅 C. 过滤时,滤纸破损了 (2)除可溶性杂质。经过上述操作后,精盐中仍存在少量的MgCl2、CaCl2未除去,现设计如下实验进行提纯,提纯的流程如下: 回答下列问题: ①用NaOH为了除去MgCl2杂质,反应的化学方程式为____________________ _。 ②NaOH和Na2CO3如果添加过量了,需往滤液中加入适量___________除去。 ③过滤后,所得滤渣中含有的物质是 (填化学式)。 ④从滤液中得到氯化钠固体的主要操作是蒸发,为了获得纯净的氯化钠,应蒸发至__ _(填序号)。 A.完全蒸干时停止加热 B.快干时停止加热,利用余热蒸干 7.(3分)某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下: 请回答下列问题: (1)操作a的名称是 。 (2)加入的物质A、B分别是 、 。(请填写所需物质的名称) 8.(2013湖北武汉)某白色粉末状固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠;某溶液乙可能含有硝酸钡、氯化钠。为探究它们的成分,某化学小组开展了下图所示的实验。 请回答下列问题: 溶液A呈_______(填“酸性”、“中性”、“碱性”)。步骤Ⅱ中分离混合物的方法是________________。 固体甲中一定含有的物质是_________________,滤液C中除了指示剂外还含有的溶质是_____________。 根据步骤Ⅳ不能确定固体甲中某物质一定存在,其理由是_______________。要证明甲中该物质的存在,需补充的实验操作是________________________,观察现象。 9.(5分)(1)有一包白色粉末,可能是由Na2CO3、Na2SO4、Ba(OH)2、BaCl2中的一种或几种组成,现做如下实验: (Ⅰ):将少量粉末放在烧杯中加入足量水,搅拌、静置、过滤,得无色溶液及白色沉淀; (Ⅱ):向(Ⅰ)过滤得到的白色沉淀中加入足量稀硝酸,沉淀全部溶解并有气体产生; (Ⅲ):向(Ⅰ)过滤得到的滤液中滴加硝酸银溶液,立即有较多的白色沉淀生成,再滴加硝酸银,沉淀不溶解。 根据以上实验现象推断: 白色粉末中①一定存在的是 ,②一定不存在的是 。③可能存在的是 。 10.(10分)过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。已知:温度过高过氧化钙会分解生成氧化物和氧气。 方法1:由Ca(OH)2为原料最终制得,其制备流程如下: 方法2:由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下: (1)方法1中搅拌的目的是 。请将搅拌过程中发生反应的化学方程式补充完整: CaCl2 + H2O2 + 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl。制备过程中除水外可循环使用的物质是 (填化学式); (2)方法2中气体X是 ,实验室常用 溶液来吸收。煅烧后的反应时化合反应,也能生成CaO2·8H2O,反应的化学方程式为 。该反应需控制温度在0 ~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式); (3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 ; (4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。 11.(6分)现欲探究一固体混合物A的成分,已知其中可能含有NaCl、NH4NO3、MgSO4、Cu(OH)2、NaOH、CaCO3六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。 固体A 沉淀D 无色滤液C 无色气体B 白色沉淀E 现象X ②通入紫色 石蕊试液 ①加适量水 过滤 ④滴入稀盐酸 ③滴入Ba(NO3)2 溶液 无色溶液F 气体G 试推断: (1)现象X为: 。 (2)白色沉淀E为 (写化学式)。 (3)无色滤液F中含有的阴离子为 (写离子符号)。 (4)请写出一个过程④发生反应的化学方程式 。 (5)固体混合物A中一定含有的物质为: ,可能含有 。 12.某校化学兴趣小组设计的实验装置如图所示,既可用于制取气体,又可用于验证物质性质。 ①写出仪器的名称:A____________;B____________。 ②当打开K1、关闭K2时,利用Ⅰ、Ⅱ装置可直接进行的实验是_______(填序号)。 a. 大理石与稀盐酸反应制取二氧化碳 b. 锌与稀硫酸反应制取氢气 ③某同学当打开K2、关闭K1时,利用Ⅰ、Ⅱ装置可验证二氧化碳与水反应生成了碳酸,此时试管中盛放的物质是_____________,可观察到的现象是__________________(C为干燥管,用于防止液体倒吸)。 13.金属在生成生活中应用广泛. (1)下列制品中,主要利用金属导电性的是 (填序号). A.铁锅 B.铜导线 C.铝箔 (2)春季停止供暖后,暖气管道最好注满水以防止生锈,其原理是 ; (3)废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为 ; (4)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案: ①操作C的名称为 ; ②写出Ⅰ中有关反应的化学方程式 ; ③Ⅱ加入适量的y时发现有气泡产生,说明金属A中的物质为 .此步反应的方程式为 . 1.(1)过滤 (2)Fe + H2SO4 === FeSO4 + H2↑ Fe+CuSO4==Cu+FeSO4 (3)除去滤渣Ⅱ中过量的铁粉 (4)C (5)做导线 2.(1)MgCl2+Ca(OH)2=== Mg(OH)2↓+ CaCl2 (2)A、C (3)物理变化 (4)③ (5)2NaCl+2H2O通电NaOH+2H2↑+Cl2↑ (6)NaHSO3+HCl===NaCl+SO2+H2O 3.(1)Fe、Cu(1分) (2)6HCl+ Fe2O3 === 2FeCl3+ 3H2O或2HCl+ CuO === CuCl2+ H2O (2分) (3)3C+2Fe2O34Fe + 3CO2或C + 2CuO 2Cu+ CO2; (2分) H2、CO;(1分)3CO + Fe2O32Fe + 3CO2或CO + CuO Cu+ CO2 (2分) 4.(1)过滤.(2)HCl.(3)4. 5.(1)Mg(OH)2和CaCO3;MgCl2+2NaOH=Mg(OH)2+H2O或Na2CO3+CaCl2=CaCO3↓+2NaCl (2) 有利于溶液吸收溶液CO2气体;NaCl+NH3+CO2+H2O =NaHCO3↓+NH4Cl (3)氮;加热;NH3; (4) CO2或二氧化碳;可循环利用,降低生产成本,同时也能保护环境。 (5) 取样,加热,将可能产生的气体通入澄清石灰水,观察溶液是否变浑浊。 6.(1)加快溶质溶解速率(充分溶解);漏斗;蒸发皿; AB;(2)①2NaOH+MgCl2===Mg(OH)2↓+2NaCl; ②稀HCl; ③ Mg(OH)2、CaCO3 ;④ B。 44.(1)过滤(每空1分) (2)Fe、稀硫酸 7.(1)碱性 过滤 (2)硫酸钠、氢氧化钠 氢氧化钠、硝酸钡、硝酸钠、氯化钠 (3)溶液乙中也可能含有氯化钠 取少量甲加水溶解,加入过量的稀硝酸和硝酸钡,过滤, 取滤液滴加硝酸银溶液 8.(1)①Na2CO3 、BaCl2 ②Na2SO4 ③Ba(OH)2 (2)①Na2CO3 或K2CO3 或BaCO3 ②NH4HCO3 或(NH4)2CO3 9.(1)使反应充分,提高原料利用率;H2O;NH4Cl;(2)CO2,NaOH,Ca(OH)2+H2O2+7H2O=CaO2•8H2O,冰水中,Ca(OH)2;(3)使CaO2分解;(4)方法2. 71.(6分)变蓝; BaSO4; Cl-; CaCO3+2HCl==CaCl2=H2O+CO2 ↑ 或Mg(OH)2+2HCl==MgCl2+2H2O; NH4NO3,NaOH,CaCO3,MgSO4; NaCl 。 10.(1)①A:分液漏斗 B:锥形瓶 ②a ③紫色石蕊试液;变红 11.故答案为:(1)B;(2)隔绝氧气;(3)3CO+Fe2O32Fe+3CO2 ;(4)①蒸发;②Fe+CuSO4=Cu+FeSO4;③铁和铜;Fe+H2SO4=H2↑+FeSO4. 12.甲为H2O,G为NH3。3CO+Fe2O3 =2Fe+3CO2、 Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2 13.(1)化合反应 复分解反应 (2)Cu H2(3)H2+CuOCu+H2O (4)稀硫酸过量 (5)Fe+H2SO4=FeSO4+H2↑查看更多