2021届新高考一轮复习人教版第34讲晶体结构与性质作业
练案[34]选修3 物质结构与性质
第34讲 晶体结构与性质
A组 基础必做题
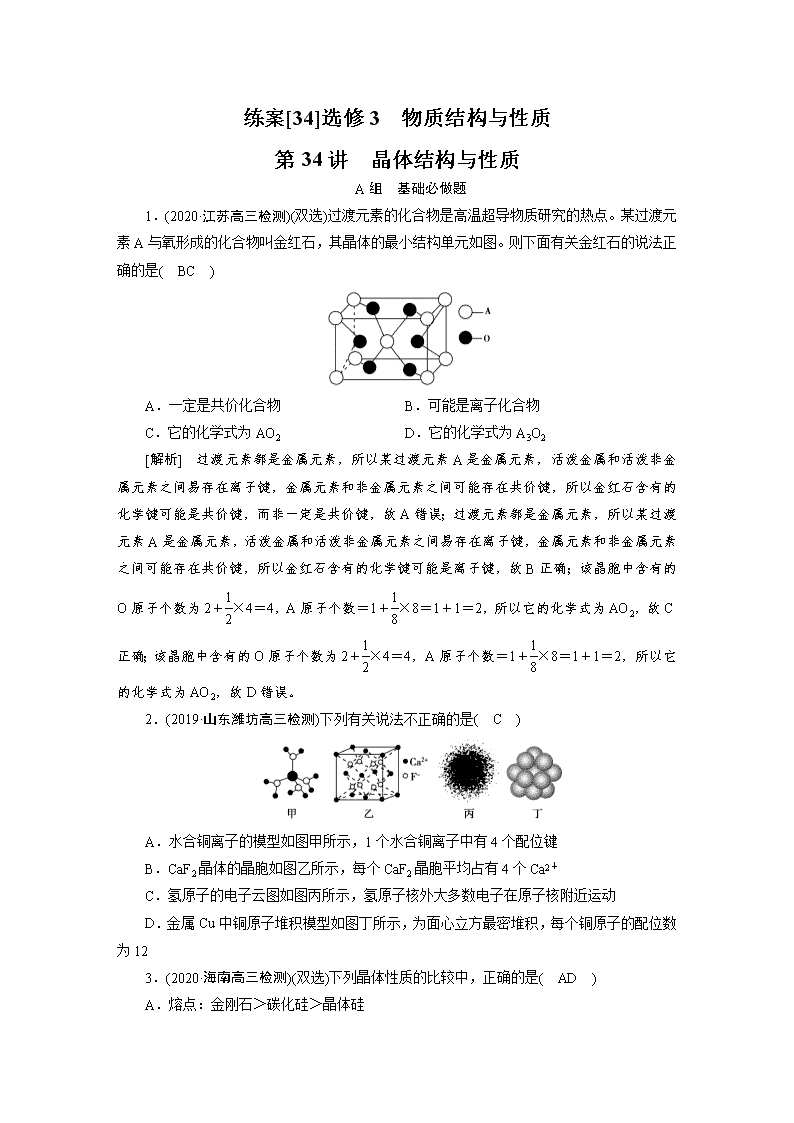
1.(2020·江苏高三检测)(双选)过渡元素的化合物是高温超导物质研究的热点。某过渡元素A与氧形成的化合物叫金红石,其晶体的最小结构单元如图。则下面有关金红石的说法正确的是( BC )
A.一定是共价化合物 B.可能是离子化合物
C.它的化学式为AO2 D.它的化学式为A3O2
[解析] 过渡元素都是金属元素,所以某过渡元素A是金属元素,活泼金属和活泼非金属元素之间易存在离子键,金属元素和非金属元素之间可能存在共价键,所以金红石含有的化学键可能是共价键,而非一定是共价键,故A错误;过渡元素都是金属元素,所以某过渡元素A是金属元素,活泼金属和活泼非金属元素之间易存在离子键,金属元素和非金属元素之间可能存在共价键,所以金红石含有的化学键可能是离子键,故B正确;该晶胞中含有的O原子个数为2+×4=4,A原子个数=1+×8=1+1=2,所以它的化学式为AO2,故C正确;该晶胞中含有的O原子个数为2+×4=4,A原子个数=1+×8=1+1=2,所以它的化学式为AO2,故D错误。
2.(2019·山东潍坊高三检测)下列有关说法不正确的是( C )
A.水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B.CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C.氢原子的电子云图如图丙所示,氢原子核外大多数电子在原子核附近运动
D.金属Cu中铜原子堆积模型如图丁所示,为面心立方最密堆积,每个铜原子的配位数为12
3.(2020·海南高三检测)(双选)下列晶体性质的比较中,正确的是( AD )
A.熔点:金刚石>碳化硅>晶体硅
B.沸点:NH3>H2O>HF
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
[解析] 三种物质均为原子晶体,原子半径越小,作用力越大,键能越大,熔点越高;由于r(C)<r(Si),所以键长C-C<C-Si<Si-Si,故键能顺序C-C>C-Si>Si-Si,A正确;三种物质均为分子晶体,其沸点高低与分子间作用力有关,三种物质间都存在氢键,只有水常温下为液态,氨气分子间氢键最弱,所以沸点:H2O>HF>NH3,B错误;二氧化硅是原子晶体,硬度大,而白磷、冰都是分子晶体,硬度小,C错误;卤化硅均为分子晶体,它们的组成和性质相似,分子间不存在氢键,所以相对分子质量越大,熔点越高,所以D正确。正确选项AD。
4.(2020·山东潍坊高三检测)(双选)下列关于CH4和CO2的说法正确的是( BD )
A.固态二氧化碳属于原子晶体
B.CH4分子中含有极性共价键,是非极性分子。
C.因为碳氢键键能小于碳氧键,所以CH4的熔点低于CO2
D.二氧化碳分子中碳原子的杂化类型是sp
[解析] 二氧化碳属于分子晶体,选项A错误;甲烷中含有极性共价键,是正四面体结构,属于非极性分子,选项B正确;二氧化碳与甲烷形成的均是分子晶体,分子间作用力二氧化碳大于甲烷,所以熔点高,选项C错误;甲烷为正四面体形,C原子含有4个σ键,无孤电子对,采取sp3杂化,二氧化碳为直线形,碳氧双键中有1个σ键和1个π键,因此C原子采取sp杂化,选项D正确。答案选BD。
5.(2020·经典习题选粹)下表给出几种氯化物的熔点和沸点:
NaCl
MgCl2
AlCl3
SiCl4
熔点/ ℃
801
714
190
-70
沸点/ ℃
1413
1412
180
57.57
有关表中所列四种氯化物的性质,以下叙述正确的是( C )
①氯化铝在加热时能升华 ②四氯化硅在晶态时属于分子晶体 ③氯化钠晶体中粒子之间以范德华力结合 ④氯化镁的熔沸点比氯化钠低,主要是受堆积方式、键的极性、晶格能等影响
A.仅② B.仅③④
C.仅①②④ D.①②③④
[解析] ①AlCl3的熔沸点较低,则AlCl3属于分子晶体,沸点低于熔点,加热时能升华,①正确;②SiCl4的熔沸点较低,是分子晶体,②正确;③NaCl的沸点为1 413 ℃,属于离子晶体,粒子之间以离子键结合,③错误;④氯化镁的熔沸点比氯化钠低,并且都属于离子晶体,所以主要是受堆积方式、键的极性、晶格能等影响,④正确。
6.(2019·重庆校级期中)如图是蓝色晶体MxFey(CN)6中阴离子的最小结构单元(图中是该晶体晶胞的八分之一)。下列说法正确的是( D )
A.该晶体属于离子晶体,M呈+2价
B.该晶体属于分子晶体,化学式为MFe2(CN)6
C.该晶体中与每个Fe3+距离相等且最近的CN-为12个
D.该晶体的一个晶胞中含有的M+的个数为4个
[解析] 根据均摊法,含Fe2+个数为4×=,同样可推出含Fe3+个数也为,CN-为12×=3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,根据化合价代数和为零可知,M的化合价为+1价,故A错误;由A的分析可知,晶体的化学式为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,故B错误;由图可看出与每个Fe3+距离最近且等距离的CN-为6个(同层4个,上、下层各1个),故C错误;图中是该晶体晶胞的八分之一,所以一个晶胞中的CN-有3个×8=24个,根据晶体的化学式MFe2(CN)6可知:M+与CN-的个数比为1︰6,所以M+有4个,故D正确。
7.(2020·山东济南高三检测)(1)金刚石的晶胞结构如图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为 顶点、面心 。
(2)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)。
①石墨烯转化为氧化石墨烯时,1号C与相邻碳原子间键能的变化是 变小 (填“变大”“变小”或“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为a m,12 g单层石墨烯的单面理论面积约为 a2NA m2(列出计算式即可)。
[解析] (1)已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+
,这说明锌全部位于晶胞中,共计是4个,根据化学式ZnS可知,S2-处于ZnS晶胞中的位置为顶点、面心。
(2)①石墨烯转化为氧化石墨烯时,1号C连接的氧原子吸引电子能力较强,导致与1号碳原子相邻碳原子对电子的吸引力减小,所以1号C与相邻碳原子间键能的变化是变小;②单层石墨烯中含有碳原子个数=6×=2,每个六边形面积=6×(×a×a× m2)= a2 m2。12 g单层石墨烯中原子个数为NA,因此12 g单层石墨烯的单面理论面积为×a2 m2= a2 NA m2。
8.(2020·经典习题选粹)下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是金刚石晶体 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为 金刚石、MgO、CaCl2、冰、干冰 。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能 小于 (填“大于”或“小于”)MgO晶体,原因是 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数,且r(Mg2+)
离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,则熔点由高到低的顺序为金刚石、MgO、CaCl2、冰、干冰。
(3)因为MgO中离子带两个电荷,NaCl中离子带一个电荷,氧离子半径小于氯离子,根据离子半径越小,离子带电荷越多,晶格能越大,可得MgO晶体的晶格能大于NaCl晶体的晶格能。
(4)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为×8+×6=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高。
B组 能力提升题
9.(2020·江苏江阴期中)石墨晶体是层状结构,在每一层内;每一个碳原子都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( D )
A.10个 B.18个
C.24个 D.14个
[解析] 根据图片知,每个碳原子被3个六元环占有,利用均摊法知,7个六元环含有碳原子个数为×6×7=14。
10.(2020·吉林延边校级期中)20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。90年代初,科学家又发现了管状碳分子和洋葱状碳分子(如图)。下列说法错误的是( B )
A.金刚石和石墨的熔点肯定要比C60高
B.据估计C60熔点比金刚石和石墨要高
C.无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体
D.C60的熔点低于C90
[解析] 金刚石属于原子晶体,石墨属于混合晶体,C60、C70等属于分子晶体,因此金刚石和石墨的熔点肯定要比C60高,故A正确,B错误;球碳分子、管状碳分子、洋葱状碳分子,都是碳元素形成的不同单质,所以均为碳的同素异形体,故C正确;C60、C90均属于分子晶体,C90相对分子质量大,分子间作用力强,熔点较高,故D正确。
11.(2020·试题调研)现有四种晶体,其离子排列方式如图所示,其中化学式正确的是( C )
[解析] A.该晶胞中A离子个数是1,B离子个数=8×=1,A、B离子个数之比=1︰1,其化学式为AB或BA,故A错误;B.该晶胞中E离子个数=F离子个数=4×=,离子个数比=︰=1︰1化学式为EF或FE,故B错误;C.该晶胞中,X离子个数是1,Y离子个数=6×=3,Z离子个数=8×=1,X、Y、Z离子个数比=1︰3︰1,其化学式为XY3Z,故C正确;D.该晶胞中A离子个数=8×+6×=4,B离子个数1+12×=4,A、B离子个数之比=4︰4=1︰1,其化学式为AB或BA,故D错误。
12.(2019·河北衡水检测)下列常见分子中σ键、π键判断正确的是( C )
A.CN-与N2结构相似,CH2===CHCN分子中σ键与π键数目之比为1︰1
B.CO与N2结构相似,CO分子中σ键与π键数目之比为2︰1
C.C与O互为等电子体,1 mol O中含有的π键数目为2NA
D.已知反应N2O4+2N2H4===3N2+4H2O,若该反应中有4 mol N—H键断裂,则形成的π键数目为6NA
[解析] A项,CH2===CH—C≡N中有3个π键、6个σ键,A错误;B项,C≡O中σ键为1个,π键为2个,B错误;C项,C中有碳碳三键,则O中有氧氧三键,C正确;D项,4 mol N—H键断裂,消耗1 mol N2H4,生成1.5 mol N2,形成π键数目为3NA,D错误。
13.(2020·湖北武汉武昌区调研考试)请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有 12 种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 SiH4 ,判断依据是 在第ⅣA~ⅦA族中的氢化物里,只有第ⅣA族元素氢化物沸点不存在反常现象;且a为第三周期氢化物,故a为SiH4 。
(3)CO2在高温高压下形成的晶体的晶胞结构如图3所示。则该晶体属于 原子 晶体。
(4)第一电离能介于Al、P之间的第三周期元素有 3 种。BCl3中心原子的杂化方式为 sp2杂化 ,写出与BCl3结构相同的一种等电子体(写离子) NO、CO、SiO(写出其中一个即可) 。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有 12 个紧邻分子。D的醋酸盐晶体局部结构如图4,该晶体中含有的化学键是 abc (填字母标号)。
a.极性键 b.非极性键
c.配位键 d.金属键
(6)Fe的一种晶体如图5中甲、乙所示,若按甲虚线方向切乙得到的A~D中正确的是 A (填字母标号)。
铁原子的配位数是 8 ,假设铁原子的半径是r cm,该晶体的密度是ρ g·cm-3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。
[解析] 本题考查物质结构与性质,考查的核心素养是宏观辨识与微观探析。(1)根据该元素的第一至第五电离能数据,可知该元素的第三电离能发生突变,说明该原子最外层有2个电子,结合该元素为第三周期主族元素可知,该元素为Mg,其核外有12个电子,每个电子的运动状态均不相同,故该元素对应的原子有12种不同运动状态的电子。(2)第ⅣA~ⅦA族元素的氢化物中,只有第ⅣA族元素的氢化物均不存在氢键(第ⅤA族中NH3、第ⅥA族中H2O、第ⅦA族中HF均存在分子间氢键),而对于结构相似的分子晶体,随着相对分子质量增大,范德华力逐渐增大,氢化物的沸点逐渐升高,a为第三周期氢化物,故a为SiH4。(3)该晶胞为空间网状结构,故该晶体属于原子晶体。(4)同周期主族元素从左到右第一电离能呈增大趋势,但第ⅡA族由于s能级全满,处于稳定状态,第Ⅴ
A族由于p能级半满,较稳定,故第三周期元素的第一电离能由大到小的顺序为NaO2-,故Cu2O的晶格能大于Cu2S,Cu2S的熔点低于Cu2O。(2)SO2和SO3中S原子的孤电子对数分别为(6-2×2)/2=1和(6-2×3)/2=0,由于孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,故SO2的键角小于SO3的键角。根据题图1可知S与4个O形成4个σ键,无孤电子对,价层电子对数为4,故S原子的杂化类型为sp3;与S形成σ键的4个O中有2个O被共用,则该物质的化学式为SO3或(SO3)n。(3)CaC2的电子式为Ca2+[︰C⋮⋮C︰]2-,根据题图2可知,该晶胞中Ca2+位于顶点和面心,形成面心立方最密堆积,C位于棱上和体心,该晶胞含有C的个数为12×1/4+1=4,由于两个碳原子之间有3个共用电子对,即1个C中有2个π键,故1个晶胞中有8个π键。(4)根据C60晶胞示意图可知与每个C60分子距离最近且相等的C60分子有12个,其距离为晶胞棱长的,即为7.1××10-8 cm。
15.(2020·山东潍坊高三检测)A、B、C、D、E为原子序数依次增大的5种元素。A元素原子的p轨道有3个未成对电子;B元素原子的价层电子中,p轨道电子数是s轨道的2倍;C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素原子最外层有1个未成对电子;E元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。请回答下列问题:
(1)D元素基态原子电子占据最高能级的电子云轮廓图为 纺锤形(或哑铃形) ,E元素基态原子的价层电子排布图(轨道表达式)为 。
(2)A、B、C中第一电离能最大的是 N (填元素符号)。
(3)元素A形成氢化物A2H4,元素B形成H2B2,二者沸点如表所示:
氢化物
A2H4
H2B2
沸点
113 ℃
150.2 ℃
A2H4中A原子的杂化类型为 sp3 ,H2B2比A2H4沸点高的原因是
O的电负性比N强,H2O2中分子之间氢键比N2H4中的强,故沸点高 。
(4)化合物D2B的立体构型为 V形 ,单质D与湿润的Na2CO3可以1︰1反应制备D2B,其化学方程式为 2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl 。
(5)E与C所形成化合物的晶胞如图所示:
①在1个晶胞中,C的数目为 4 ,该化合物的化学式为 ZnS 。
②其中原子坐标参数:O(0,0,0),P(0,,),Q(,0,),则R的坐标参数为 (,,) 。
[解析] A元素原子的p轨道有3个未成对电子,价层电子排布式为xs2xp3,B元素原子的价层电子中,p轨道电子数是s轨道的2倍,价层电子排布式为ys2yp4,C的基态原子的3p轨道上有4个电子,C的电子排布式为1s22s22p63s23p4,C为S;五种元素原子序数依次增大,则y和x均为2,A为N,B为O;C和D属于同周期,且原子序数依次增大,D元素原子最外层有1个未成对电子,即D为Cl,E元素位于第四周期,内层轨道全部排满,最外层电子数为2,E的电子排布式为1s22s22p63s23p63d104s2,即E为Zn。(1)Cl元素原子核外电子排布式为1s22s22p63s23p5,电子占据最高能级为p能级,其电子云轮廓图为纺锤形(或哑铃形);Zn为副族元素,价层电子包括最外层电子和次外层d能级上的电子,价层电子排布图为。(2)同主族从上到下第一电离能逐渐减小,同周期从左向右第一电离能逐渐增大,但存在电离能反常情况,即第ⅡA族>第ⅢA族、第ⅤA族>第ⅥA族,因此第一电离能最大的元素是N。(3)N2H4的电子式为,中心原子N形成3个σ键,还有一对孤电子对,故N原子的杂化方式为sp3。O的电负性比N强,H2O2中分子之间氢键比N2H4中的强,故沸点高。(4)D2B的分子式为Cl2O,可以看作O为中心原子,O形成2个σ键,孤电子对数为=2,即Cl2O的空间构型为V形。根据题意,得出制备Cl2O的化学方程式:2Cl2+2Na2CO3+H2O===Cl2O+2NaHCO3+2NaCl。(5)①利用均摊法,C位于顶点和面心,个数为8×+6×=4;E位于晶胞内部,个数为4,因此化学式为ZnS。②R在体对角线的位置,R的坐标参数为(,,)。
[点拨] 结合原子的电子排布原理推断元素,以元素推断为切入点,考查物质结构与性质,是高考中常见的考查方式,能够较好地考查考生的逻辑推理能力,预计2021年可能会如此考查。
16.(2020·河南郑州第二次质量预测)砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 3d84s2 ,基态As原子电子占据的最高能级的电子云轮廓图为 哑铃(或纺锤) 形。
(2)第一电离能As > (填“>”或“<”)Se,原因是 As元素原子的4p轨道上的电子呈半满状态,比较稳定 。
(3)As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
①AlH的中心原子的杂化方式为 sp3 ,其空间构型为 正四面体 。写出一种与AlH互为等电子体的分子的化学式 SiH4或CH4 。
②AsH3分子中H—As—H键角 < (填“>”“=”或“<”)109.5°。AsH3的沸点低于NH3,其原因是 NH3分子间能形成氢键,AsH3分子间只有范德华力 。
(4)有机砷是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为 abc (填字母编号)。
a.离子键 b.σ键
c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及黏膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶体密度ρ为 (或或) g·cm-3(列式即可,不必化简)。
[解析] 本题主要考查价电子排布式的书写、第一电离能比较、键角大小分析、化学键类型判断、晶胞结构分析及计算,考查的核心素养是宏观辨识与微观探析。
(1)基态镍原子核外有28个电子,核外电子排布式为[Ar]3d84s2,价电子排布式为3d84s2。基态砷原子核外有33个电子,核外电子排布式为[Ar]3d104s24p3,电子占据的最高能级为4p,其电子云轮廓图为哑铃(或纺锤)形。
(2)As为第四周期第ⅤA族元素,Se为第四周期第ⅥA族元素,As元素原子的4p轨道上的电子呈半满状态,比较稳定,因此第一电离能:As>Se。
(3)①AlH中Al的孤电子对数为=0,成键电子对数为4,Al的杂化轨道数为4,杂化类型为sp3,AlH的空间构型为正四面体形。与AlH互为等电子体的分子有SiH4、CH4等。②AsH3中As的孤电子对数为=1,As的杂化轨道数为1+3=4,杂化类型为sp3,由于孤电子对与成键电子对间的斥力>成键电子对间的斥力,故H—As—H的键角小于109.5°。NH3、AsH3均为分子晶体,NH3分子间能形成氢键,AsH3分子间只有范德华力,因此AsH3的沸点低于NH3的沸点。
(4)该有机物中Na+与阴离子之间为离子键,阴离子中N—H键、C—N键、C—As键、As—O键等均为σ键,As===O键中含有σ键、π键,该有机物中不含碳碳双键。
(5)该晶胞中Ni的个数为8×+4×=2,As的个数为2,该晶胞的质量为 g= g,该晶胞的底面积为b×10-10 cm×b×10-10 cm=b2×10-20 cm2,则该晶胞的体积为b2×10-20cm2×a×10-10 cm=ab2×10-30 cm3,故该晶体的密度ρ= g÷(ab2×10-30 cm3)= g·cm-3。