- 2021-05-22 发布 |
- 37.5 KB |
- 33页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习氧化还原反应和离子反应课件(33张)(全国通用)
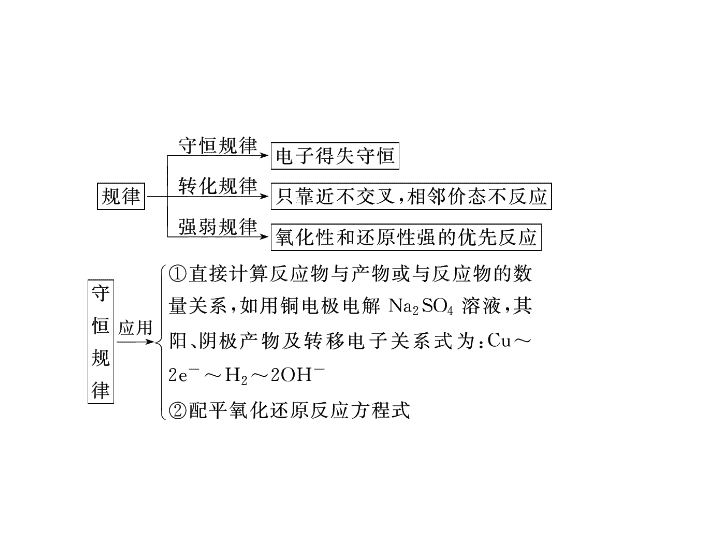
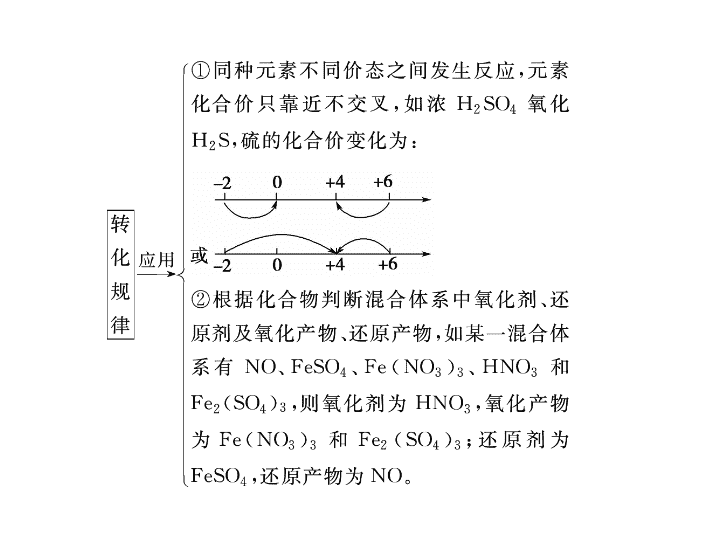
氧化还原反应和离子反应 【 破题技巧 】 解答该题的思维流程如下: 【 精讲精析 】 该反应中铁的化合价由+ 2 升高到+ 3 、铬的化合价由+ 6 降低到+ 3 。由原子守恒知 B 选项正确;参加反应的铬的物质的量为 nx mol ,转移电子 3 nx mol , C 选项正确;根据电子守恒知 D 选项正确;消耗硫酸亚铁铵的物质的量为 n (1 + y )mol , A 选项错误。 【 答案 】 A 1 .已知还原性: Fe 2 + >Br - >Cl - ,在 FeCl 2 、 FeBr 2 的混合溶液中, Cl - 、 Br - 两种离子的物质的量之比为 1 ∶ 2 ,向该溶液中通入一定量的氯气,使溶液中 Cl - 与 Br - 的个数之比为 8 ∶ 1 ,则通入氯气的物质的量与溶液中 Fe 3 + 的物质的量之比为 ( ) A . 1 ∶ 1 B . 2 ∶ 1 C . 4 ∶ 3 D . 2 ∶ 3 【 答案 】 A 6 .看反应物的量是否影响产物,物质混合时随着量的不同,它们的离子方程式也不同,常见的由于量不同而导致离子方程式不同的情况有: (1) 碱与多元弱酸的反应:如 NaOH 溶液与 CO 2 、 SO 2 、 H 2 S 等的反应。 (2) 酸与多元弱酸盐的反应:如 HCl 与 Na 2 CO 3 、 K 2 SO 3 、 Na 2 S 等的反应。 (3) 电解质中的多种离子都发生反应的情况:如 NaHSO 4 与 Ba(OH) 2 、 NH 4 HCO 3 与 Ca(OH) 2 、 KAl(SO 4 ) 2 与 Ba(OH) 2 等。 (4) 碳酸氢盐与 Ca(OH) 2 、 Ba(OH) 2 的反应。 (5) 一种氧化剂对应几种还原剂的反应 ( 如在 FeBr 2 或 FeI 2 中通入 Cl 2 ) ,在含有不同阳离子的溶液中加入一种还原剂的反应。 【 破题技巧 】 正确解答本题的关键在于: (1) 准确判断离子方程式是否符合事实。 (2) 化学式拆分是否正确。 【 答案 】 D 【 答案 】 D 【 答案 】 C 【 答案 】 D 如图中, A 、 B 、 C 、 D 、 E 是单质, G 、 H 、 I 、 F 是 B 、 C 、 D 、 E 分别和 A 形成的二元化合物。已知: ① 反应 C + G B + H 能放出大量的热,该反 应曾应用于铁轨的焊接; ② I 是一种常见的温室气体,它和 E 可以发生反应: 2E + I 2F + D , F 中 E 元素的质量分数为 60% 。 回答问题: (1) 写出 ① 中反应的化学方程式并标出电子转移的方向和数目 _______ ; (2)1.6 g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量 ( 写出离子方程式和过程 ) ; (3)C 与过量 NaOH 溶液反应的离子方程式为 ________ ,反应后溶液与过量化合物 I 反应的离子方程式为 _______ 。 【 破题技巧 】 本题题干是无机框图推断,但设置的问题却是氧化还原反应和离子反应。推断部分的破题点有两个: (1) 铝热反应, (2) 温室气体 CO 2 。 【 精讲精析 】 由反应 C + G B + H 曾应用于铁轨的焊接,推出 C 、 G 为 Al 和 Fe 2 O 3 , B 、 H 为 Fe 和 Al 2 O 3 。又知 G 、 H 分别是 B 、 C 和 A 形成的二元化合物,那么 G 为 Fe 2 O 3 , H 为 Al 2 O 3 ,从而推知 B 为 Fe , C 为 Al , A 为 O 2 。 I 是一种常见的温室气体,则 I 为 CO 2 ,又知 I(CO 2 ) 是 D 和 A(O 2 ) 形成的二元化合物, 则 D 为碳。 【 答案 】 1 . 氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与 Br 2 + SO 2 + 2H 2 O=H 2 SO 4 + 2HBr 相比较,水的作用不相同的是 ( ) A . 2Na 2 O 2 + 2H 2 O=4NaOH + O 2 ↑ B . 4Fe(OH) 2 + O 2 + 2H 2 O=4Fe(OH) 3 C . 2F 2 + 2H 2 O=4HF + O 2 D . 2Al + 2NaOH + 2H 2 O=2NaAlO 2 + 3H 2 ↑ 【 解析 】 反应 Br 2 + SO 2 + 2H 2 O=H 2 SO 4 + 2HBr 中,水既非氧化剂又非还原剂。 A 中水既非氧化剂又非还原剂; B 中水既非氧化剂又非还原剂; C 中水作还原剂; D 中水作氧化剂。 【 答案 】 CD 【 解析 】 A 项不符合电荷守恒, A 错; C 项应该发生氧化还原反应,故不可能生成 SO 2 , C 错;在 CO 2 过量的情况下,应该生成 Ca(HCO 3 ) 2 , D 错。 【 答案 】 B 【 解析 】 碳酸的酸性大于硅酸和苯酚,因此 A 、 D 选项不合题意; B 选项,通入 CO 2 ,溶液仍呈酸性,所给离子均能大量存在;二氧化碳能与 OH - 反应, C 选项不合题意。 【 答案 】 B 4 .下列说法正确的一组是 ( ) ① 不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③ 0.5 mol /L 一元酸溶液 H + 浓度为 0.5 mol/ L ④ 强酸溶液中的 H + 浓度一定大于弱酸溶液中的 H + 浓度 ⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子 ⑥熔融的电解质都能导电 A .①③⑤⑥ B .②④⑤⑥ C .只有⑤ D .只有⑥ 【 解析 】 电解质的溶解性与电解质的强弱没有直接的关系,①、②错;③中若为弱酸则不能完全电离, H + 浓度小于其浓度,错误;强酸溶液中的 H + 浓度不一定大于弱酸溶液中的 H + 浓度,还与酸本身的浓度大小有关,④错;属共价化合物的电解质熔融时不能导电,⑥错。 【 答案 】 C 【 解析 】 【 答案 】 (1)1 ∶ 1 (2)As 2 S 3 氢氧化钠溶液 ( 或硫酸铜溶液 ) (3)10 mol查看更多