- 2021-05-22 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2012高考北京理综化学试题解析
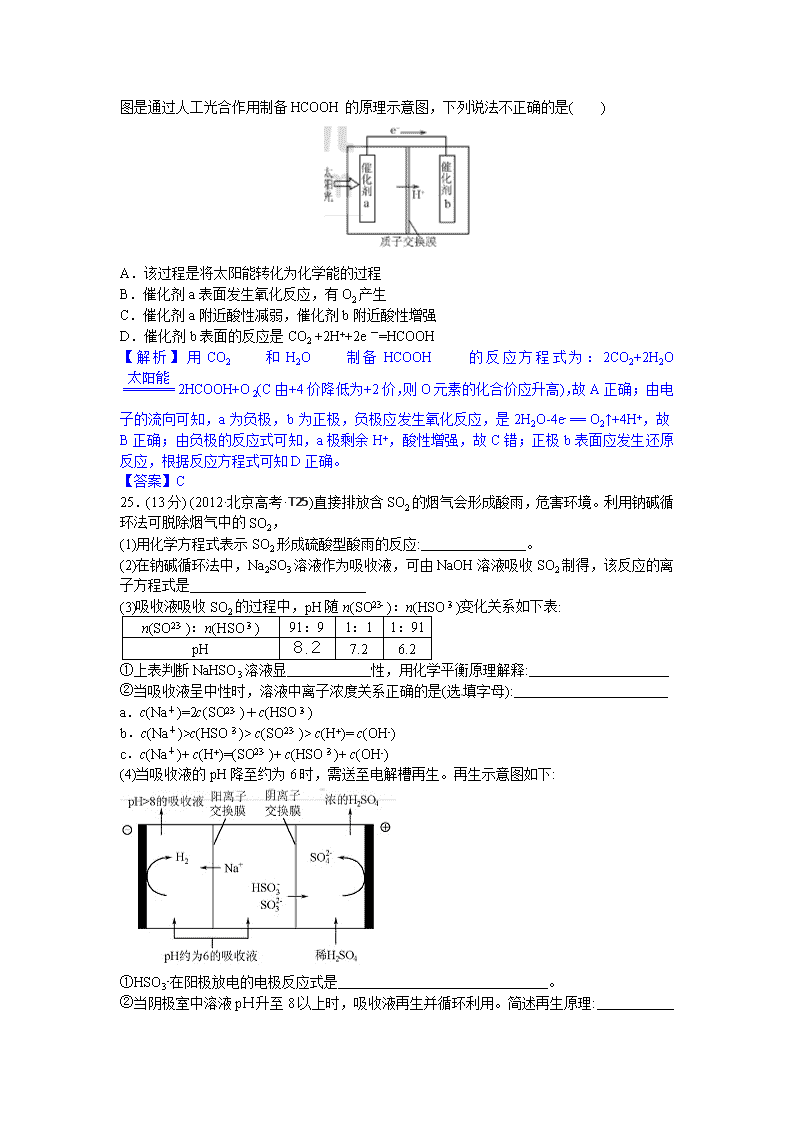
2012高考北京理综化学试题解析 6.(2012·北京高考·T6)下列用品的有效成分及用途对应错误的是( ) A B C D 用品 有效成分 NaCl Na2CO3 Al(OH)3 Ca(ClO)2 用途 做调味品 做发酵粉 做抗酸药 做消毒剂 【解析】众所周知,食盐的主要成分是NaCl,可作调味品,故A正确;小苏打的主要成分是NaHCO3而不是Na2CO3,故B错;复方氢氧化铝的主要成分是Al(OH)3,可以治疗胃酸过多,故C正确;漂白粉的有效成分是Ca(ClO)2,也可以做漂白剂,故D正确。 【答案】B 7.(2012·北京高考·T7)下列解释实验现象的反应方程式正确的是( ) A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2- =Ag2S↓+2C1- C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2=2Na2CO3+O2 D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH- =CaCO3↓+CO32-+2H2O 【解析】“切开的金属Na暴露在空气中,光亮表面逐渐变暗”是生成Na2O而不是Na2O2,只有在加热(点燃)条件下才生成Na2O2:2Na+O2Na2O2,故A错;Ag2S的溶解度比AgC1更小,可以实现沉淀的转化,故B正确;“Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物”主要是2Na2O2+2H2O=4NaOH+O2,生的NaOH具有吸水性造成的,故C错; “过量的澄清石灰水”时发生的离子方程式为:HCO3-+Ca2++OH- =CaCO3↓+2H2O,故D错。 【答案】B 8.(2012·北京高考·T8)下列试验中,所选装置不合理的是( ) A.分离Na2CO3溶液和CH3COOC2H5,选④ B.用CC14提取碘水中的碘,选③ C.用FeC12溶液吸收C12,选⑤ D.粗盐提纯,选①和② 【解析】因CH3COOC2H5不溶解于水,故分离Na2CO3溶液和CH3COOC2H5用的是分液法,应选③,故A错;萃取分液用的是分液漏斗,故B正确;将FeC12溶液盛在⑤中广口瓶宗,C12从左侧通入反应,故C正确;粗盐的提纯需经过溶解、过量、蒸发结晶,故D正确。 【答案】A 9.(2012·北京高考·T9)已知33As、35Br位于同一周期,下列关系正确的是( ) A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4 【解析】33As、35Br和选项中的其他元素在周期表中的位置关系为:,根据同周期、同主族元素性质的递变规律可知,原子半径:As>P>C1,故A错;非金属性:C1>Br>As,故热稳定性HC1>HBr>AsH3,B错;非金属性C1>S>As,故还原性As3->S2->C1-,C正确;非金属性S>P>As,故最高价含氧酸的酸性H2SO4>H3PO4>H3AsO4,D错。 【答案】C 【易错分析】对As元素符合不熟悉而无从下手。 10.(2012·北京高考·T10)用右图所示装置进行下列实验,实验结果与预测的现象不一致的是( ) 【解析】因浓硝酸具有挥发性,溶解于淀粉碘化钾溶液中将I-氧化为I2,与淀粉变蓝,故A错;虽然挥发的HCl会进入酚酞试液,但酚酞试液遇酸不变色,故B正确;挥发出的NH3溶于AlCl3溶液中发生反应:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,故C正确;饱和氯水中可以挥发出Cl2,与湿润的红色布条中的H2O反应:Cl2+H2O=HCl +HClO,生成的HClO能使有色布条褪色,故D正确。 【答案】A 11.(2012·北京高考·T11)下列说法正确的是( ) A.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 C.若两种二肽互为同分异构体,则二者的水解产物不一致 D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 【解析】天然植物油均为高级脂肪酸甘油酯,但多是混甘油酯,没有固定的熔沸点,故A错;蔗糖虽能水解得到葡萄糖,但其本身无还原性,故B错;两者的虽结构不同,但可水解得到相同的水解产物,比如CH3CH(NH2)CONHCH2COOH和CH2(NH2)CONHCH(CH3)COOH,均水解得到CH2(NH2)COOH、CH3CH(NH2)COOH,故C错;乙醛可以制取聚乙醛等,氯乙烯可以合成聚氯乙烯,乙二醇可以和乙二酸缩聚生成聚酯,故D正确。 【答案】D 12.(2012·北京高考·T12)人工光合作用能够借助太阳能,用CO2和H2O 制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( ) A.该过程是将太阳能转化为化学能的过程 B.催化剂a表面发生氧化反应,有O2产生 C.催化剂a附近酸性减弱,催化剂b附近酸性增强 D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH 【解析】用CO2和H2O制备HCOOH的反应方程式为:2CO2+2H2O2HCOOH+O2(C由+4价降低为+2价,则O元素的化合价应升高),故A正确;由电子的流向可知,a为负极,b为正极,负极应发生氧化反应,是2H2O-4e- == O2↑+4H+,故B正确;由负极的反应式可知,a极剩余H+,酸性增强,故C错;正极b表面应发生还原反应,根据反应方程式可知D正确。 【答案】C 25.(13分) (2012·北京高考·T25)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2, (1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。 (2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 (3)吸收液吸收SO2的过程中,pH随n(SO):n(HSO)变化关系如下表: n(SO):n(HSO) 91:9 1:1 1:91 pH 8.2 7.2 6.2 ①上表判断NaHSO3溶液显 性,用化学平衡原理解释: ②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): a.c(Na+)=2c(SO)+c(HSO) b.c(Na+)>c(HSO)> c(SO)> c(H+)= c(OH-) c.c(Na+)+ c(H+)=(SO)+ c(HSO)+ c(OH-) (4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下: ①HSO3-在阳极放电的电极反应式是 。 ②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 【解析】(1)SO2与水反应生成H2SO3:SO2+H2O=H2SO3;H2SO3在空气中易被氧气氧化:2H2SO3+O2==2H2SO4。 (2)NaOH与SO2反应生成Na2SO3的离子方程式为:SO2 +2OH- == SO32- + H2O。 (3)①由表可知,n(HSO)越多,溶液的酸性越强,故NaHSO3溶液显酸性;HSO即能电离又能水解,水解显碱性:HSO3-+ H2OH2SO3 +OH-,电离显酸性:HSO3-SO+ H+,但电离程度大于水解程度,使溶液显酸性。 ②由电荷守恒可知:c(H+)+c(Na+)=2c(SO)+c(HSO)+c(OH-),故c错;溶液显中性是c(H+)=c(OH-),带入电荷守恒等式可知a正确;由表知,在pH=7.2时,n(SO):n(HSO)=1:1,要使溶液显中性,n(HSO)要稍多,故c(HSO)> c(SO),则b正确。 (4)①在阳极发生的氧化反应,故HSO3-在阳极的电极反应式为:HSO3-+H2O-2e- =3H++SO42-;②再生,就是再生成SO,由图可知是在阴极区生成的,阴极发生的是还原反应,电极反应式为:2H+ +2e- == H2↑,使阴极区溶液显碱性,则会发生反应:HSO+ H+== SO+H2O,且Na+进入阴极室,从而使Na2SO3再生。 【答案】(1)SO2+H2O=H2SO3 2H2SO3+O2==2H2SO4 (2)SO2 +2OH- == SO32- + H2O (3)①酸性 HSO3-存在:HSO3-+ H2OH2SO3 +OH-和HSO3-SO+ H+,HSO3-的电离程度大于水解程度 ②a b (4)HSO3-+H2O-2e- =3H++SO42- ②H+在阴极得到电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生 26. (12分) (2012·北京高考·T26)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。 反应A:4HCl+O22Cl2+2H2O (1)已知:i .反应A中,4mol HCI被氧化,放出115.6kJ的热量。 ii . ①H2O的电子式是_______________。 ②反应A的热化学方程式是_______________。 ③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中 H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。 (2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。 ①曲线b对应的投料比是______________。 ②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投 料比的关系是_________________。 ③投料比为2:1,温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________。 【解析】(1)①根据O原子的最外层电子数,可写出H2O的电子式为:; ②根据“4mol HCI被氧化,放出115.6kJ的热量”可写出热化学方程式为: 4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1; 设断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量分别为x、y kJ·mol-1,则: (4×y+498 kJ·mol-1)-(4x+2×243 kJ·mol-1)= -115.6 kJ·mol-1,解得: y-x= -31.9 kJ·mol-1,故断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为32 kJ;由“y-x= -31.9 kJ·mol-1”知H—O键的键能高,更稳定。 (2)①据提高一种反应物的浓度,能够提高另一种反应的转化率,而本身的转化率降低,可知a、b、c、d对应的投料比依次是:6:1、4:1、2:1和1:1,故b对应的是4:1; ②因投料比越高,HCl的平衡转化率越小,故要达到相同的转化率,投料比越高,温度越低,因为该反应是放热反应,降低温度有利于平衡正向移动,提高HCl的转化率。 ③当投料比为2:1、温度为400℃时,HCl的转化率约为80%,此时: 4HCl+O22Cl2+2H2O 起始物质的量/mol 2 1 0 0 转化物质的量/mol 1.6 0.4 0.8 0.8 平衡物质的量/mol 0.4 0.6 0.8 0.8 故平衡混合气中氯气的物质的量分数为=30.8%。 【答案】(1)① ②4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1 ③32 kJ 强 (2)①4:1 ②投料比越高,对应的反应温度越低 ③30.8%。 27.(2012·北京高考·T27) (15分)有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。某同学进行如下验证和对比实验。 装置 实验序号 试管中的药品 现象 实验Ⅰ 2mL银氨溶液和数 滴较浓NaOH溶液 有气泡产生:一段时间后,溶液逐渐变黑:试管壁附着银镜 实验Ⅱ 2mL银氮溶液和 数滴浓氨水 有气泡产生: 一段时间后,溶液 无明显变化 该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料: a.Ag(NH3)2++2H2O=Ag++2NH3+H2O b.AgOH不稳定,极易分解为黑色Ag2O (I)配制银氨溶液所需的药品是 。 (2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。 ①用湿润的红色石蕊试纸检验NH3,产生的现象是 。 ②产生Ag2O的原因是 。 (3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O。实验及现象:向AgNO3 溶液中加入 ,出现黑色沉淀;水浴加热,未出现银镜。 (4)重新假设:在NaOH存在下可能是NH3还原Ag2O。用下图所示装置进行实验。现象:出现银镜。在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略)。 (5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成。由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应行如下实验: ①有部分Ag2O溶解在氨水中,该反应的化学方程式是 。 ②实验结果证实假设成立,依据的现象是 。 (6)用HNO3消洗试管壁上的Ag,该反应的化学方程式是 。 【解析】(1)配制银氨溶液的方法是:将氨水滴加到AgNO3溶液中,至生成的沉淀恰好溶解为止。 (2)①用湿润的红色石蕊试纸检验NH3时,会观察到试纸变蓝;②生成Ag2O的原因是: 在NaOH存在下,加热促进NH3.H2O的分解,逸出NH3,促使Ag(NH3)2++2H2OAg++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O; (3)若是NaOH还原Ag2O时,可向其中加入过量NaOH溶液; (4)石灰和浓 氨水制取NH3的最简装置为: (5)①Ag2O溶解在氨水中的反应方程式为:Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O;②若假设结果成立,则与溶液接触的试管壁上析出银镜; (6)银是不活泼的金属,其和硝酸反应的方程式和铜相似:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。 【答案】(1)AgNO3溶液和氨水 (2)①试纸变蓝; ②在NaOH存在下,加热促进NH3.H2O的分解,逸出NH3,促使Ag(NH3)2++2H2OAg++2NH3.H2O平衡正向移动,c(Ag+)增大,Ag+和OH-反应立即转化为Ag2O:2Ag++2OH-=Ag2O↓+H2O (3)过量NaOH溶液 (4) (5)①Ag2O+4NH3.H2O= 2Ag(NH3)2OH+3H2O ②与溶液接触的试管壁上析出银镜 (6)Ag+2HNO3(浓)=AgNO3+NO2↑+H2O 28. (17分) (2012·北京高考·T28) 优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下: 己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如: (1)B为芳香烃。 ①由B生成对孟烷的反应类型是 。 ②(CH3 )2 CHCl与A生成B的化学方程式是 。 ③A的同系物中相对分子质量最小的物质是 。 (2) 1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色。 ①F的官能团是 。 ②C的结构简式是 ③反应I的化学方程式是 。 (3)下列说法正确的是(选填字母) 。 a. B可使酸性高锰放钾溶液褪色 b. C不存在醛类同分异构体 c. D的酸性比E弱 d. E的沸点高于对孟烷 (4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。G与NaHCO3反应放出CO2。反应II的化学方程式是 。 【解析】本题有三个突破口,由易到难为: (1)G能“与NaHCO3反应放出CO2”说明含有羧基,分子式为C4H6O2,说明含有一个碳碳双键,“核磁共振氢谱有3种峰,其峰面积之比为3:2:1”可确定其结构简式为:。根据生成F的反应条件,可猜测E中应含有醇羟基。 (2)充分利用题目中的信息:,信息的反应对应在框图中,应该是生成B的反应和生成D的反应。由对孟烷和(CH3)2CHCl的结构可知化合物A应为,这一点也不太难。 (3)由D最终也生成对孟烷可知,C的结构应与相似。由“1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀”可知,C应属于酚,108g此酚会生成345 g沉淀。由反应+3Br2↓+3HBr可知,苯环上每有1mol H原子被取代,质量就会增加(80-1)g=79 g,现增加345 g-108g=237g,应有3 mol H原子被取代,故C的结构简式应为:。则D为,E为,F为。 另外,容易出错的是:(1)B是苯的同系物,故能使酸性高锰酸钾溶液褪色;(2)C的分子式为C7H8O,可能是醛类:CH≡C—CH=CHCH2CH2CHO;(3)E和对孟烷的碳原子数相等,但E中含有羟基,分子间存在氢键,故E的沸点高。 【答案】(1)①加成(还原)反应 ② ③苯 (2)①碳碳双键 ② ③ (3)ad (4)查看更多