- 2021-05-22 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】西藏自治区日喀则市南木林高级中学2019-2020学年高一第二学期期中考试试卷
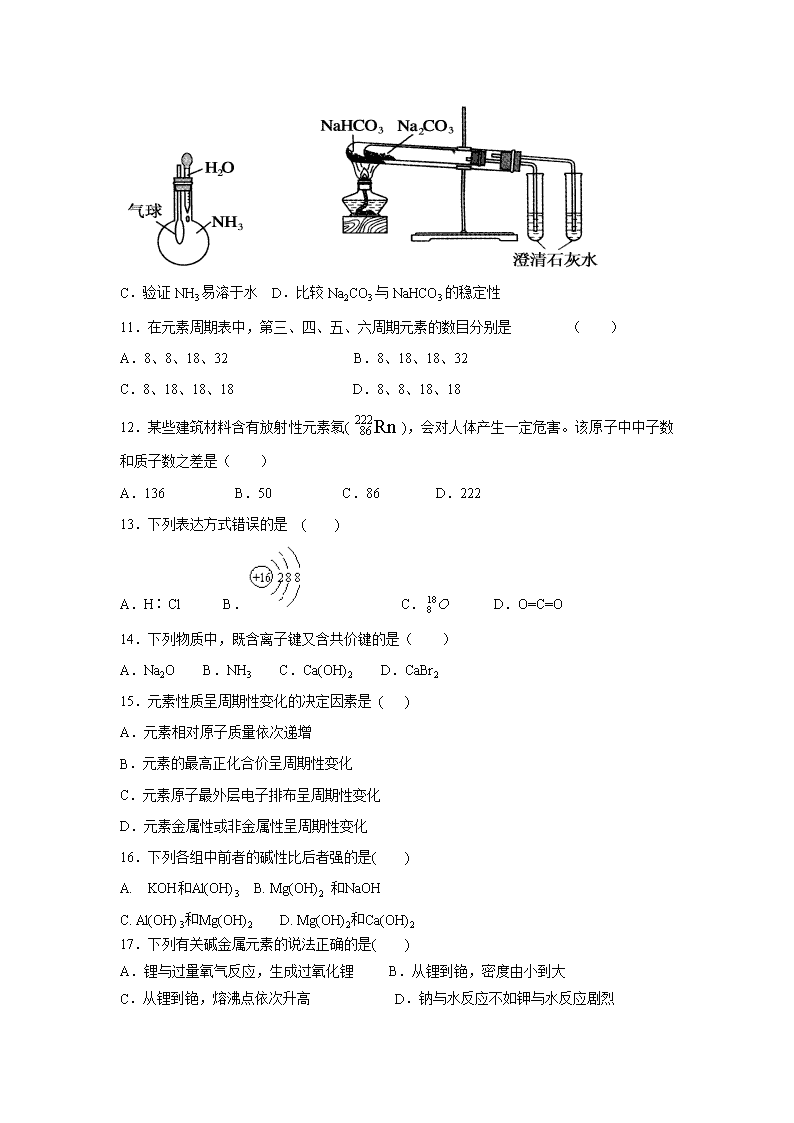
西藏自治区日喀则市南木林高级中学2019-2020学年高一第二学期期中考试试卷 注意事项: 1、本试题全部为笔答题,共2页,满分100分,考试时间60分钟。 2、答卷前将密封线内的项目填写清楚,密封线内禁止答题。 3、用钢笔或签字笔直接答在试卷(或答题纸上)。 4、本试题为闭卷考试,请考生勿将课本进入考场。 可能用到的相对原子质量: H-1 O-16 Cl-35.5 Na-23 Li-7 K-39 Rb-85 Cs-133 Ag-108 一. 选择题(每题3分,共60分) 1.下列关于浓硫酸的叙述正确的是 ( ) A.浓硫酸具有吸水性,因而能使蔗糖炭化 B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 D.浓硫酸在常温下能够使铁、铝等金属钝化 2.下列实验设计及其对应的离子方程式均正确的是( ) A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+ B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2 C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO- D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2+8H2O 3.19世纪门捷列夫的突出贡献是( ) A.提出了原子学说 B.提出了分子学说 C.发现了稀有气体 D.发现了元素周期律 4.检验SO2气体中是否混有CO2气体,可采用的方法是( ) A.通过品红溶液 B.通过澄清石灰水 C.先通过NaOH溶液,再通过澄清石灰水 D.先通过足量酸性KMnO4溶液,再通过澄清石灰水 5.浓硫酸在下列转化中,既表现出氧化性又表现出酸性的是( ) A.Cu―CuSO4 B.C―CO2 C.Fe(OH)3―Fe2(SO4)3 D.Fe2O3―Fe2(SO4)3 6.下列有关氨水和氯水的说法正确的是( ) A.含有的物质种类数相同 B.敞口放置后溶液的pH均可能减小 C.都能与SO2发生氧化还原反应 D.均具有强氧化性 7.久置在空气中不易变质的物质是( ) A.亚硫酸钠 B.硅酸钠 C.硫酸钠 D.漂白粉 8.下列关于物质性质的叙述中,正确的是( ) A.Cl2能与金属活动性顺序表中大多数金属反应 B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性 D.硅是应用广泛的半导体材料,常温下化学性质活泼 9.下列有关Cl、N、S等非金属元素化合物的说法正确的是( ) A.漂白粉的成分为次氯酸钙 B.实验室可用浓硫酸干燥氨气 C.实验室可用NaOH溶液处理NO2和HCl废气 D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒。 10.下列实验装置不能达到实验目的的是( ) A.用SO2做喷泉实验 B.验证Cu与浓硝酸反应的热量变化 C.验证NH3易溶于水 D.比较Na2CO3与NaHCO3的稳定性 11.在元素周期表中,第三、四、五、六周期元素的数目分别是 ( ) A.8、8、18、32 B.8、18、18、32 C.8、18、18、18 D.8、8、18、18 12.某些建筑材料含有放射性元素氡(),会对人体产生一定危害。该原子中中子数和质子数之差是( ) A.136 B.50 C.86 D.222 13.下列表达方式错误的是 ( ) A.H∶Cl B. C. D.O=C=O 14.下列物质中,既含离子键又含共价键的是( ) A.Na2O B.NH3 C.Ca(OH)2 D.CaBr2 15.元素性质呈周期性变化的决定因素是 ( ) A.元素相对原子质量依次递增 B.元素的最高正化合价呈周期性变化 C.元素原子最外层电子排布呈周期性变化 D.元素金属性或非金属性呈周期性变化 16.下列各组中前者的碱性比后者强的是( ) A. KOH和Al(OH)3 B. Mg(OH)2 和NaOH C. Al(OH)3和Mg(OH)2 D. Mg(OH)2和Ca(OH)2 17.下列有关碱金属元素的说法正确的是( ) A.锂与过量氧气反应,生成过氧化锂 B.从锂到铯,密度由小到大 C.从锂到铯,熔沸点依次升高 D.钠与水反应不如钾与水反应剧烈 18.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( ) A.元素X与元素Z的最高正化合价之和的数值等于8 B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ C.离子Y2-和Z 3+的核外电子数和电子层数都相同 D.元素W的最高价氧化物对应的水化物的酸性比Q的强 19.下列氢化物中稳定性由强到弱的顺序正确的是( ) A.CH4>NH3>H2O>HF B.SiH4>NH3>H2S>HCl C.HF>H2O>NH3>PH3 D.NH3>PH3>H2S>HBr 20.6O和18O是氧元素的两种核素,下列说法正确的是 ( ) A. 16O2与18O2互为同分异构体 B. 16O与18O核外电子排布方式不同 C. 通过化学变化可以实现16O与18O间的相互转化 D. 标准状况下,1.12 L 16O2和1.12 L 18O2均含有0.1NA个氧原子 二.非选择题(每空2分,共40分) 21.(每空1分,共12分)下表是元素周期表的一部分,按要求填空(填元素符号或化学式): 族 周期 IA IIA IIIA IVA VA VIA VIIA 0 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ 4 ⑩ ⑾ ⑿ (1)写出下列元素的元素符号:① ,⑾ (2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。 (3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。 (4)在③与④的单质中,化学性质较活泼的是 ,判断依据是 ;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是 。 22.(每空2分,共16分)实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题: (1)A、B两仪器的名称:A________,B________。 (2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入下列溶液中的C______________;D______________。 ①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4 (3)E中为红色干布条,F中为红色湿布条,可观察到的现象是______________________________。 (4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成____________。反应的离子方程式是______________________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成________。 23.(每空2分,共12分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题: (1) B元素在周期表中的位置是_______________________________________________。 (2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)__________________________。 (3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式: ①_____________________________________________________________________; ②________________________________________________________________________。 (4) D、A按原子个数比3∶2形成化合物丙的化学式为____________。 (5) B、C可按原子个数比1∶1形成化合物乙的电子式____________。 【参考答案】 一:选择题 1 2 3 4 5 6 7 8 9 10 D A D D A B C A C D 11 12 13 14 15 16 17 18 19 20 B B B C C A D A C D 二:非选择题 21,(每空1分,共12分) (1)N;Ca (2)K;F;Ne (3)HClO4 ;KOH;Al(OH)3 (4)Na;钠与冷水剧烈反应,而镁与冷水几乎不反应 ;Cl2;氯气可以与溴化钾反应,置换出单质溴。 22,(每空2分,共12分) (1)分液漏斗 圆底烧瓶 (2)② ④ (3)E中无变化,F中红色布条褪色 (4)蓝色 2I-+Cl2===2Cl-+I2 橙色 23,(每空2分,共12分) (1)第二周期ⅥA族 (2)Na>Mg>Al>N>O (3)Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO+2H2O (4)Mg3N2 (5)过氧化钠的电子式 查看更多