- 2021-05-22 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习高考非选择题五大题型突破题型2化学工艺流程教案(全国通用)
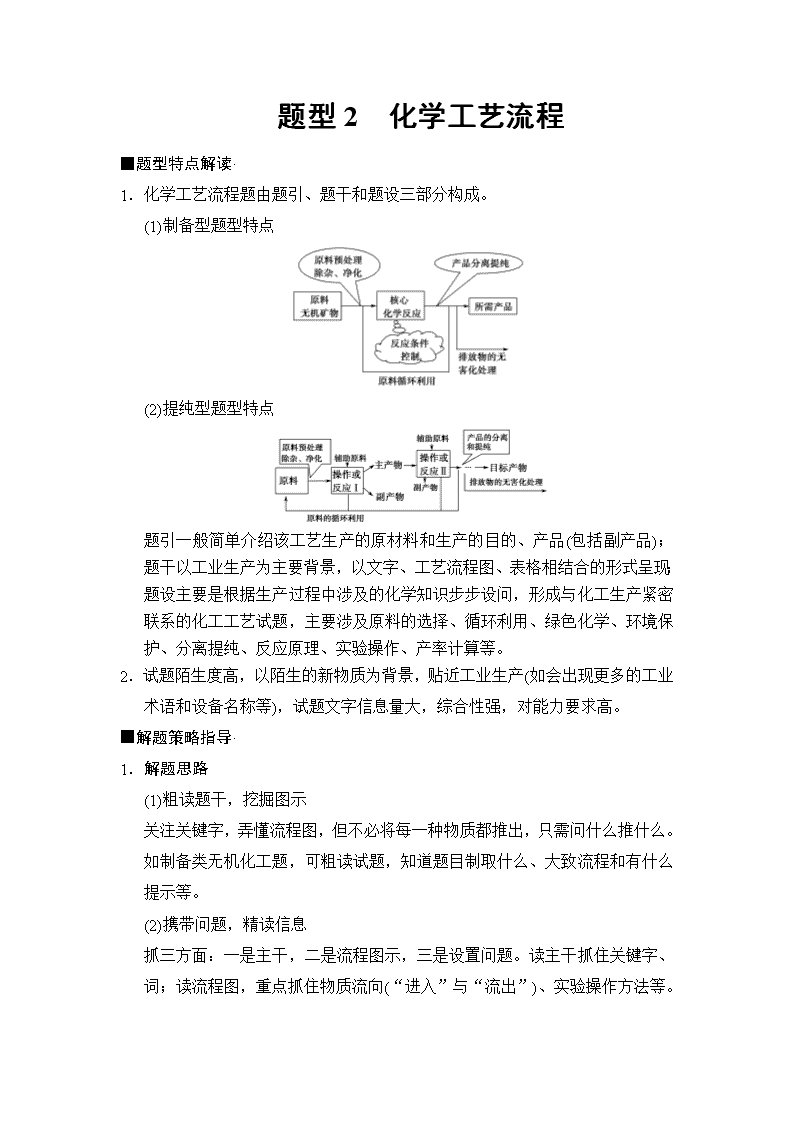
题型2 化学工艺流程 ■题型特点解读· 1.化学工艺流程题由题引、题干和题设三部分构成。 (1)制备型题型特点 (2)提纯型题型特点 题引一般简单介绍该工艺生产的原材料和生产的目的、产品(包括副产品);题干以工业生产为主要背景,以文字、工艺流程图、表格相结合的形式呈现;题设主要是根据生产过程中涉及的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题,主要涉及原料的选择、循环利用、绿色化学、环境保护、分离提纯、反应原理、实验操作、产率计算等。 2.试题陌生度高,以陌生的新物质为背景,贴近工业生产(如会出现更多的工业术语和设备名称等),试题文字信息量大,综合性强,对能力要求高。 ■解题策略指导· 1.解题思路 (1)粗读题干,挖掘图示 关注关键字,弄懂流程图,但不必将每一种物质都推出,只需问什么推什么。如制备类无机化工题,可粗读试题,知道题目制取什么、大致流程和有什么提示等。 (2)携带问题,精读信息 抓三方面:一是主干,二是流程图示,三是设置问题。读主干抓住关键字、词;读流程图,重点抓住物质流向(“进入”与“流出”)、实验操作方法等。 (3)跳跃思维,规范答题 答题时应注意前后问题往往没有“相关性”,即前一问未答出,不会影响后面答题。 2.破题关键 (1)看原料:明确化工生产或化学实验所需的材料。 (2)看目的:把握题干中的“制备”或“提纯”等关键词,确定化工生产或化学实验的目的。 (3)看箭头:进入的是投料(即反应物);出去的是生成物(包括主产物和副产物)。 (4)看三线:主线主产品;分支副产品;回头为循环。 (5)找信息:明确反应条件的控制和分离提纯方法。 (6)关注所加物质的可能作用:参与反应、提供反应氛围、满足定量要求。 3.破题方法 (1)首尾分析法:对一些线型流程工艺(从原料到产品为一条龙的生产工序)试题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),从对比分析中找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和除杂、分离、提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答。 (2)分段分析法:对于用同样的原材料生产多种(两种或两种以上)产品(包括副产品)的工业流程题,用分段分析法更容易找到解题的切入点。 (3)交叉分析法:有些化工生产选用多组原材料,先合成一种或几种中间产品,再用这一中间产品与部分其他原材料生产所需的主流产品,这种题适合用交叉分析法。就是将提供的工业流程示意图结合常见化合物的制取原理划分成几条生产流水线,然后上下交叉分析。 ■典例剖析示范· 制备型工艺流程题 (2017·全国Ⅰ卷)①都是锂离子电池的电极材料,可利用②来制备。工艺流程如下: 回答下列问题: (1)“酸浸”实验中,铁的浸出率结果如下图所示。④,所采用的实验条件为______________。 (2)“酸浸”后,钛主要以⑤形式存在,写出相应反应的离子方程式_________________________________________________________________ ________________________________________________________________。 (3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示: 温度/℃ 30 35 40 45 50 TiO2·xH2O转化率/% 92 95 97 93 88 分析⑥的原因__________________________。 (4)Li2 Ti5O15中Ti的化合价为+4,其中过氧键的数目为________。 (5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,⑦,使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?________⑦。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0× 10-24。 (6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式__________ ________________________________________________________________。 ①明确目的:生产目的是制备Li4Ti5O12和LiFePO4。 ②明确原料:明确主要成分和杂质。 ③核心反应:盐酸酸浸、双氧水氧化(氨水、磷酸)、高温煅烧等。 ④识图像:坐标含义,关键点。从关键点分析条件为“100 ℃、2h或90 ℃、5h”。 ⑤信息理解:从生成物分析钛的化合价变化,进而确定反应情况。 ⑥表格信息:结合物质性质,温度过高H2O2及NH3·H2O分解。 ⑦关注细节:溶液体积加倍,离子浓度变为原来的一半;列式计算,不能直接写出计算结果。 【解析】 (1)根据图像分析,当铁的浸出率为70%时,所采用的实验条件为100 ℃、2 h,90 ℃、5 h。 (2)“酸浸”时,发生反应的离子方程式为FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O。 (3)当温度低于40 ℃时,H2O2、NH3·H2O不易分解,但是温度低,反应速率慢,TiO2·xH2O转化率低;当温度高于40 ℃时,H2O2分解,NH3逸出,反应物浓度降低,反应速率下降,TiO2·xH2O的转化率低。 (4)设Li2Ti5O15中过氧键的数目为x,则非过氧键氧原子数目为15-2x,根据化合物中各元素正、负化合价代数和为零可得:2x+2×(15-2x)=1×2+4×5,解得:x=4。 (5)根据Ksp(FePO4)=1.3×10-22及Fe3+恰好完全沉淀时溶液中c(Fe3+)=1.0×10-5 mol·L-1,可得c(PO)= mol·L-1=1.3×10-17 mol·L-1。c(Mg2+)= mol·L-1=0.01 mol·L-1,则c3(Mg2+)·c2(PO)=0.013×(1.3×10-17)2=1.69×10-40≈1.7×10-40查看更多
- 当前文档收益归属上传用户
- 下载本文档