- 2021-05-22 发布 |
- 37.5 KB |
- 19页

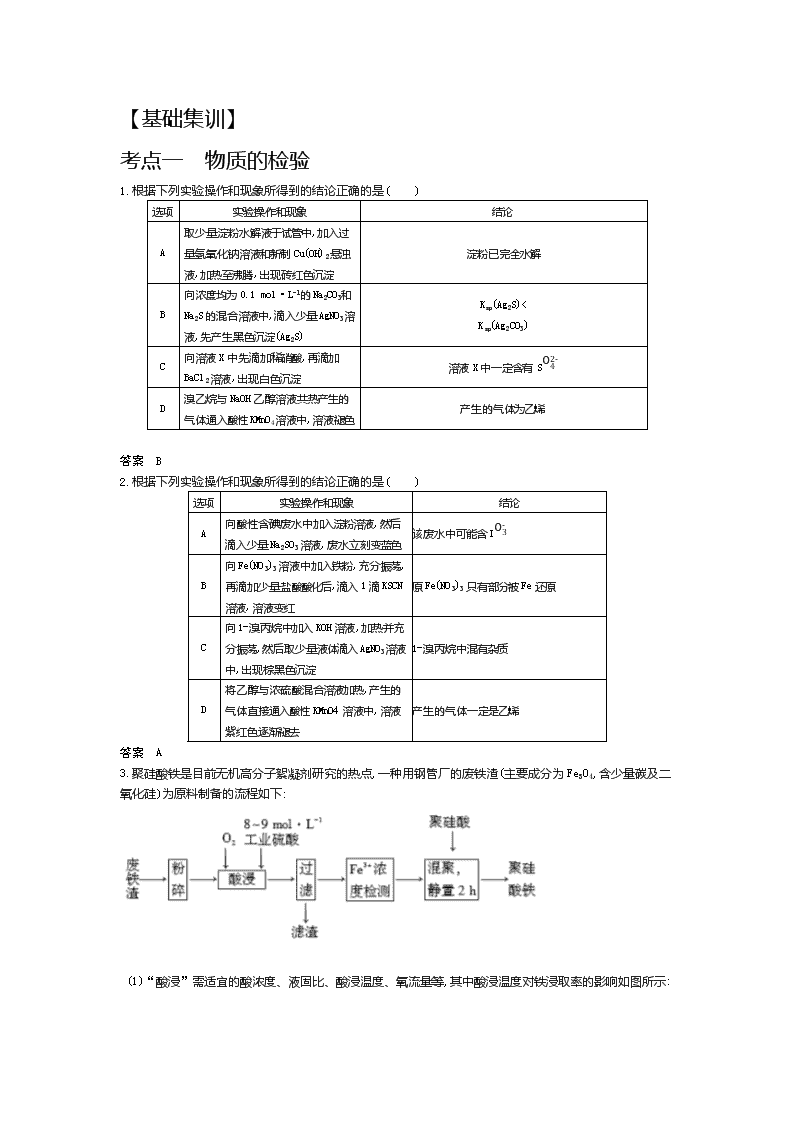
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习人教版专题17 物质的检验、分离与提纯作业(江苏专用)
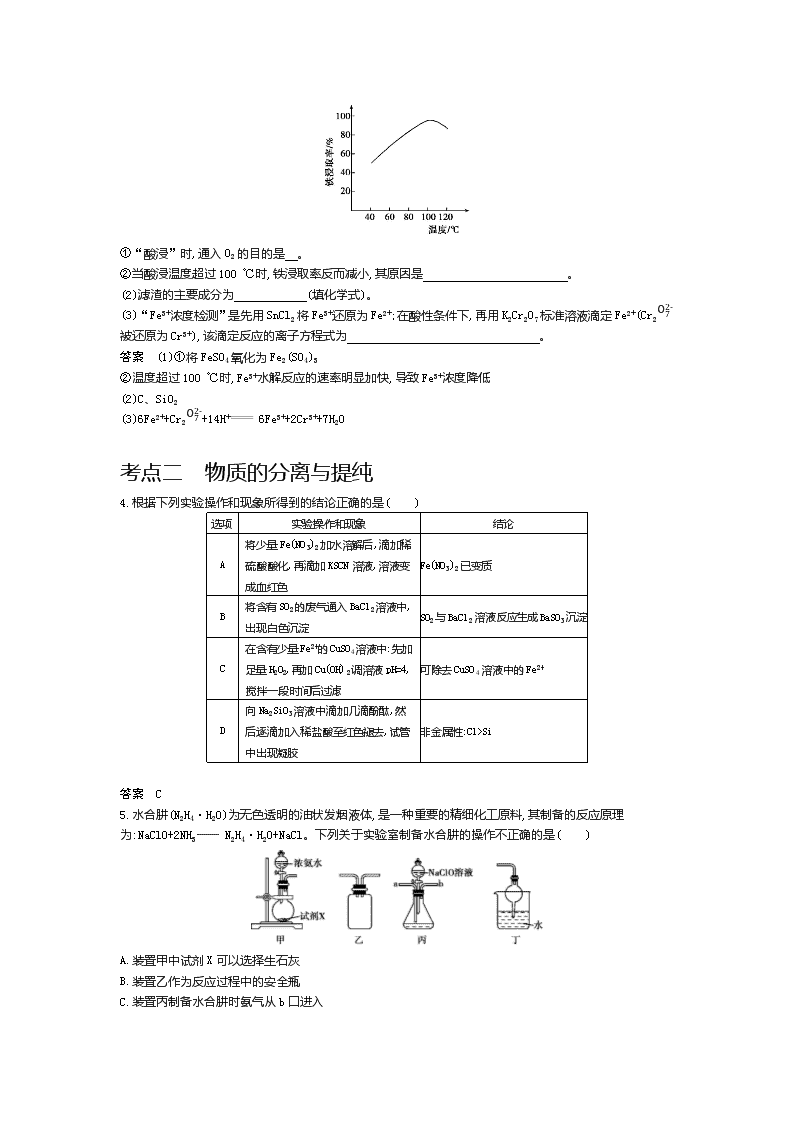
专题17 物质的检验、分离与提纯 备考篇提纲挈领 【考情探究】 课 标 解 读 考点 物质的检验 物质的分离与提纯 解读 掌握常见物质检验的方法 掌握常见物质分离和提纯的方法 考情分析 本专题以中等题和难题为主。设题形式有选择题、实验题、计算题。选择题通常以“判断指定实验操作和现象的结论是否正确”为切入口,以表格的形式既考查元素化合物知识又考查实验常识;实验题通常以工业生产上实际问题为载体,层层递进设问,涉及元素化合物知识及相关实验知识;计算题中前两个空有时会考查实验基础知识 备考指导 2021年高考备考一定要重点关注“实验基础知识”,如酸性(酸根结合H+能力)强弱比较、氧化性强弱比较、萃取分液、制备Fe(OH)3胶体、检验Fe2+和Fe3+等 【真题探秘】 基础篇固本夯基 【基础集训】 考点一 物质的检验 1.根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 结论 A 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀 淀粉已完全水解 B 向浓度均为0.1 mol·L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,先产生黑色沉淀(Ag2S) Ksp(Ag2S)< Ksp(Ag2CO3) C 向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀 溶液X中一定含有SO42- D 溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中,溶液褪色 产生的气体为乙烯 答案 B 2.根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 结论 A 向酸性含碘废水中加入淀粉溶液,然后滴入少量Na2SO3溶液,废水立刻变蓝色 该废水中可能含IO3- B 向Fe(NO3)3溶液中加入铁粉,充分振荡,再滴加少量盐酸酸化后,滴入1滴KSCN溶液,溶液变红 原Fe(NO3)3只有部分被Fe还原 C 向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液中,出现棕黑色沉淀 1-溴丙烷中混有杂质 D 将乙醇与浓硫酸混合溶液加热,产生的气体直接通入酸性KMnO4溶液中,溶液紫红色逐渐褪去 产生的气体一定是乙烯 答案 A 3.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分为Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下: (1)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示: ①“酸浸”时,通入O2的目的是 。 ②当酸浸温度超过100 ℃时,铁浸取率反而减小,其原因是 。 (2)滤渣的主要成分为 (填化学式)。 (3)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为 。 答案 (1)①将FeSO4氧化为Fe2(SO4)3 ②温度超过100 ℃时,Fe3+水解反应的速率明显加快,导致Fe3+浓度降低 (2)C、SiO2 (3)6Fe2++Cr2O72-+14H+ 6Fe3++2Cr3++7H2O 考点二 物质的分离与提纯 4.根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 结论 A 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 Fe(NO3)2已变质 B 将含有SO2的废气通入BaCl2溶液中,出现白色沉淀 SO2与BaCl2溶液反应生成BaSO3沉淀 C 在含有少量Fe2+的CuSO4溶液中:先加足量H2O2,再加Cu(OH)2调溶液pH=4,搅拌一段时间后过滤 可除去CuSO4溶液中的Fe2+ D 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,试管中出现凝胶 非金属性:Cl>Si 答案 C 5.水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为:NaClO+2NH3 N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( ) A.装置甲中试剂X可以选择生石灰 B.装置乙作为反应过程中的安全瓶 C.装置丙制备水合肼时氨气从b口进入 D.装置丁可用于吸收多余的尾气 答案 C 6.下列有关实验装置进行的相应实验,能达到实验目的的是( ) A.利用图1所示装置制取少量NH3 B.利用图2所示装置制备Fe(OH)3胶体 C.利用图3所示装置收集HCl D.利用图4所示装置检验是否生成乙烯 答案 A 综合篇知能转换 【综合集训】 1.(2019苏州期末,5)下列有关实验装置正确且能达到实验目的的是( ) A.用图1所示装置制取少量乙酸乙酯 B.用图2所示装置验证SO2的漂白性 C.用图3所示装置配制100 mL 0.100 mol·L-1的硫酸溶液 D.用图4所示装置分离水和溴苯 答案 D 2.(2018南京、盐城一模,4)一种从含Br-废水中提取Br2的过程包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知: Br2 CCl4 正十二烷 密度/g·cm-3 3.119 1.595 0.753 沸点/℃ 58.76 76.8 215~217 下列说法正确的是( ) A.用甲装置过滤时,需不断搅拌 B.用乙装置将Br-氧化为Br2 C.丙装置中用正十二烷而不用CCl4,是因为正十二烷密度小 D.可用装置丁进行蒸馏,先收集正十二烷再收集Br2 答案 B 3.[2020届盐城中学学情测试一,21(2)(3)]FeC2O4·2H2O(草酸亚铁)是淡黄色结晶性粉末,难溶于水,在碱性或中性溶液中不稳定。它广泛应用于新型电池材料、感光材料等。一种用钛白副产物硫酸亚铁[含TiOSO4、Al2(SO4)3、MnSO4及重金属盐]制取电池级草酸亚铁的实验步骤如下: 步骤1:将固体钛白副产物硫酸亚铁溶于水,搅拌,加热至95 ℃,并加入还原铁粉 步骤2:维持pH为4~5,静置6 h、过滤,得纯净的FeSO4溶液 步骤3:在搅拌条件下,控制温度约40 ℃,加入氨水沉铁 步骤4:将草酸溶液滴入氢氧化亚铁悬浊液中,并用硫酸调节pH约为2 步骤5:过滤、洗涤、烘干 (2)步骤3控制的温度不宜过高,其原因是 。 (3)步骤5洗涤时,检验洗涤是否完全的方法是 。 答案 (2)温度过高会导致氨水挥发、生成的Fe(OH)2分解和氧化 (3)取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全 应用篇知行合一 【应用集训】 1.(2020届扬州中学开学测试,4)下列实验装置与描述正确的是( ) A.装置①:用于吸收HCl气体 B.装置②:用于除去CO2中的HCl C.装置③:配制1 mol·L-1 NaCl溶液时的定容操作 D.装置④:滴有淀粉碘化钾溶液的纸蝴蝶变蓝 答案 D 2.(2019苏南苏北五校联考二,12)下列根据实验操作和现象所得出的结论正确的是( ) 选项 实验操作 实验现象 结论 A 用铂丝蘸取少量某无色溶液进行焰色反应 火焰呈黄色 该溶液一定是钠盐溶液 B 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X 加热后未出现砖红色沉淀 X中一定不含醛基 C 将FeSO4加强热,得红色固体,产生的气体通入BaCl2溶液 产生白色沉淀 白色沉淀为BaSO4 D 在漂白粉中滴入70%的硫酸 产生黄绿色气体 说明硫酸具有氧化性 答案 C 3.[2020届盐城中学学情测试,22(2)]硫的化合物在生产生活中有广泛应用。 (2)工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3。KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.126 0 g成品溶于水并加入淀粉作指示剂,再用0.010 00 mol·L-1 KIO3酸性标准溶液滴定至终点,消耗KIO3溶液31.25 mL。 ①滴定终点观察到的现象为 。 ②成品中Na2SO3的质量分数是 。 答案 (2)①加入最后一滴KIO3标准溶液时,溶液由无色变为蓝色,且30 s内不变色 ②93.75% 4.[2019泰州中学、宜兴中学联考,20(2)(3)]含重金属离子(如铬、锰、铅等)废水的常见处理方法有化学还原法、化学氧化法、吸附法等。 (2)化学氧化法除Mn2+。 ①相同条件下,按Ⅰ、Ⅱ两种方案氧化除去水样中Mn2+,测定不同pH、相同反应时间的c(Mn2+),结果如图1所示,产生该差异的可能原因是 。 ②氧化实验中除Mn2+的最佳条件为 。 图1 (3)石墨烯吸附法除Pb2+。不同的pH会使石墨烯吸附剂表面带上不同的电荷,图2为pH对Pb2+吸附率的影响,其原因是 。 图2 答案 (2)①MnO2对Mn2+的氧化有催化作用 ②MnO2作催化剂,pH控制在9左右 (3)随pH增大,吸附剂表面吸附的OH-越多,带负电荷越多,越有利于吸附带正电荷的Pb2+ 【五年高考】 考点一 物质的检验 1.(2018江苏单科,12,4分)根据下列实验操作和现象所得出的结论正确的是( ) 选项 实验操作和现象 结论 A 向苯酚浊液中滴加Na2CO3溶液,浊液变清 苯酚的酸性强于H2CO3的酸性 B 向碘水中加入等体积CCl4 ,振荡后静置,上层接近无色,下层显紫红色 I2在CCl4 中的溶解度大于在水中的溶解度 C 向CuSO4溶液中加入铁粉,有红色固体析出 Fe2+的氧化性强于Cu2+的氧化性 D 向NaCl、NaI 的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI) 答案 B 2.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 实验结论 A 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 苯酚浓度小 B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 部分Na2SO3被氧化 C 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜 蔗糖未水解 D 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 溶液中含Br2 答案 B 3.(2015江苏单科,13,4分)下列设计的实验方案能达到实验目的的是( ) A.制备Al(OH)3悬浊液:向1 mol·L-1 AlCl3溶液中加过量的6 mol·L-1 NaOH溶液 B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡后静置分液,并除去有机相的水 C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 答案 BD 4.(2019课标Ⅱ,26,13分)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题: (1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为 (填标号)。 A.黄色 B.红色 C.紫色 D.绿色 (2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉: ①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为 。 回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为 。 ②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的 (填化学式)。 ③沉淀器中反应的离子方程式为 。 (3)成品中S2-的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取25.00 mL 0.100 0 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉为指示剂,过量的I2用0.100 0 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2S2O32- 2I-+S4O62-。测定时消耗Na2S2O3溶液体积V mL。终点颜色变化为 ,样品中S2-的含量为 (写出表达式)。 答案 (1)D (2)①BaSO4+4C BaS+4CO↑ CO+H2O CO2+H2 ②BaCO3 ③S2-+Ba2++Zn2++SO42- BaSO4·ZnS↓ (3)浅蓝色至无色 (25.00-12V)×0.100 0×32m×1 000×100% 考点二 物质的分离与提纯 5.(2019课标Ⅲ,10,6分)离子交换法净化水过程如图所示。下列说法中错误的是( ) A.经过阳离子交换树脂后,水中阳离子的总数不变 B.水中的NO3-、SO42-、Cl-通过阴离子树脂后被除去 C.通过净化处理后,水的导电性降低 D.阴离子树脂填充段存在反应H++OH-H2O 答案 A 6.[2016江苏单科,19(3)(4),9分]实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下: (3)用下图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。 ①实验装置图中仪器A的名称为 。 ②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。 (4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50 ℃下干燥,得到MgCO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。 答案 (3)①分液漏斗 ②充分振荡(每空2分) (4)至5查看更多