- 2021-05-22 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习常见金属元素单质及其化合物学案(全国通用)
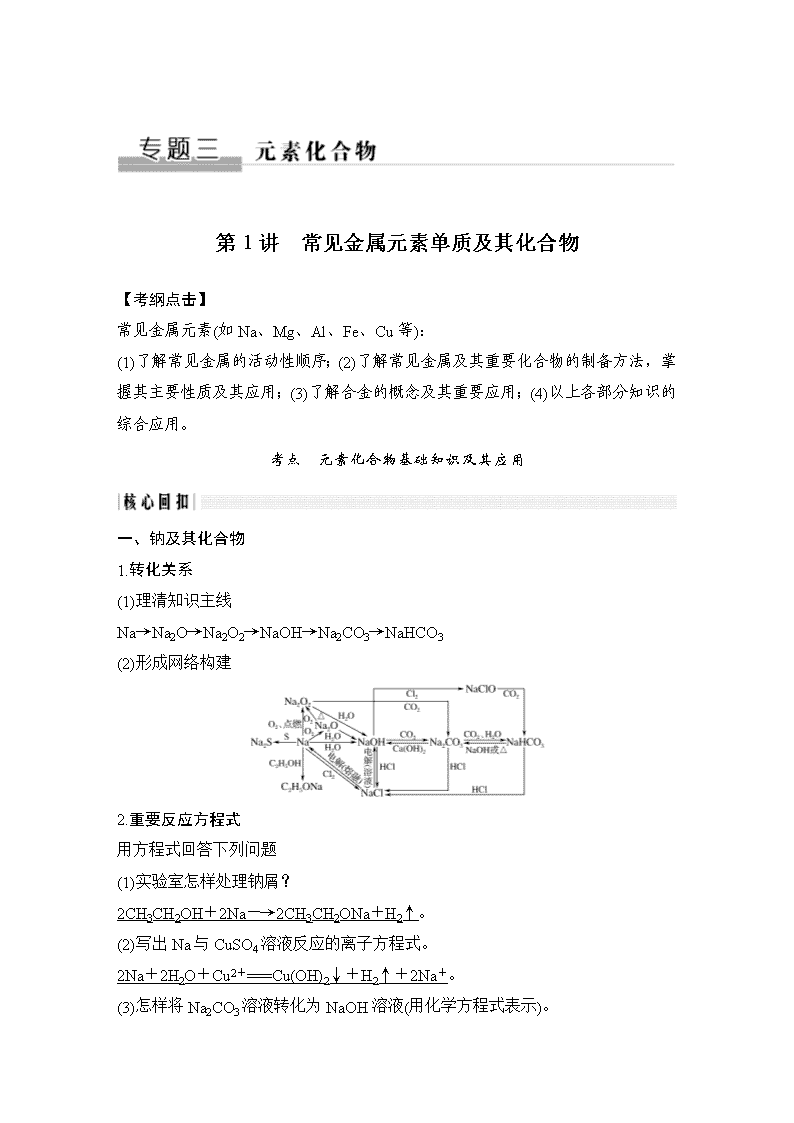
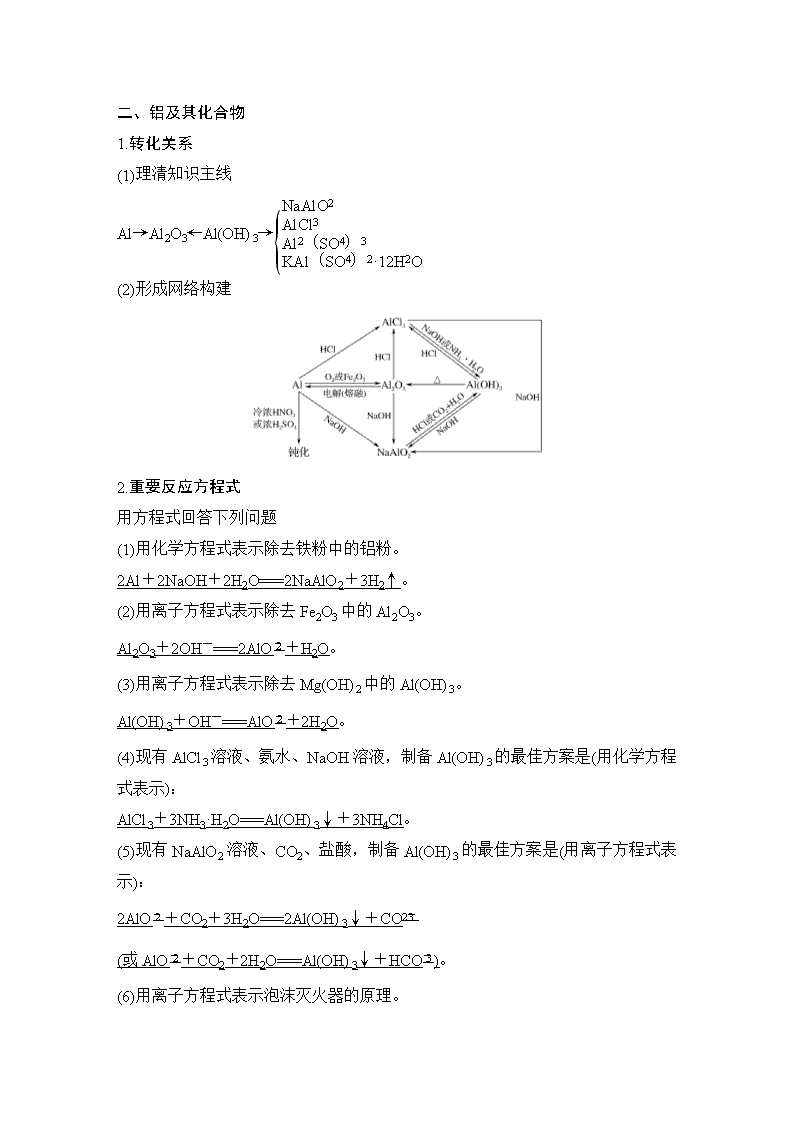
第1讲 常见金属元素单质及其化合物 【考纲点击】 常见金属元素(如Na、Mg、Al、Fe、Cu等): (1)了解常见金属的活动性顺序;(2)了解常见金属及其重要化合物的制备方法,掌握其主要性质及其应用;(3)了解合金的概念及其重要应用;(4)以上各部分知识的综合应用。 考点 元素化合物基础知识及其应用 一、钠及其化合物 1.转化关系 (1)理清知识主线 Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3 (2)形成网络构建 2.重要反应方程式 用方程式回答下列问题 (1)实验室怎样处理钠屑? 2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑。 (2)写出Na与CuSO4溶液反应的离子方程式。 2Na+2H2O+Cu2+===Cu(OH)2↓+H2↑+2Na+。 (3)怎样将Na2CO3溶液转化为NaOH溶液(用化学方程式表示)。 Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。 (4)向NaOH、Na2CO3、NaHCO3溶液中逐滴加入盐酸,发生反应的离子方程式。 OH-+H+===H2O;CO+H+===HCO; HCO+H+===H2O+CO2↑。 (5)怎样除去CO2中的SO2气体(用离子方程式表示)。 SO2+2HCO===2CO2↑+SO+H2O。 (6)怎样除去Na2CO3溶液中的NaHCO3(用离子方程式表示)。 HCO+OH-===CO+H2O。 (7)怎样除去NaHCO3溶液中的Na2CO3(用离子方程式表示)。 CO+H2O+CO2===2HCO。 (8)用化学方程式表示呼吸面具中产生O2的原理。 2Na2O2+2H2O===4NaOH+O2↑; 2Na2O2+2CO2===2Na2CO3+O2。 3.知识盲点 (1)钠和盐溶液反应,不能置换出盐中的金属,与熔融的盐反应才能置换出盐中的金属。 (2)无论Na与O2反应生成Na2O还是Na2O2,只要参与反应的Na的质量相等,则转移电子的物质的量一定相等,但得到Na2O2的质量大于Na2O的质量。 (3)1 mol Na2O2参与反应转移电子的物质的量不一定为1 mol,如Na2O2与SO2反应生成Na2SO4转移电子的物质的量应为2 mol。 (4)Li和O2反应只生成Li2O;NaH是离子化合物,是一种强还原剂。Na2O、Na2O2阴阳离子个数比均为1∶2。 (5)不能用Ca(OH)2鉴别Na2CO3和NaHCO3溶液,应选用CaCl2或BaCl2溶液。 (6)除去CO2中的HCl气体,应选用饱和的NaHCO3溶液,不能用NaOH溶液、Na2CO3溶液。 (7)向饱和的Na2CO3溶液中通入过量CO2,有晶体析出。 (8)焰色反应是元素的性质,无论是游离态还是化合态,均具有相同的焰色反应,但不是化学变化,在观察钾元素的焰色反应时,应透过蓝色钴玻璃。 二、铝及其化合物 1.转化关系 (1)理清知识主线 Al→Al2O3←Al(OH)3→ (2)形成网络构建 2.重要反应方程式 用方程式回答下列问题 (1)用化学方程式表示除去铁粉中的铝粉。 2Al+2NaOH+2H2O===2NaAlO2+3H2↑。 (2)用离子方程式表示除去Fe2O3中的Al2O3。 Al2O3+2OH-===2AlO+H2O。 (3)用离子方程式表示除去Mg(OH)2中的Al(OH)3。 Al(OH)3+OH-===AlO+2H2O。 (4)现有AlCl3溶液、氨水、NaOH溶液,制备Al(OH)3的最佳方案是(用化学方程式表示): AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。 (5)现有NaAlO2溶液、CO2、盐酸,制备Al(OH)3的最佳方案是(用离子方程式表示): 2AlO+CO2+3H2O===2Al(OH)3↓+CO (或AlO+CO2+2H2O===Al(OH)3↓+HCO)。 (6)用离子方程式表示泡沫灭火器的原理。 Al3++3HCO===Al(OH)3↓+3CO2↑。 (7)用离子方程式分别表示 ①Al3+、AlO;②AlO、HCO不能大量共存的原理。 a.Al3++3AlO+6H2O===4Al(OH)3↓; b.AlO+H2O+HCO===Al(OH)3↓+CO。 (8)用离子方程式表示KAl(SO4)2和Ba(OH)2的反应。 ①沉淀的物质的量最大;②沉淀的质量最大。 a.2Al3++3SO+6OH-+3Ba2+===2Al(OH)3↓+3BaSO4↓; b.Al3++2SO+2Ba2++4OH-===AlO+2H2O+2BaSO4↓。 (9)铵明矾[NH4Al(SO4)2·12H2O]是常见的食品添加剂,用于焙烤食品,向铵明矾溶液中逐滴滴入NaOH溶液,试写出反应的离子方程式。 Al3++3OH-===Al(OH)3↓; NH+OH-===NH3·H2O; Al(OH)3+OH-===AlO+2H2O。 (10)写出铝热反应的化学方程式。 2Al+Fe2O32Fe+Al2O3。 3.知识盲点 (1)铝是活泼金属,但铝抗腐蚀性相当强,因为铝表面生成一层致密的氧化物薄膜。由于Al2O3的熔点高于Al的熔点,故在酒精灯上加热铝箔直至熔化,发现熔化的铝并不滴落。 (2)铝热反应不仅仅是单质铝与Fe2O3反应,还包含制取其他难熔金属的反应,但铝热反应不能用于工业上冶炼铁。注意铝热反应是中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。 (3)引发铝热反应的操作是高考实验考查的热点,具体操作是先铺一层KClO3,然后插上镁条,最后点燃镁条。 (4)并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属的活泼性应比铝弱。 (5)Al2O3、Al(OH)3与NaOH溶液的反应常用于物质的分离提纯。Al(OH)3不溶于氨水,所以实验室常用铝盐和氨水来制备Al(OH)3。 (6)利用偏铝酸盐制备Al(OH)3,一般不用强酸,因为强酸的量控制不当会使制得的Al(OH)3溶解。若向偏铝酸盐溶液中通入CO2,生成的Al(OH)3不溶于碳酸,CO2过量时生成HCO,不过量时生成CO,书写离子反应方程式时要特别注意。 (7)Al(OH)3可用作抗酸药,明矾常用于净水。 (8)泡沫灭火器所用试剂为Al2(SO4)3溶液和NaHCO3溶液。 三、铁及其化合物 1.转化关系 (1)清理知识主线 Fe→→→ (2)形成网络构建 2.重要反应方程式 用方程式回答下列问题。 (1)高温下铁和H2O(g)的反应。 4H2O(g)+3FeFe3O4+4H2。 (2)①铁在氯气中燃烧 2Fe+3Cl22FeCl3。 ②铁与晶体碘混合研磨 Fe+I2===FeI2。 (3)用离子方程式表示将铁粉逐渐加入稀HNO3中的反应过程。 Fe+4H++NO===Fe3++NO↑+2H2O; 2Fe3++Fe===3Fe2+。 (4)①用离子方程式表示Fe3O4与盐酸反应 Fe3O4+8H+===Fe2++2Fe3++4H2O。 ②用离子方程式表示Fe(OH)3与氢碘酸反应 2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O。 (5)用化学方程式表示铁发生吸氧腐蚀生成铁锈的过程。 负极:2Fe-4e-===2Fe2+, 正极:O2+4e-+2H2O===4OH-, Fe2++2OH-===Fe(OH)2↓, 4Fe(OH)2+O2+2H2O===4Fe(OH)3, Fe(OH)3脱去一部分水生成Fe2O3·xH2O。 (6)怎样除去Fe2(SO4)3中的FeSO4(用适当的文字和离子方程式说明)。 加入H2SO4酸化的H2O2,2H++2Fe2++H2O2===2Fe3++2H2O。 (7)怎样检验Fe2O3中的FeO(用适当的文字和离子方程式说明)。 ①取少量样品于试管中,加稀H2SO4使其溶解,离子方程式为 Fe2O3+6H+===2Fe3++3H2O, FeO+2H+===Fe2++H2O。 ②再加入少量酸性KMnO4溶液,若紫红色褪去,证明溶液中含有Fe2+,原样品中含有FeO,离子方程式为 5Fe2++MnO+8H+===5Fe3++Mn2++4H2O。 (8)怎样检验FeCl3溶液中的Fe3+(用适当的文字和离子方程式说明)。 取少量样品于试管中,加入几滴KSCN溶液,溶液呈血红色,证明溶液中含有Fe3+,离子方程式为Fe3++3SCN-===Fe(SCN)3。 3.知识盲点 (1)Fe与O2(在O2中燃烧)、H2O(g)反应的产物都是Fe3O4而不是Fe2O3。Fe与Cl2反应时生成FeCl3,与S反应时生成FeS,说明Cl2的氧化能力大于S。Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3。 (2)向含Fe2+的溶液中加入硝酸、KMnO4 溶液、氯水等具有强氧化性的物质时,溶液会出现浅绿色→棕黄色的颜色变化,该现象可用于Fe2+的检验。 (3)Fe3+的检验方法较多,效果最好最灵敏的方法是KSCN溶液法。Fe2+的检验方法较多,其中无干扰检验的方法是K3[Fe(CN)6]溶液法。现象是生成蓝色沉淀(Fe3[Fe(CN)6]2)。 (4)配制FeCl2溶液既要防氧化(加入Fe粉),又要防水解(加入盐酸);配制FeCl3溶液要加入浓盐酸防止水解,Fe3+只能存在酸性溶液中,pH=7时几乎完全水解。 (5)制备Fe(OH)2的方法很多,原则有两点:一是溶液中的溶解氧必须提前除去;二是反应过程中必须与O2隔绝。同时要牢记Fe(OH)2转化为Fe(OH)3时溶液的颜色变化(白色沉淀迅速变成灰绿色,最后变成红褐色)。 (6)常温下,Fe、Al在冷的浓硫酸和浓硝酸中发生钝化,但加热后继续反应。 四、铜及其化合物 1.转化关系 (1)理清知识主线 Cu→←Cu(OH)2→ (2)形成网络构建 2.重要反应方程式 用方程式回答下列问题。 (1)用两组方程式表示Cl2的氧化性大于S。 ①2Fe+3Cl22FeCl3,Fe+SFeS。 ②Cu+Cl2CuCl2,2Cu+SCu2S。 (2)铜在潮湿的空气中生锈。 2Cu+O2+H2O+CO2===Cu2(OH)2CO3。 (3)将Cu和浓H2SO4混合加热。 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。 (4)将Cu粉加入到热的稀硫酸中通入空气,Cu粉溶解。 2Cu+O2+2H2SO42CuSO4+2H2O (5)Cu和稀HNO3反应的离子方程式。 3Cu+8H++2NO===3Cu2++2NO↑+4H2O。 (6)常用FeCl3溶液腐蚀铜板(用离子方程式表示)。 Cu+2Fe3+===Cu2++2Fe2+。 (7)用离子方程式表示将氨水逐滴滴入到CuSO4溶液的反应过程。 Cu2++2NH3·H2O===Cu(OH)2↓+2NH; Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。 (8)用惰性电极电解CuSO4溶液(用化学方程式表示)。 2CuSO4+2H2O2Cu+O2↑+2H2SO4。 3.知识盲点 (1)铜是紫红色金属,它在潮湿的空气中最终不是生成CuO,而是生成铜绿[Cu2(OH)2CO3]。 (2)受热分解:Cu(OH)2(蓝色)―→CuO(黑色)―→Cu2O(砖红色)―→Cu(紫红色)。 Cu(OH)2常温下缓慢分解,CuO需要在高温条件下才能分解。 (3)常用灼热的铜粉除去N2中的O2,灼热的CuO除去CO2中的CO。 (4)Cu和一定量的浓HNO3反应,产生的是NO2和NO的混合气体,当Cu有剩余,再加入稀H2SO4,Cu继续溶解。 (5)冶炼铜的方法:①热还原法;②湿法炼铜;③电解精炼铜。 (6)重金属离子可使蛋白质变性,因此,可溶性铜盐均有毒。另一方面,可溶性铜盐可作为消毒杀菌剂,如用于配制波尔多液等。 角度一 化学与STSE 1.(2018·课标全国Ⅱ,7)化学与生活密切相关。下列说法错误的是( ) A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 解析 Na2CO3溶液水解呈碱性,油污在碱性条件下能发生水解反应,A项正确;漂白粉的有效成分为Ca(ClO)2,Ca(ClO)2溶于水生成HClO,HClO具有杀菌消毒作用,故可用于生活用水的杀菌消毒,B项正确;胃酸的主要成分为盐酸,可用Al(OH)3进行中和,C项正确;BaCO3能与胃酸反应生成Ba2+,Ba2+为重金属离子,能引起蛋白质变性,D项错误。 答案 D 2.(2018·江苏化学,3)下列有关物质性质与用途具有对应关系的是( ) A.NaHCO3受热易分解,可用于制胃酸中和剂 B.SiO2熔点高硬度大,可用于制光导纤维 C.Al2O3是两性氧化物,可用作耐高温材料 D.CaO能与水反应,可用作食品干燥剂 解析 NaHCO3可用于制胃酸中和剂是因为NaHCO3可以与胃酸中的HCl反应,而不是因为其受热易分解,A项错误;SiO2用作光导纤维,不是因为其熔点高硬度大,而是因为其具有较强的传导能力,B项错误;Al2O3用作耐高温材料是因为其熔点高,C项错误;CaO可以吸水,故可作食品干燥剂,D项正确。 答案 D 角度二 物质性质及应用 3.(2019·天津理综,3)下列有关金属及其化合物的应用不合理的是( ) A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2 B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 D.无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水 解析 将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2,发生反应2FeCl2+Cl2===2FeCl3、2FeCl3+Fe===3FeCl2 ,A项正确;铝中添加适量锂,制得的铝合金密度小、硬度大,可用于航空工业,B项正确;盐碱地中施加熟石灰,发生反应Na2CO3+Ca(OH)2===CaCO3+2NaOH,生成的NaOH为强碱,不利于作物生长,C项错误;无水CoCl2吸水后会发生颜色变化,可用于判断变色硅胶是否吸水,D项正确。 答案 C 4.(2019·江苏化学,3)下列有关物质的性质与用途具有对应关系的是( ) A.NH4HCO3受热易分解,可用作化肥 B.稀硫酸具有酸性,可用于除去铁锈 C.SO2具有氧化性,可用于纸浆漂白 D.Al2O3具有两性,可用于电解冶炼铝 解析 A项,因为NH4HCO3中含有氮元素,所以其可以用作化肥,错误;B项,铁锈的主要成分为Fe2O3,加入稀硫酸可以除去Fe2O3利用了稀硫酸的酸性,正确;C项,SO2漂白纸浆利用了SO2的漂白性,不是其氧化性,错误;D项,电解Al2O3获得铝,不是因为Al2O3具有两性,错误。 答案 B 角度三 物质的转化关系及应用 5.(2018·江苏化学,9)在给定条件下,下列选项所示的物质间转化均能实现的是( ) A.NaHCO3(s)Na2CO3(s)NaOH(aq) B.Al(s)NaAlO2(aq)Al(OH)3(s) C.AgNO3(aq)[Ag(NH3)2]+(aq)Ag(s) D.Fe2O3(s)Fe(s)FeCl3(aq) 解析 2NaHCO3Na2CO3+CO2↑+H2O,Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,A项正确;2Al+2NaOH+2H2O===2NaAlO2+3H2↑,NaAlO2与过量HCl反应生成Al3+,即AlO+4H+===Al3++2H2O,B项错误;蔗糖分子中不含醛基,无还原性,不能发生银镜反应,C项错误;Fe2O3+2AlAl2O3+2Fe,而Fe与HCl反应只能生成FeCl2:Fe+2HCl===FeCl2+H2↑,D项错误。 答案 A 6.(2017·海南化学)下列叙述正确的是(双选)( ) A.稀硫酸和铜粉反应可制备硫酸铜 B.碘化钾与浓硫酸反应可制备碘化氢 C.过氧化钠与二氧化碳反应可制备氧气 D.铝箔在氯气中燃烧可制备无水三氯化铝 解析 A.根据金属活动顺序表,Cu排在H的右边,因此金属铜不与稀硫酸反应,故A错误;B.浓硫酸具有强氧化性,能把I-氧化,故B错误;C.2Na2O2+2CO2===2Na2CO3+O2,因此可以制备氧气,故C正确;D.铝在氯气中燃烧生成AlCl3,故D正确。 答案 CD 角度四 无机化工微型化设计 7.(2018·课标全国Ⅰ,7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下: 下列叙述错误的是( ) A.合理处理废旧电池有利于保护环境和资源再利用 B.从“正极片”中可回收的金属元素有Al、Fe、Li C.“沉淀”反应的金属离子为Fe3+ D.上述流程中可用硫酸钠代替碳酸钠 解析 废旧电池中含有的金属、电解质溶液会对水体和土壤等造成污染,处理废旧电池有利于资源再利用,同时能够降低环境污染,保护环境,A项正确;从流程图看出,正极材料涉及了铝、铁、锂等金属,B项正确;因流程中加入的有HNO3,故在含Li、P、Fe等元素的滤液中加碱液,发生“沉淀”反应的金属离子为Fe3+,C项正确;因为锂及其化合物的性质与镁相似,由硫酸镁易溶于水推知,硫酸锂易溶于水,由碳酸镁微溶于水推知,碳酸锂微溶于水,所以不能用硫酸钠代替碳酸钠,D项错误。 答案 D 8.(2015·浙江理综,13)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3 、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程: 下列说法不正确的是( ) A.溶解烧渣选用足量硫酸,试剂X选用铁粉 B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2 C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O 解析 根据题意,分析得出以下流程: A项,溶解烧渣选用足量硫酸,试剂X选用铁粉,正确;B项,由于SiO2不溶于硫酸,则固体1中一定含有SiO2,为了使溶液中的Al3+转化成Al(OH)3沉淀,故用NaOH溶液控制pH,得固体2为Al(OH)3,正确;C项,由于Fe2+易被氧化、FeSO4·7H2O易分解,故在从FeSO4溶液中得到FeSO4·7H2O产品过程中,须控制条件防止其氧化和分解,正确; D项,若在溶液1[Fe2(SO4)3和Al2(SO4)3溶液]中直接加NaOH至过量,得到的为Fe(OH)3,用硫酸溶解得到Fe2(SO4)3溶液,故经结晶不能得到FeSO4·7H2O,错误。 答案 D 角度五 元素化合物的综合应用——化学工艺流程框图题 9.(2019·课标全国Ⅲ,26)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题: 相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 (1)“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式___________________________________________________________ ___________________________________________________________。 (2)“氧化”中添加适量的MnO2的作用是________________________ ___________________________________________________________。 (3)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。 (4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。 (5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___________________________________________________________ ___________________________________________________________。 (6)写出“沉锰”的离子方程式_____________________________________ ___________________________________________________________。 (7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=时,z=________。 解析 (1)硫化锰矿中硅元素主要以SiO2或不溶性硅酸盐形式存在,则“滤渣1”的主要成分为S和SiO2(或不溶性硅酸盐)。结合“滤渣1”中含S,可知“溶浸”时MnO2与MnS在酸性条件下发生氧化还原反应生成MnSO4和S,根据得失电子守恒可配平该反应。(2)“溶浸”后溶液中含Fe2+,“氧化”中加入的适量MnO2 能将Fe2+氧化为Fe3+。(3)“调pH”除去Fe3+和Al3+时,结合表格中数据信息可知需控制溶液的pH在4.7~6之间。(4)“除杂1”中加入Na2S能将Zn2+和Ni2+分别转化为沉淀除去,故“滤渣3”的主要成分为NiS和ZnS。(5)“除杂2”中F-与Mg2+反应生成MgF2沉淀,若溶液酸度过高,则F-与H+结合生成弱电解质HF,导致MgF2(s)Mg2+(aq)+2F-(aq)平衡向右移动,Mg2+不能完全除去。(6)“沉锰”时Mn2+与HCO反应生成MnCO3并放出CO2,由此可写出离子方程式。(7)化合物LiNixCoyMnzO2中,当x=y=时,根据化合价代数和为0得1+2×+3×+4z-2×2=0,解得z=。 答案 (1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4===2MnSO4+S+2H2O (2)将Fe2+氧化为Fe3+ (3)4.7 (4)NiS和ZnS (5)F-与H+结合形成弱电解质HF,MgF2Mg2++2F-平衡向右移动 (6)Mn2++2HCO===MnCO3↓+CO2↑+H2O (7) 10.(2017·课标全国Ⅰ,27)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下: 回答下列问题: (1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________________ ___________________________________________________________。 (2)“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式___________________________________________________________。 (3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示: 温度/℃ 30 35 40 45 50 TiO2·xH2O转化率/% 92 95 97 93 88 分析40 ℃时TiO2·xH2O转化率最高的原因________________________ ___________________________________________________________ ___________________________________________________________。 (4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________________。 (5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?__________________________________ ___________________________________________________________ ___________________________________________________________(列式计算)。 FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24 (6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式___________________________________________________________。 解析 (1)由图示可知,当铁浸出率为70%时,可以采用100 ℃、2 h,也可采用90 ℃、5 h。(2)反应物有FeTiO3,由生成物有TiOCl可知,反应物中还含有Cl-,生成物中还有Fe2+,注意酸性条件,用H+平衡电荷,配平。(3)温度低,转化速率慢,单位时间内转化效率低,温度过高,H2O2分解,NH3挥发,导致转化速率慢。注意:取的是相同时间内的转化率。(4)由化合物中所有元素化合价代数和为0,有15个O原子共-22价,设-2价氧原子为x个,-1价氧原子则为(15-x )个,有-2x-(15-x)=-22,x=7,则-1价O原子共8个,即有4个过氧键。(6)反应物为FePO4、Li2CO3、H2C2O4,生成物有LiFePO4,铁元素的化合价降低,则H2C2O4中碳元素的化合价升高,产物为CO2,配平。 答案 (1)100 ℃、2 h或90 ℃、5 h (2)FeTiO3+ 4H++ 4Cl-===Fe2++TiOCl+2H2O (3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 (4)4 (5)Fe3+恰好沉淀完全时, c(PO)= mol·L-1=1.3×10-17mol·L-1,c3(Mg2+)·c2(PO)值为0.013×(1.3×10-17)2=1.69×10-40查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档