- 2021-05-22 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学冲刺专题复习卷除杂和结晶练习卷
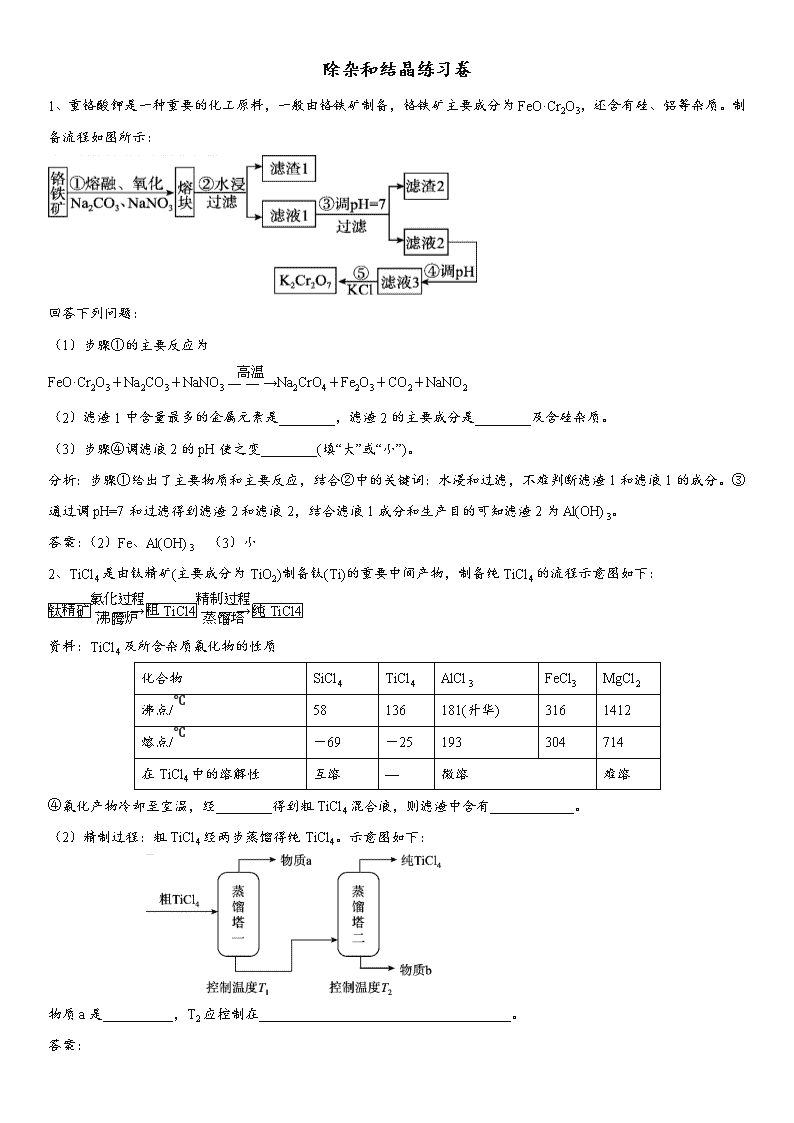
除杂和结晶练习卷 1、重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: 回答下列问题: (1)步骤①的主要反应为 FeO·Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2 (2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。 (3)步骤④调滤液2的pH使之变________(填“大”或“小”)。 分析:步骤①给出了主要物质和主要反应,结合②中的关键词:水浸和过滤,不难判断滤渣1和滤液1的成分。③通过调pH=7和过滤得到滤渣2和滤液2,结合滤液1成分和生产目的可知滤渣2为Al(OH)3。 答案:(2)Fe、Al(OH)3 (3)小 2、TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 资料:TiCl4及所含杂质氯化物的性质 化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2 沸点/℃ 58 136 181(升华) 316 1412 熔点/℃ -69 -25 193 304 714 在TiCl4中的溶解性 互溶 — 微溶 难溶 ④氯化产物冷却至室温,经________得到粗TiCl4混合液,则滤渣中含有____________。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: 物质a是__________,T2应控制在____________________________________。 答案: (1)④过滤;MgCl2、AlCl3、FeCl3 (2)SiCl4;高于136℃,低于181℃ 3、以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4•7H2O的过程如图所示: 镁泥的主要成分如下表: MgO SiO2 FeO、Fe2O3 CaO Al2O3 B2O3 30%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2% 回答下列问题: (1)“酸解”时应该加入的酸是 ,“滤渣1”中主要含有 (写化学式)。 (2)“除杂”时加入次氯酸钙、氧化镁的作用分别是 、 。 (3)判断“除杂”基本完成的检验方法是 。 答案: (1)浓硫酸;SiO2、CaSO4 (2)氧化亚铁离子;促进铁离子、铝离子转化为沉淀。 (3)溶液接近为无色。 4、LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下: 已知:HCl的沸点是-85.0℃,HF的沸点是 19.5℃。 (3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。 答案:(3)过滤;冷凝 5、草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水) 的工艺流程如下: 回答下列问题: (2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。 答案: (2)NaOH溶液;CaC2O4;H2C2O4溶液;H2SO4溶液;CaSO4 6、重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示: (4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,_____________________、_____________________、___________得到K2Cr2O7固体。冷却到________(填标号)得到的K2Cr2O7固体产品最多。 a.80℃ b.60℃ c.40℃ d.10℃ 答案: (4)蒸发浓缩,冷却结晶,过滤、d 7、某火电厂收捕到的粉煤灰的主要成分为SiO2、A12O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处 理的流程如下: 回答下列问题: (5)实验室用MgCl2溶液制备MgCl2·7H2O,在不断滴加浓盐酸或通入HCl后,需要进行的操作是______________、_________________、___________、干燥。 答案: (5)蒸发浓缩,冷却结晶,过滤 8、明矾石经过处理后得到明矾[KAl(SO4)2•12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: 焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O 请回答下列问题: (2)从水浸后的滤液中得到K2SO4晶体的方法是 。 答案: (2)蒸发结晶 银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: [Cu(OH)2在800C以上分解;Al(OH)3在3000C以上分解] (5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。 答案: (5)蒸发浓缩、冷却结晶 9、以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下: PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq), 其溶解度曲线如图所示。 ②过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:____________________。 答案: (3)②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到PbO固体。 10、柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3===FeCO3↓+Na2SO4 FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O 某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 )出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤,得到FeSO4溶液,滴加稀硫酸酸化, ,得到FeSO4·7H2O晶体。 答案: (5)加热浓缩得到 60℃饱和溶液,冷却至 0℃结晶,过滤,少量冰水洗涤,低温干燥 11、以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4•7H2O的过程如图所示: 镁泥的主要成分如下表: MgO SiO2 FeO、Fe2O3 CaO Al2O3[来源:学科网] B2O3 30%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2% MgSO4和CaSO4在不同温度下的溶解度如下表: S(g)/T(℃) 25 50 60 70 90 MgSO4 11.6 23.3 32.5 38.1 42.5 CaSO4 0.2028 0.1817 0.1632 0.1569 0.1492 回答下列问题: (4)分离滤渣3应趁热过滤的原因是 。 答案: 温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙。 13、废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下: 回答下列问题: (4)操作⑤由硫酸铜溶液制胆矾的主要步骤是 。 答案: (4)加热浓缩、冷却结晶、过滤 14、实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下: (3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。 ②为使Fe3+尽可能多的从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂, 、静置、分液,并重复多次。 (4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水, ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。 [已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。 【答案】 (3) ②充分振荡 (4)至5查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档