- 2021-05-22 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习仪器连接应用填空特训作业(全国通用)
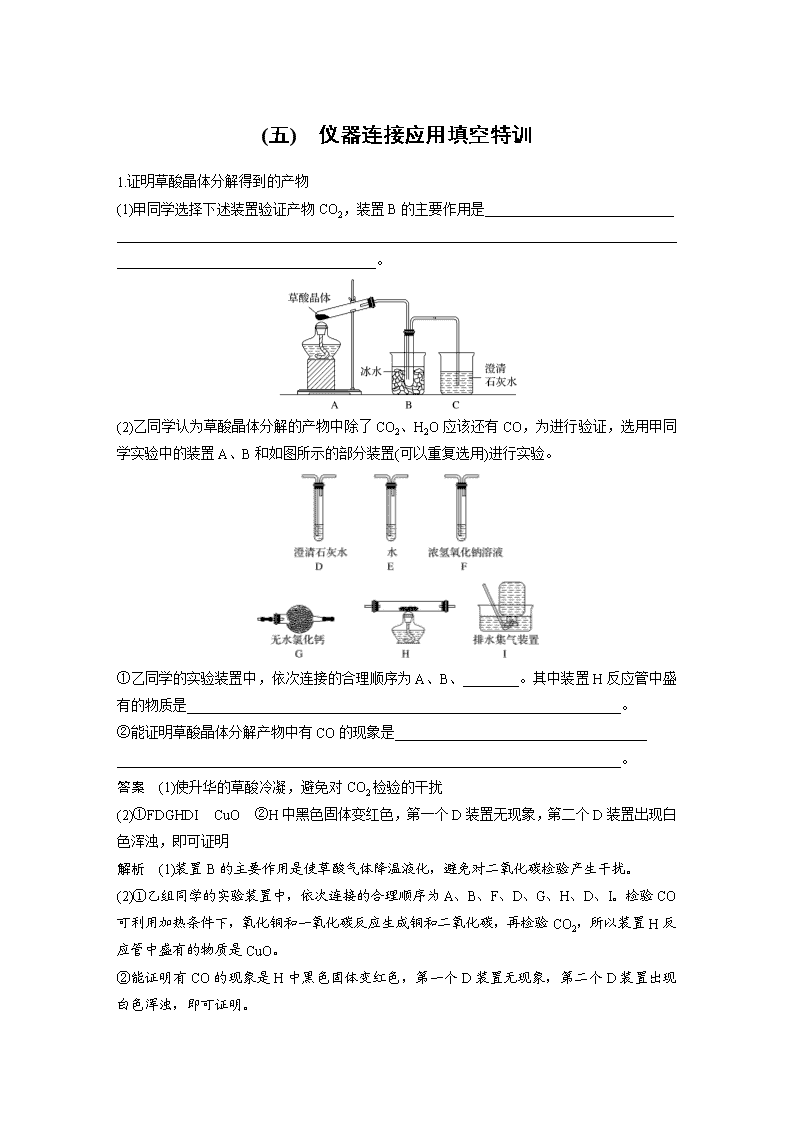
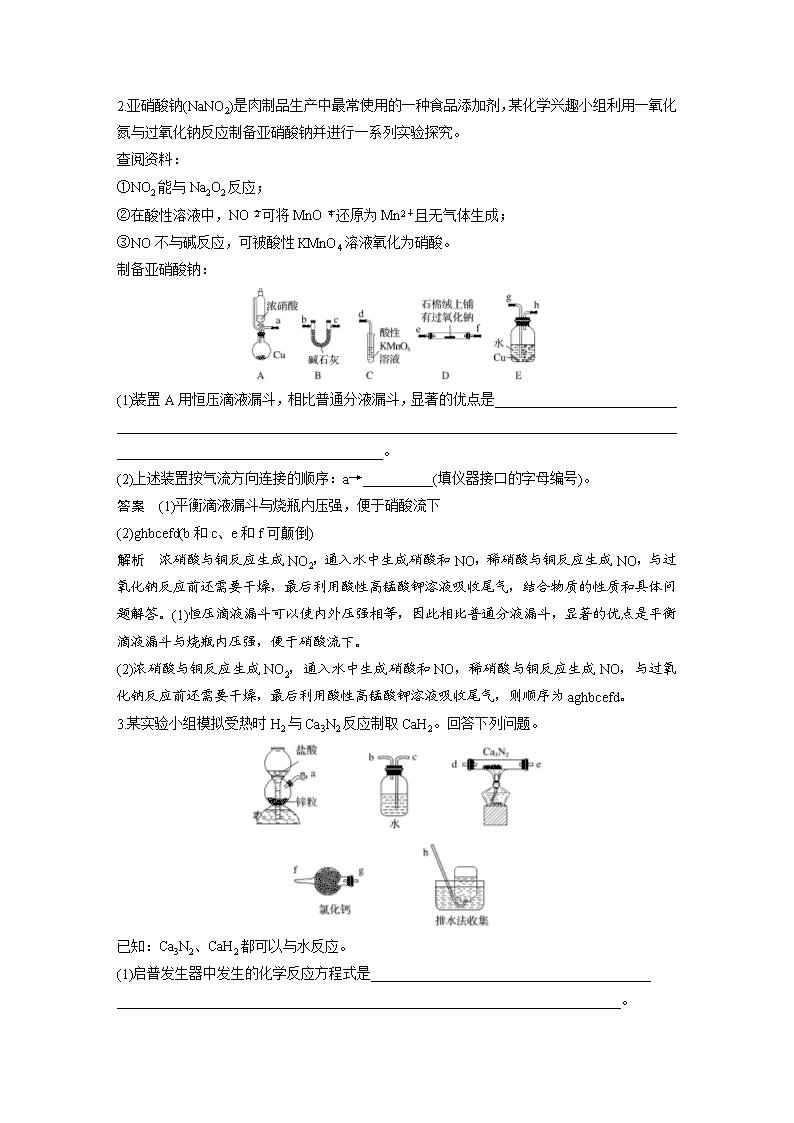
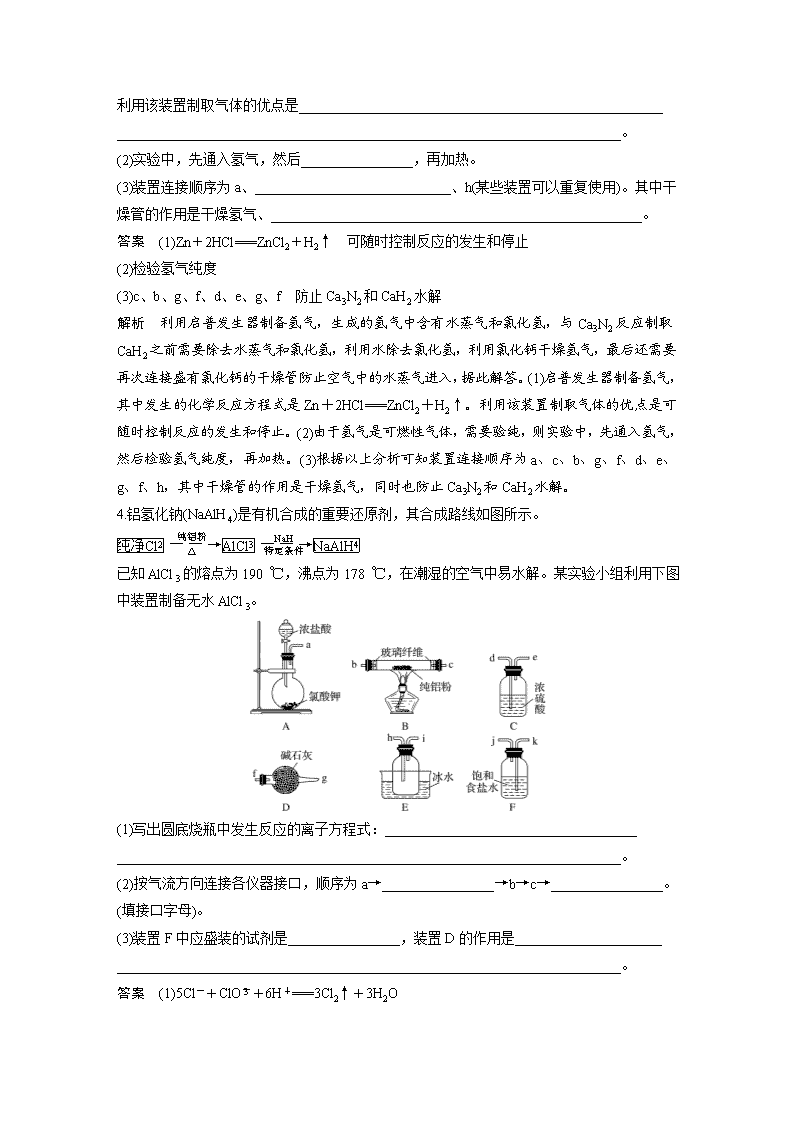
(五) 仪器连接应用填空特训 1.证明草酸晶体分解得到的产物 (1)甲同学选择下述装置验证产物CO2,装置B的主要作用是___________________________ _____________________________________________________________________________________________________________________。 (2)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。 ①乙同学的实验装置中,依次连接的合理顺序为A、B、________。其中装置H反应管中盛有的物质是______________________________________________________________。 ②能证明草酸晶体分解产物中有CO的现象是____________________________________ ________________________________________________________________________。 答案 (1)使升华的草酸冷凝,避免对CO2检验的干扰 (2)①FDGHDI CuO ②H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明 解析 (1)装置B的主要作用是使草酸气体降温液化,避免对二氧化碳检验产生干扰。 (2)①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G、H、D、I。检验CO可利用加热条件下,氧化铜和一氧化碳反应生成铜和二氧化碳,再检验CO2,所以装置H反应管中盛有的物质是CuO。 ②能证明有CO的现象是H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明。 2.亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用一氧化氮与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。 查阅资料: ①NO2能与Na2O2反应; ②在酸性溶液中,NO可将MnO还原为Mn2+且无气体生成; ③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。 制备亚硝酸钠: (1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是__________________________ ______________________________________________________________________________________________________________________。 (2)上述装置按气流方向连接的顺序:a→__________(填仪器接口的字母编号)。 答案 (1)平衡滴液漏斗与烧瓶内压强,便于硝酸流下 (2)ghbcefd(b和c、e和f可颠倒) 解析 浓硝酸与铜反应生成NO2,通入水中生成硝酸和NO,稀硝酸与铜反应生成NO,与过氧化钠反应前还需要干燥,最后利用酸性高锰酸钾溶液吸收尾气,结合物质的性质和具体问题解答。(1)恒压滴液漏斗可以使内外压强相等,因此相比普通分液漏斗,显著的优点是平衡滴液漏斗与烧瓶内压强,便于硝酸流下。 (2)浓硝酸与铜反应生成NO2,通入水中生成硝酸和NO,稀硝酸与铜反应生成NO,与过氧化钠反应前还需要干燥,最后利用酸性高锰酸钾溶液吸收尾气,则顺序为aghbcefd。 3.某实验小组模拟受热时H2与Ca3N2反应制取CaH2。回答下列问题。 已知:Ca3N2、CaH2都可以与水反应。 (1)启普发生器中发生的化学反应方程式是________________________________________ ________________________________________________________________________。 利用该装置制取气体的优点是____________________________________________________ ________________________________________________________________________。 (2)实验中,先通入氢气,然后________________,再加热。 (3)装置连接顺序为a、____________________________、h(某些装置可以重复使用)。其中干燥管的作用是干燥氢气、_____________________________________________________。 答案 (1)Zn+2HCl===ZnCl2+H2↑ 可随时控制反应的发生和停止 (2)检验氢气纯度 (3)c、b、g、f、d、e、g、f 防止Ca3N2和CaH2水解 解析 利用启普发生器制备氢气,生成的氢气中含有水蒸气和氯化氢,与Ca3N2反应制取CaH2之前需要除去水蒸气和氯化氢,利用水除去氯化氢,利用氯化钙干燥氢气,最后还需要再次连接盛有氯化钙的干燥管防止空气中的水蒸气进入,据此解答。(1)启普发生器制备氢气,其中发生的化学反应方程式是Zn+2HCl===ZnCl2+H2↑。利用该装置制取气体的优点是可随时控制反应的发生和停止。(2)由于氢气是可燃性气体,需要验纯,则实验中,先通入氢气,然后检验氢气纯度,再加热。(3)根据以上分析可知装置连接顺序为a、c、b、g、f、d、e、g、f、h,其中干燥管的作用是干燥氢气,同时也防止Ca3N2和CaH2水解。 4.铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如图所示。 已知AlCl3的熔点为190 ℃,沸点为178 ℃,在潮湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3。 (1)写出圆底烧瓶中发生反应的离子方程式:____________________________________ ________________________________________________________________________。 (2)按气流方向连接各仪器接口,顺序为a→________________→b→c→________________。(填接口字母)。 (3)装置F中应盛装的试剂是________________,装置D的作用是_____________________ ________________________________________________________________________。 答案 (1)5Cl-+ClO+6H+===3Cl2↑+3H2O (2)k→j→d→e h→i→f→g (3)饱和NaCl溶液 吸收未反应的Cl2,并防止空气中的水蒸气进入装置E中 解析 (1)氯酸钾和浓盐酸制氯气,反应的离子方程式:5Cl-+ClO+6H+===3Cl2↑+3H2O。 (2)A用于制备氯气,经F中饱和食盐水除去氯化氢,用C装置干燥,在B中反应生成氯化铝,E用于收集氯化铝,最后连接D,用碱石灰吸收氯气尾气,且吸收空气中的水蒸气,则连接顺序为a→k→j→d→e→b→c→h→i→f→g。 (3)装置F用于除去氯化氢,应盛装的试剂是饱和食盐水,装置D的作用是吸收剩余的氯气并避免空气中的水蒸气进入D中,反之氯气污染空气以及氯化铝水解。 5.工业上可用焦炭、二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是某化学小组制备干燥的氯气并在实验室制备SiCl4的部分装置示意图(注:SiCl4遇水易水解)。 (1)选择上图部分装置,制备纯净干燥的氯气,正确的仪器连接顺序为:发生装置甲→______→______→______→______→装置A(用小写字母填空)。 (2)上图C装置的作用是___________________________________________________。 (3)装置A的硬质玻璃管中二氧化硅和焦炭与氯气恰好完全反应生成SiCl4,则二氧化硅和碳的物质的量之比为________。 答案 (1)g h c d (2)防止D装置中的水蒸气进入到B的集气瓶使SiCl4水解 (3)1∶2 解析 (1)制备纯净干燥的氯气,用饱和食盐水除去多余的HCl,用浓硫酸干燥,正确的连接顺序为g→h→c→d。 (2)由信息知SiCl4遇水易水解,制备SiCl4不能接触水,因此,上图C装置的作用是防止D装置中的水蒸气进入到B的集气瓶使SiCl4水解。 (3)装置A的硬质玻璃管中二氧化硅和焦炭与氯气恰好完全反应生成SiCl4,化学方程式为 SiO2+2C+2Cl2===SiCl4+2CO,所以二氧化硅和碳的物质的量之比为1∶2。查看更多