- 2021-05-22 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届新高考选考化学一轮复习苏教版物质的制备与合成作业
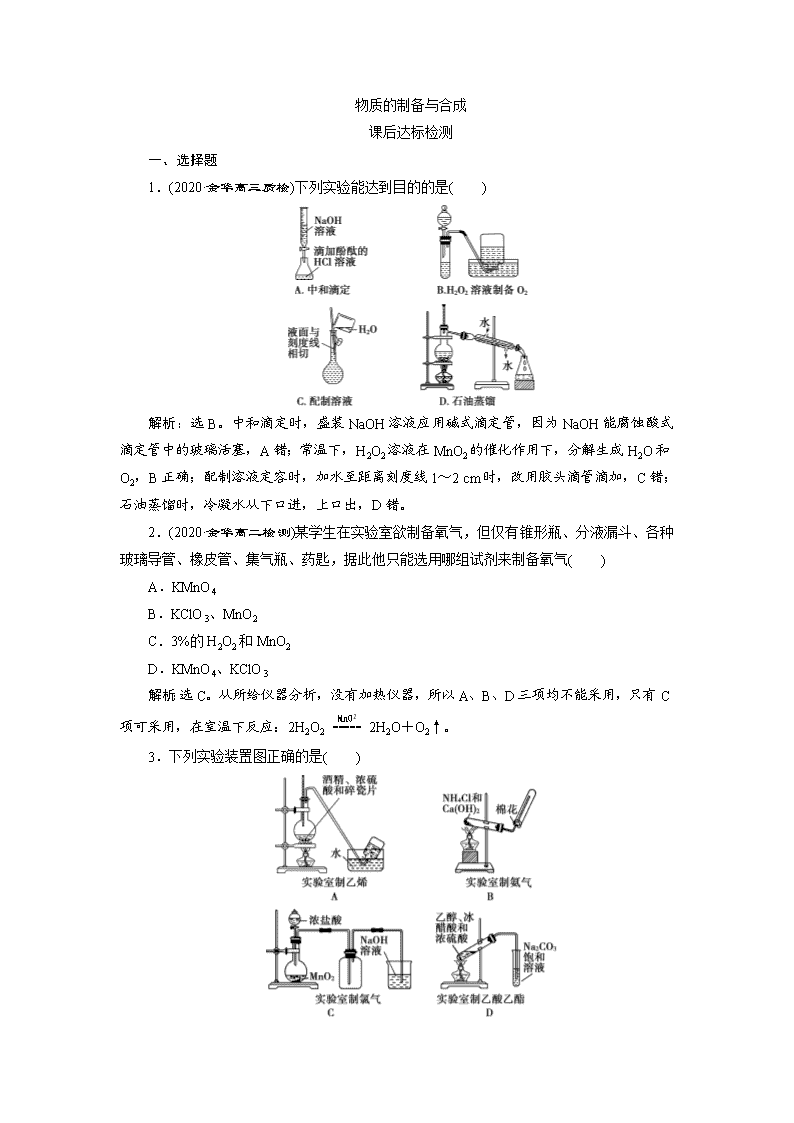
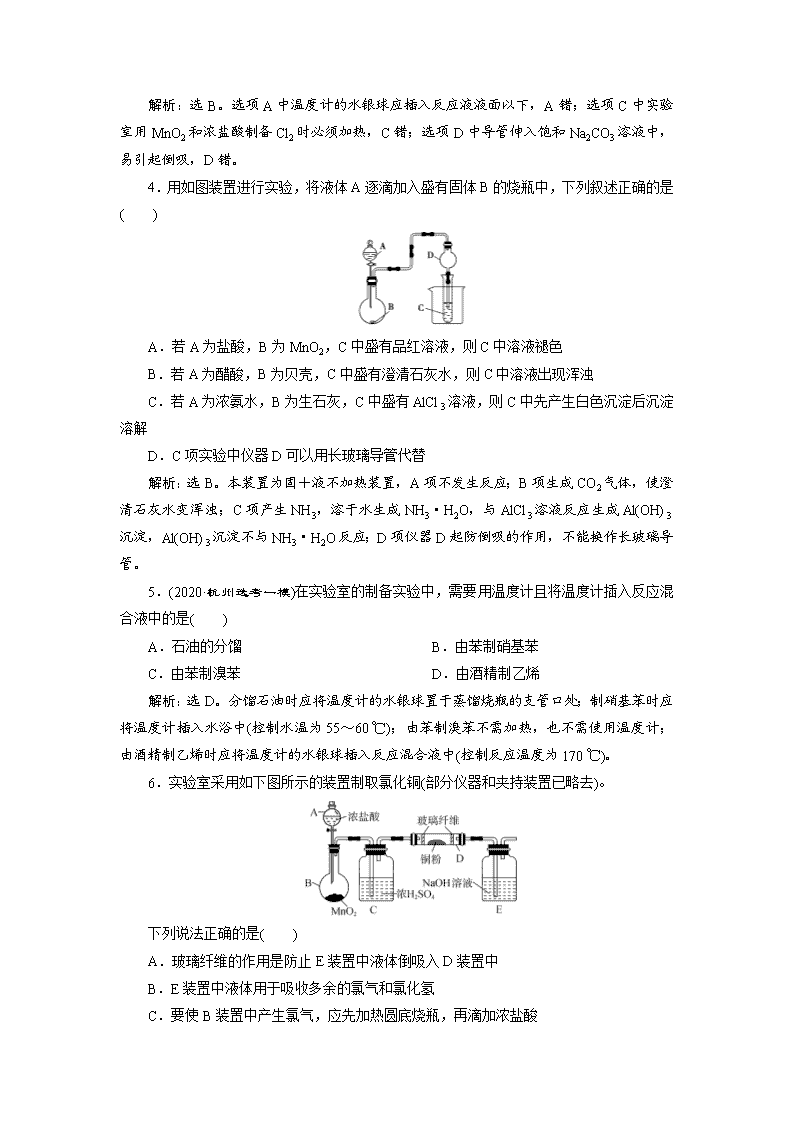
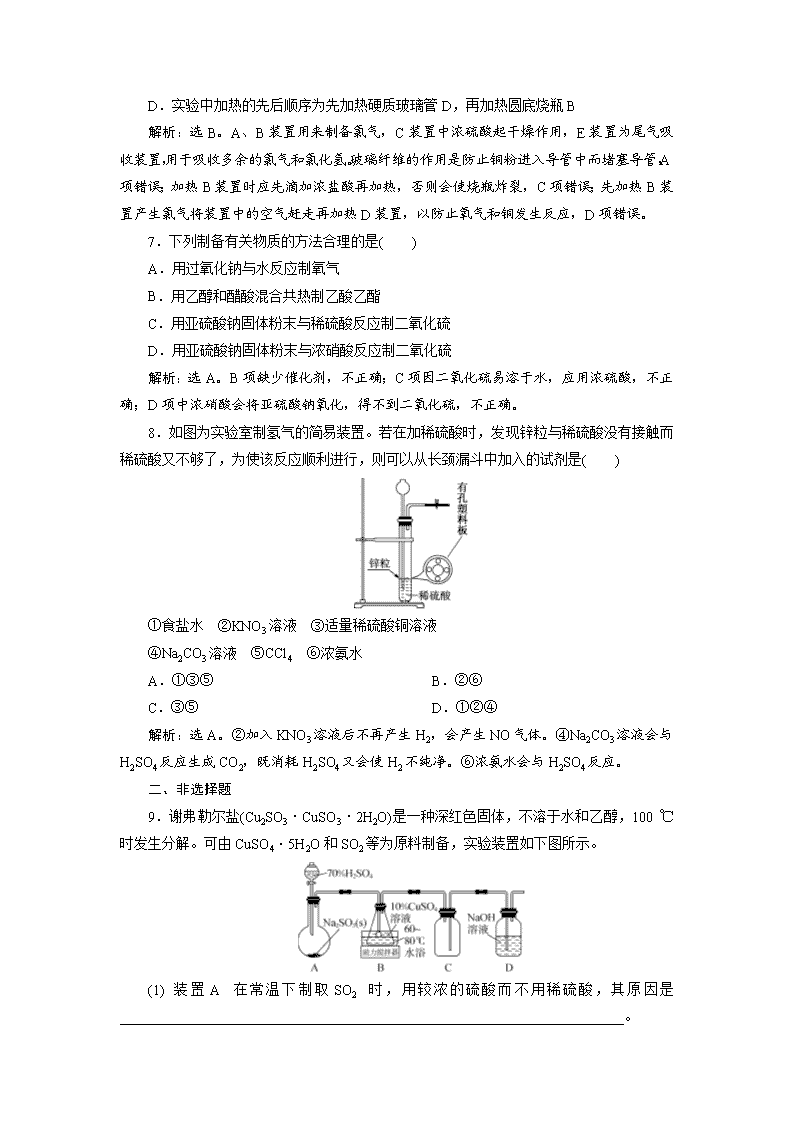
物质的制备与合成 课后达标检测 一、选择题 1.(2020·金华高三质检)下列实验能达到目的的是( ) 解析:选B。中和滴定时,盛装NaOH溶液应用碱式滴定管,因为NaOH能腐蚀酸式滴定管中的玻璃活塞,A错;常温下,H2O2溶液在MnO2的催化作用下,分解生成H2O和O2,B正确;配制溶液定容时,加水至距离刻度线1~2 cm时,改用胶头滴管滴加,C错;石油蒸馏时,冷凝水从下口进,上口出,D错。 2.(2020·金华高二检测)某学生在实验室欲制备氧气,但仅有锥形瓶、分液漏斗、各种玻璃导管、橡皮管、集气瓶、药匙,据此他只能选用哪组试剂来制备氧气( ) A.KMnO4 B.KClO3、MnO2 C.3%的H2O2和MnO2 D.KMnO4、KClO3 解析:选C。从所给仪器分析,没有加热仪器,所以A、B、D三项均不能采用,只有C项可采用,在室温下反应:2H2O22H2O+O2↑。 3.下列实验装置图正确的是( ) 解析:选B。选项A中温度计的水银球应插入反应液液面以下,A错;选项C中实验室用MnO2和浓盐酸制备Cl2时必须加热,C错;选项D中导管伸入饱和Na2CO3溶液中,易引起倒吸,D错。 4.用如图装置进行实验,将液体A逐滴加入盛有固体B的烧瓶中,下列叙述正确的是( ) A.若A为盐酸,B为MnO2,C中盛有品红溶液,则C中溶液褪色 B.若A为醋酸,B为贝壳,C中盛有澄清石灰水,则C中溶液出现浑浊 C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中先产生白色沉淀后沉淀溶解 D.C项实验中仪器D可以用长玻璃导管代替 解析:选B。本装置为固+液不加热装置,A项不发生反应;B项生成CO2气体,使澄清石灰水变浑浊;C项产生NH3,溶于水生成NH3·H2O,与AlCl3溶液反应生成Al(OH)3沉淀,Al(OH)3沉淀不与NH3·H2O反应;D项仪器D起防倒吸的作用,不能换作长玻璃导管。 5.(2020·杭州选考一模)在实验室的制备实验中,需要用温度计且将温度计插入反应混合液中的是( ) A.石油的分馏 B.由苯制硝基苯 C.由苯制溴苯 D.由酒精制乙烯 解析:选D。分馏石油时应将温度计的水银球置于蒸馏烧瓶的支管口处;制硝基苯时应将温度计插入水浴中(控制水温为55~60 ℃);由苯制溴苯不需加热,也不需使用温度计;由酒精制乙烯时应将温度计的水银球插入反应混合液中(控制反应温度为170 ℃)。 6.实验室采用如下图所示的装置制取氯化铜(部分仪器和夹持装置已略去)。 下列说法正确的是( ) A.玻璃纤维的作用是防止E装置中液体倒吸入D装置中 B.E装置中液体用于吸收多余的氯气和氯化氢 C.要使B装置中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸 D.实验中加热的先后顺序为先加热硬质玻璃管D,再加热圆底烧瓶B 解析:选B。A、B装置用来制备氯气,C装置中浓硫酸起干燥作用,E装置为尾气吸收装置,用于吸收多余的氯气和氯化氢。玻璃纤维的作用是防止铜粉进入导管中而堵塞导管,A项错误;加热B装置时应先滴加浓盐酸再加热,否则会使烧瓶炸裂,C项错误;先加热B装置产生氯气将装置中的空气赶走再加热D装置,以防止氧气和铜发生反应,D项错误。 7.下列制备有关物质的方法合理的是( ) A.用过氧化钠与水反应制氧气 B.用乙醇和醋酸混合共热制乙酸乙酯 C.用亚硫酸钠固体粉末与稀硫酸反应制二氧化硫 D.用亚硫酸钠固体粉末与浓硝酸反应制二氧化硫 解析:选A。B项缺少催化剂,不正确;C项因二氧化硫易溶于水,应用浓硫酸,不正确;D项中浓硝酸会将亚硫酸钠氧化,得不到二氧化硫,不正确。 8.如图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( ) ①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水 A.①③⑤ B.②⑥ C.③⑤ D.①②④ 解析:选A。②加入KNO3溶液后不再产生H2,会产生NO气体。④Na2CO3溶液会与H2SO4反应生成CO2,既消耗H2SO4又会使H2不纯净。⑥浓氨水会与H2SO4反应。 二、非选择题 9.谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100 ℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示。 (1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是________________________________________________________________________。 (2)装置C的作用是____________________________________________。 (3)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。 ①检验洗涤已完全的方法是____________________________________________。 ②不用烘干的方式得到产品,其原因是_________________________________。 解析:(1)二氧化硫易溶于水,用稀硫酸会导致生成的二氧化硫大量溶解,对制备不利。(2)装置C中导管短进长出,再结合二氧化硫易溶于水的性质,可知其作用为防止倒吸。(3)①检验洗涤完全就是要检验洗涤液中不再有硫酸根离子,所以正确方法是取少量最后一次洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净;②由题中信息可知,谢弗勒尔盐100 ℃时发生分解,所以不用烘干的方式得到产品的原因是防止其发生分解。 答案:(1)二氧化硫易溶于水 (2)防止倒吸 (3)①取少量最后一次洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净 ②防止谢弗勒尔盐发生分解 10.(2016·浙江10月选考,T31)某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下: 已知:Cu(NO3)2·3H2OCu(NO3)2·Cu(OH)2CuO;SOCl2熔点-105 ℃、沸点76 ℃,遇水剧烈水解生成两种酸性气体。 请回答: (1)第②步调pH适合的物质是________(填化学式)。 (2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是________________________________________________________________________ ________________________________________________________________________。 为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是______________ (填一种)。 (3)第④步中发生反应的化学方程式是________________________。 (4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图1)有一处不合理,请提出改进方案并说明理由:______________________________。 装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞________(填“a”“b”或“a和b”)。 (5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。 已知:4NH3·H2O+Cu2+===Cu(NH3)+4H2O;Cu(NH3)对特定波长光的吸收程度(用吸光度A表示)与Cu2+在一定浓度范围内成正比。现测得Cu(NH3)的吸光度A与Cu2+标准溶液浓度关系如图2所示。 准确称取0.315 0 g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00 mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是________(以质量分数表示)。 解析:由题意知将Cu屑(含Fe)溶解在足量HNO3中,得到Cu(NO3)2和Fe(NO3)3溶液,加Cu(OH)2或Cu2(OH)2CO3调pH,将Fe3+转化为Fe(OH)3沉淀,过滤得到Cu(NO3)2溶液,将Cu(NO3)2溶液蒸发浓缩、冷却结晶得到Cu(NO3)2·3H2O晶体,可通过减慢冷却结晶的速度得到较大颗粒的晶体。SOCl2遇水剧烈水解生成两种酸性气体,应在A、B之间增加干燥装置,防止B中水蒸气进入反应器A,装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞b,使SOCl2滴入反应器A参加反应。由图2可知:A=400c(Cu2+),当A=0.620时,c(Cu2+)= mol·L-1=1.55×10-3 mol·L-1,则称取的无水Cu(NO3)2中所含n[Cu(NO3)2]=1.55×10-3 mol,m[Cu(NO3)2]=1.55×10-3 mol×188 g·mol-1=0.291 4 g,故无水Cu(NO3)2产品的纯度为×100%=92.5%。 答案:(1)Cu(OH)2[或Cu2(OH)2CO3] (2)将溶液转移至蒸发皿中,控制温度加热至溶液表面形成一层晶膜 减慢冷却结晶的速度 (3)Cu(NO3)2·3H2O+3SOCl2===Cu(NO3)2+3SO2↑+6HCl↑ (4)在A、B之间增加干燥装置,防止B中水蒸气进入反应器A b (5)92.5% 11.(2020·浙江十校联盟选考模拟)用Skraup 法合成8羟基喹啉的原理和流程如下: 已知水蒸气蒸馏原理: 在难溶或不溶于水的有机物中通入水蒸气,使难溶或不溶于水的有机物和水一起蒸出。 物质 熔点/℃ 沸点/℃ 溶解性 某些化 学性质 邻氨 基苯酚 177 153 可溶于水;能溶于强酸、强碱;易溶于乙醇 两性 邻硝基 苯酚 45 216 微溶于水,能随水蒸气挥发;易溶于乙醇 — 甘油 20 290.9 与水、乙醇混溶;能吸潮 — 8羟基 喹啉 76 257 难溶于水;能溶于强酸、强碱;易溶于乙醇 两性 主要实验装置如下: (1)图1中仪器a的名称为________;图2中仪器b的作用是________。 (2)甘油中水量大于5%会影响产量,需要新配。下列说法合理的是________。 A.将普通甘油置于蒸发皿加热至180 ℃去水后,立即放入干燥器中(图3)d处备用 B.为了增强干燥器的干燥效果,可在磨口边缘涂极薄的一层凡士林 C.当干燥器内变色硅胶(干燥剂,含有CoCl2)颜色为浅粉红色时,需要更换干燥剂 D.取用甘油时,手握干燥器盖顶圆球向上拉,取下盖子正着放置,取用甘油 (3)第一次水蒸气蒸馏主要除去的杂质是________。 (4)剩余液调节pH=7的作用是________________________________。 (5)第二次馏出物经过一系列操作可以获得高纯度的产品,下列说法正确的是________。 A.第二次水蒸气蒸馏的馏出物经过抽滤、洗涤、干燥可以获得粗产品 B.粗产品加入4∶1的乙醇水溶液溶解后,慢慢滴加水,可得到颗粒较细的晶体 C.将重结晶过滤后的母液收集起来进行适当处理,可提高产率 D.可以用测产品熔点判断产物的纯度 解析:(1)根据图示,仪器a的名称是冷凝管;图2中仪器b是安全管,烧瓶内压强增大时,管内液面上升,因此其作用是防止内压过大。(2)A.干燥器(图3)中d处放置干燥剂,故A错误;B.凡士林起到密封的作用,故B正确;C.变色硅胶的颜色为浅粉红色时失去干燥作用,需要更换干燥剂,故C正确;D.干燥器在开启时,左手按住器体,右手握住盖顶“玻球”,沿器体上沿轻推或拉动。切勿用力上提,盖子取下后要仰放桌面上,故D错误。(3)在难溶或不溶于水的有机物中通入水蒸气,使难溶或不溶于水的有机物和水一起蒸出,邻硝基苯酚微溶于水,所以第一次水蒸气蒸馏主要除去的杂质是邻硝基苯酚。(4)调节pH=7,可以将邻氨基苯酚和8羟基喹啉的硫酸盐转化为邻氨基苯酚和8羟基喹啉,使产物8羟基喹啉容易蒸出。(5)A.第二次水蒸气蒸馏的馏出物是8羟基喹啉,难溶于水,所 以经过抽滤、洗涤、干燥可以获得粗产品,故A正确;B.粗产品加入乙醇溶解后,慢慢滴加水,可得到颗粒较细的晶体,故B错误;C.过滤后的母液中含有少量产品,所以将重结晶过滤后的母液收集起来进行适当处理,可提高产率,故C正确;D.晶体一旦混入杂质,熔点就会下降,所以可通过测定熔点判断产品的纯度,故D正确。 答案:(1)冷凝管 防止内压过大 (2)BC (3)邻硝基苯酚 (4)将邻氨基苯酚和8羟基喹啉的硫酸盐转化为邻氨基苯酚和8羟基喹啉,使产物容易蒸出 (5)ACD查看更多