- 2021-05-21 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习专题一物质的组成、分类及变化 化学用语课件备考备查清单学案
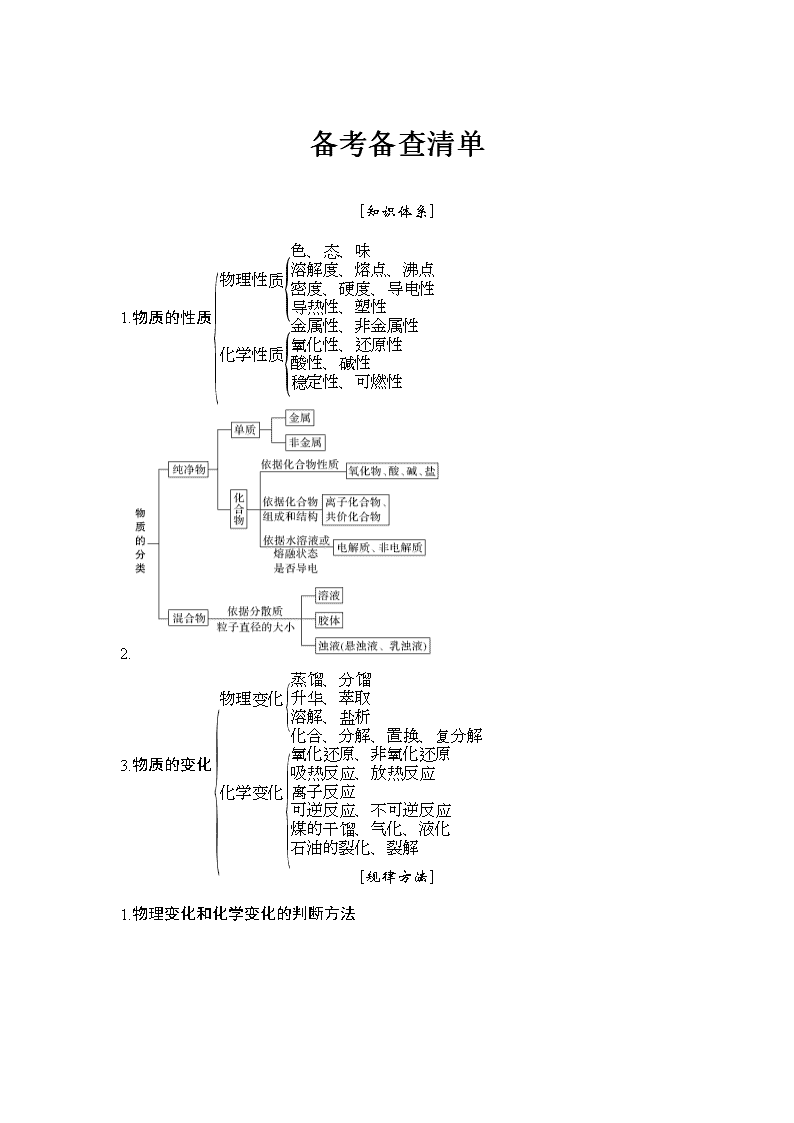
备考备查清单 [知识体系] 1.物质的性质 2. 3.物质的变化 [规律方法] 1.物理变化和化学变化的判断方法 2.三个角度认识化学变化、物理变化 (1)从宏观角度看,有新物质生成的变化是化学变化,反之则为物理变化。这里的新物质生成所能实现的仅是原子之间的重新组合,在整个过程中原子核没有发生改变。一种原子变为另一种原子涉及原子核的变化,不属于化学变化。化学变化过程中一定伴有物理变化,但物理变化过程中没有化学变化。 (2)从微观角度看,化学变化过程中有旧化学键的断裂,同时又有新化学键的形成,但有化学键断裂的变化未必就是化学变化,如NaCl晶体熔化、SiO2晶体的熔化,分别破坏了离子键、共价键,但属于物理变化。 (3)从能量角度看,化学变化中一定伴随能量变化,而有能量变化的过程却不一定是化学变化。 3.常见的物理变化、化学变化 升华、萃取、分液、蒸馏、吸附褪色、盐析、金属导电、焰色反应、电离等属于物理变化,脱水、蛋白质变性、水解、同素异形体互变、电解、熔融盐导电、电解质溶液导电、干馏等都属于化学变化。同位素之间的转化既不是物理变化也不是化学变化,是核反应。 4.判断氧化物种类时的注意要点 (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。 (4)酸酐不一定都是酸性氧化物(如乙酸酐)。 (5)碱不一定都有对应的碱性氧化物(如NH3·H2O无对应的碱性氧化物)。 5.明确物质反应的特点,理清化学反应的分类 6.分散系中的“两个大小”和“两个只有” (1)关于分散系的“两个大小”比较。 ①分散质粒子的大小:溶液<胶体<浊液; ②分散系稳定性大小:溶液>胶体>浊液。 (2)关于分散质的“两个只有”。 ①只有浊液分散质粒子不能透过滤纸,溶液和胶体分散质粒子能透过; ②只有溶液分散质粒子能透过半透膜,浊液和胶体分散质粒子不能透过。 7.“三步”判断化学用语的正误 8.化学用语使用“五”注意 (1)电子式:离子(或根)带电荷,基团不显电性。如OH-为,—OH为。 (2)书写化合物的电子式时首先要正确判断是离子化合物还是共价化合物。 (3)结构简式需保留官能团,如CH2===CH2,不能写成CH2CH2,还要注意有机物中原子的连接情况,如不能写成。 (4)各“式”均勿张冠李戴:名称还是化学式,分子式还是实验式,结构式还是结构简式,原子还是离子结构示意图,化学方程式还是离子方程式等。 (5)化学方程式或离子方程式要遵守质量守恒,化学计量数要最简,注明反应条件并注意“↑”、“↓”、“”、“===”、“―→”等符号的使用。 一、选择题 1.(2018·金华一中期末模拟)金华市金东区环保部门为了使农村生活垃圾得到合理利用,在全国率先实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于( ) A.无机物 B.有机物 C.盐类 D.非金属单质 解析 塑料袋、废纸、旧橡胶制品属于人工合成的高分子化合物是有机物。 答案 B 2.(2018·4月湖州三县联考)下列物质分类正确的是( ) A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、石灰乳、氯化铁溶液均为胶体 C.烧碱、醋酸溶液、碳酸钙为电解质 D.医用酒精、氯水、盐酸均为混合物 解析 A项CO不是酸性氧化物,B项石灰乳是悬浊液、氯化铁溶液不是胶体,C项醋酸溶液是混合物,不是电解质,D正确。 答案 D 3.(2017·嘉兴高一联考)表中的物质分类,正确的是( ) 强电解质 弱电解质 非电解质 A 钠 碳酸 氨气 B 氯化钠 水 Cu C 硫酸钡 氢氧化钙 硅酸 D 烧碱 次氯酸 CO2 解析 A.钠为单质既不是电解质也不是非电解质,故A错误;B.Cu为单质既不是电解质也不是非电解质,故B错误;C.氢氧化钙在水溶液中或熔融状态下能完全电离,则为强电解质,故C错误;D.烧碱在水溶液中或熔融状态下能完全电离为强电解质,次氯酸为弱酸,在水溶液中只能部分电离为弱电解质,CO2本身不能电离出离子,属于非电解质,故D正确。 答案 D 4.(2017·浙江名校协作)下列表示正确的是( ) A.HClO的结构式:H—O—Cl B.x=11,右图表示钠原子的结构示意图 C.CCl4的电子式: D.乙炔的最简式:C2H2 解析 A项次氯酸结构式氧原子居中,正确;B项表示钠离子的示意图,错误;C项四氯化碳电子式中氯原子的其他电子不能省略;D项乙炔的最简式为CH。 答案 A 5.(2018·嘉兴市高一上期末)下列物质,不能通过一步化合反应实现的是( ) A.Cu(OH)2 B.FeCl2 C.Fe3O4 D.SiCl4 解析 B项FeCl2可以通过FeCl3溶液与Fe反应得到,C项Fe3O4可以通过Fe在氧气中燃烧得到,D项SiCl4可以通过Si与氯气高温反应得到。A项不能一步合成。 答案 A 6.(2017·温州乐清芙蓉中学)下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( ) A.NH3 B.CH4 C.NaHCO3 D.HClO 解析 A.氨气不是酸,故A错误;B.甲烷含有氢元素,属于烃类,不能电离,故B错误;C.碳酸氢钠含有氢元素,属于盐类,电离时生成的阳离子为氢离子和钠离子,属于酸式盐,故C错误;D.次氯酸电离时生成的阳离子全部是氢离子,属于酸,故D正确。 答案 D 7.(2017·浙江省衢州二中学考模拟)以下表示的是碳及其化合物的相互转化关系:CCO2H2CO3CaCO3CO2,其中涉及的基本反应类型依次为( ) A.置换、化合、分解、复分解 B.置换、化合、复分解、分解 C.化合、置换、分解、复分解 D.化合、置换、复分解、分解 解析 这一系列的反应为:碳和氧化铜发生置换反应生成二氧化碳,二氧化碳和水发生化合反应生成碳酸,碳酸和氢氧化钙发生复分解反应生成碳酸钙,碳酸钙高温分解生成二氧化碳,反应方程式分别为:C+2CuO2Cu+CO2↑,该反应为置换反应;CO2+H2OH2CO3,该反应为化合反应;H2CO3+Ca(OH)2===CaCO3↓+2H2O,该反应为复分解反应;CaCO3CaO+CO2↑,该反应为分解反应,故选B。 答案 B 8.(2017·金华十校)下列化学用语正确的是( ) A.乙烯的结构简式:C2H4 B.NaH中氢离子的结构示意图: C.NH4I的电子式: D.H2O、CO2的比例模型都可以用表示 解析 乙烯的结构简式缺了碳碳双键的表示,错误;氢化钠中氢是带负电的阴离子,正确;碘化铵中碘离子应该带中括号,错误;二氧化碳为直线型分子,比例模型表示不合理。 答案 B 9.(2018·温州市十五校联合体期末)下列说法正确的是( ) A.分散系一定是混合物 B.凡是能电离出 OH-的化合物都是碱 C.只由一种元素组成的物质一定是单质 D.石蜡、玻璃等物质属于晶态物质 解析 A项,分散系一定是混合物,正确;某些碱式盐也能电离出 OH-,B项,错误;只由一种元素组成的物质可能是两种同素异形体,C项错误;石蜡、玻璃等物质没有固定熔沸点,是非晶体。 答案 A 10.(2018·浙江诸暨中学)材料与化学密切相关,表中对应关系错误的是( ) 选项 材料 主要化学成分 A 刚玉、金刚石 三氧化二铝 B 大理石、石灰石 碳酸钙 C 普通水泥、普通玻璃 硅酸盐 D 沙子、石英 二氧化硅 解析 A项,金刚石是碳单质;B项,大理石、石灰石均为碳酸钙;C项,水泥和普通玻璃成分均为硅酸盐材料;沙子和石英的主要成分均为二氧化硅,因此答案为A。 答案 A 11.(2018·舟山中学)下列各组物质既不属于同位素,也不属于同素异形体的是( ) A.16O和18O B.H2O和H2O2 C.O2和O3 D.金刚石、石墨和富勒烯(C60) 解析 A.16O和18O质子数相同,中子数不同,故互为同位素,故A错误;B.水和双氧水是由氧元素和氢元素形成的不同化合物,既不属于同位素,也不属于同素异形体,故B正确;C.O2和O3都是由氧元素形成的不同单质,故互为同素异形体,故C错误;D.金刚石、石墨和富勒烯(C60 )都是由碳元素形成的不同单质,故互为同素异形体,故D错误;故选B。 答案 B 12.(2018·浙江余姚中学)最近韩国首尔大学科学家将水置于一个足够强的电场中,在 20 ℃时,水分子瞬时凝固形成了“暖冰”。下列说法正确的是( ) A.“暖冰”中水分子上的 3 个原子位于同一条直线上 B.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” C.水凝固形成 20℃时的“暖冰”所发生的变化是化学变化 D.水是一种非常稳定的化合物,这是由于氢键所致 解析 水分子中氧原子含有2个σ键和2个孤对电子,所以水分子是V型结构,故A错误;在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”,否则20 ℃时,水分子不能瞬间凝固形成冰,故B正确;水凝固形成20 ℃时的“暖冰”没有新物质生成,所以所发生的变化不是化学变化,故C错误;水分子的稳定性与化学键有关系,与氢键无关,氢键不是化学键,一般影响物质的物理性质,故D错误。 答案 B 二、填空题 13.(2018·浙江温州中学)有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。 ①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2; ②每2 mol X2可与1 mol Y2化合生成2 mol X2Y,X2Y在常温下为液体; ③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色; ④Z单质溶于化合物X2Y,所得溶液具有漂白作用; 请回答: (1)画出Z原子的原子结构示意图 ;实验室中的W应保存在 中(填试剂名称)。 (2)写出化学式W2Y2 。 (3)写出与W+ 具有相同核外电子数的分子或原子,请写出任意2种的化学式 。 (4)Z单质与水反应的离子方程式:__________________________ ___________________________________________________________。 (5)W单质与X2Y化学反应方程式:____________________________ ___________________________________________________________。 解析 根据现象推断出X单质是氢气,Z单质是氯气,W单质和Y单质是金属钠和氧气。 答案 (1) 煤油 (2)Na2O2 (3)CH4 HF NH3 H2O Ne (任选2个) (4)Cl2+H2OH++Cl-+HClO (5)2Na+2H2O===2NaOH+H2↑ 14.(加试题)(2017·镇海中学高一期中)(1)下列说法不正确的是 (填字母)。 A.铝的氧化物属于碱性氧化物 B.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 C.英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 D.液氨、液氯、液态氯化氢都是非电解质 E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应 F.化学变化前后原子的种类、数目不变,分子数目也不变 (2)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深,由低级到高级的认识过程。 ①1887年阿仑尼乌斯提出电离理论。 ②1923年丹麦化学家布朗斯特和英国化学家劳莱提出了质子论:凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子的水溶液既可看作酸又可看作碱的是 。 A.H2O B.NH C.OH- D.HCO E.CH3COO- F.Cl- 解析 (1)A项Al2O3属于两性氧化物;B项中热的纯碱溶液水解程度大,碱性强,其溶解油脂的能力强,是化学变化;D项中液态氯既不是电解质,也不是非电解质,液态氯化氢是电解质,其水溶液能导电,错误;F项化学变化前后虽然原子种类和原子个数不变,但其分子数可能改变,错误,故选A、D、F。 (2)②H2O结合H+变为H3O+,又可给出H+变为OH-;NH能给出质子但不能结合H+;OH-、CH3COO-、Cl-只能结合H+,可看成碱;D项中HCO可结合H+变为H2CO3,又能给出H+变为CO,故可视为酸又可视为碱。 答案 (1)ADF (2)②AD 15.(加试题)(2018·舟山中学)按要求完成下列式子: (1)S2-离子结构示意图 ,CO2的电子式 ,NH3的结构式 。 (2)写出磁铁矿的化学式 。 (3)写出一水合氨(NH3·H2O)在水中的电离方程式___________________________________________________________ ___________________________________________________________。 (4)写出实验室制取氯气的离子方程式___________________________________________________________ ___________________________________________________________。 解析 (1)硫离子的质子数为16,有3个电子层,最外层容纳8个电子,离子结构示意图为:,CO2的电子式为,NH3的结构式为; (2)磁铁矿的主要成分是四氧化三铁,化学式为Fe3O4; (3)一水合氨是弱电解质,在水溶液中部分电离生成铵根离子和氢氧根离子,电离方程式为:NH3·H2ONH+OH-; (4)实验室制取氯气的反应是二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的离子方程式为:MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O。 答案 (1) (2)Fe3O4 (3)NH3·H2ONH+OH- (4)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 16.(2017·台州高一上期末)将一块金属钠露置于空气中,观察到下列现象: 金属钠(银白色)变灰暗变白色表面潮湿形成白色晶体形成白色粉末 请回答下列问题: (1)白色粉末的化学式是 ,过程②的化学方程式是___________________________________________________________。 (2)下列说法正确的是 。 A.过程③为物理变化 B.过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠 C.过程⑤发生了分解反应 D.整个变化过程中只有一个氧化还原反应 解析 (1)小块金属钠露置于空气中发生的变化中,银白色变灰暗变白色表面潮湿出现液滴白色固体形成白色粉末,可能发生的反应为①是钠被氧化为氧化钠;②是氧化钠和水反应生成氢氧化钠;③是氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠固体,碳酸钠和水生成碳酸钠晶体,⑤是碳酸钠晶体变成碳酸钠粉末;(2)A.无新物质生成的变化为物理变化;B.④ 是二氧化碳和氢氧化钠反应生成碳酸钠晶体;C.⑤是碳酸钠晶体变成碳酸钠粉末;D.整个变化过程中只有钠被氧化为氧化钠,为氧化还原反应。 答案 (1)Na2CO3 Na2O+H2O===2NaOH (2)ACD查看更多