- 2021-05-21 发布 |
- 37.5 KB |
- 20页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国1卷2020届高三年级化学高考模拟冲刺训练三 Word版含解析
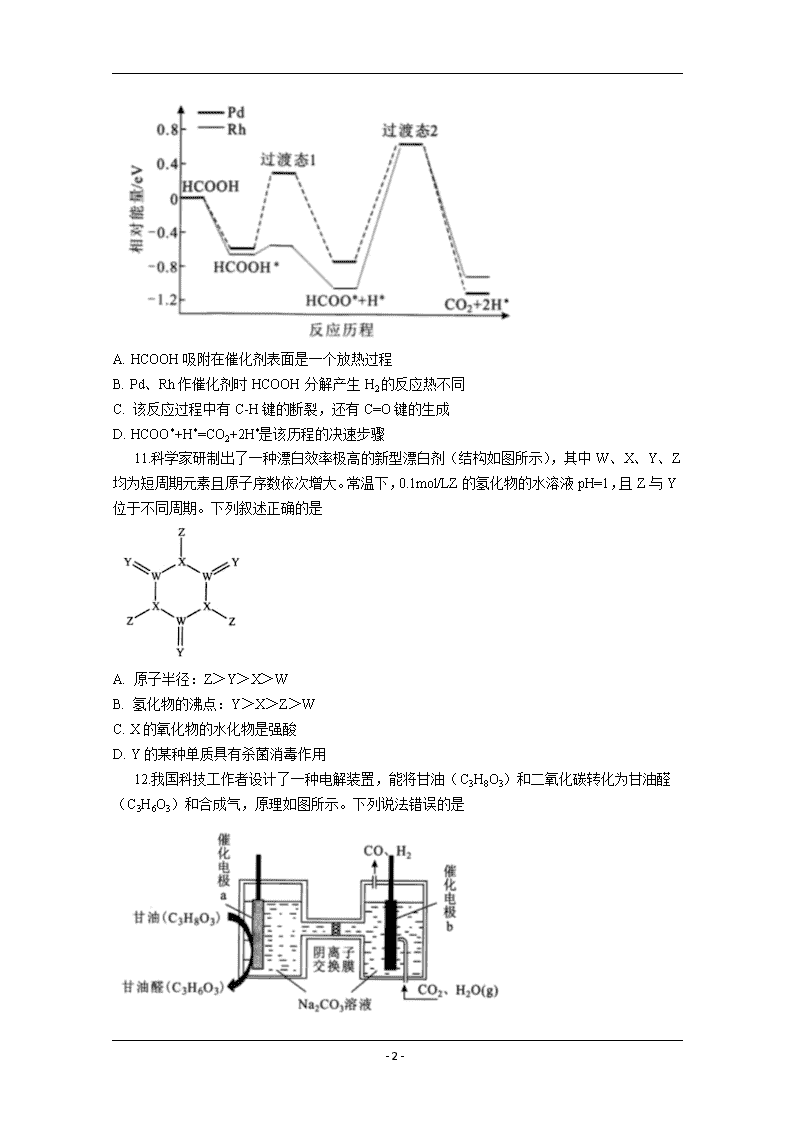
2020年高三年级化学高考模拟冲刺训练三 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Ni-59 一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生产、生活密切相关。下列说法错误的是 A. 燃煤中加入生石灰可减少温室气体的排放 B. 用纯碱溶液除油污,加热可提高去污能力 C. 我国北斗导航系统所用的芯片中含高纯硅 D. 医用护目镜片的主要成分属于有机高分子材料 8.“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是 A. 分子式C9H8O4 B. 分子中所有原子可能处于同一平面 C. 1mol该分子最多可与5molH2发生加成反应 D. 能与NaHCO3溶液反应放出CO2 9.探究FeSO4的热分解产物的实验装置如图所示,乙和丙中盛有检验相应物质的常用试剂,实验完成后甲中残留固体为红棕色。下列有关实验操作或现象的叙述正确的是 A. 实验过程中持续通氮气的目的是排除装置内空气 B. 用盐酸和K3[Fe(CN)6]溶液检验残留固体的主要成分 C. 乙装置中生成白色沉淀、丙装置中溶液褪色 D. 丁装置中所盛装的试剂可用澄清石灰水替代 10.我国科技工作者运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法错误的是 - 20 - A. HCOOH吸附在催化剂表面是一个放热过程 B. Pd、Rh作催化剂时HCOOH分解产生H2的反应热不同 C. 该反应过程中有C-H键的断裂,还有C=O键的生成 D. HCOO*+H*=CO2+2H*是该历程的决速步骤 11.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是 A. 原子半径:Z>Y>X>W B. 氢化物的沸点:Y>X>Z>W C. X的氧化物的水化物是强酸 D. Y的某种单质具有杀菌消毒作用 12.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,原理如图所示。下列说法错误的是 - 20 - A. 催化电极b与电源负极相连 B. 电解时催化电极a附近的pH增大 C. 电解时阴离子透过交换膜向a极迁移 D. 生成的甘油醛与合成气的物质的量相等 13.在25 ℃时,向20.00 mL 0.10 mol/L一元弱碱MOH溶液中滴0.10 mol/L HCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是 A. a+b=14 B. Q点消耗盐酸的体积小于20.00mL C. M点和N点溶液中,相等 D. 当V(HCl)=10.00 mL时,c(M+)-c(MOH)=c(OH-)-c(H+) 三、非选择题: 26.二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图: 回答下列问题: (1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。 (2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。 (3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。 (4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。 - 20 - (5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。 (6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。 27.苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图: 实验步骤:如图所示,在装有电动搅拌器的250 mL三颈烧瓶里加入9.0 g碳酸钾(过量),70.0 mL水,加热溶解,再加入2.0 mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0 mL氯化苄。搅拌加热回流反应1~1.5 h。反应结束后冷却,并转入125 mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208 ℃的馏分,得8.4 mL苯甲醇。 回答下列问题: - 20 - (1)仪器X的名称是___,冷却水应从___(填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___(填字母)。 (2)本实验中加入无水硫酸镁的目的是___。从绿色化学角度考虑,萃取剂宜采用___(填字母)。 A.乙醇 B.乙酸乙酯 C.苯 D.氯仿 (3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___(填“是”或“否”)正确,其理由是___。 (4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___。 (5)本实验苯甲醇的产率为___%(计算结果保留一位小数)。 28.CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。 (1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表: 则制备合成气的反应CH4(g)+CO2(g)2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。 (2)在刚性容器中,当投料比=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。 ①由图可知:压强p1___2 MPa(填“>”、“<”或“=”),理由是___。 ②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。 ③若起始时提高投料比,则CO2的平衡转化率将___(填“升高”或“降低”)。 ④起始时向容器中加入1 mol CH4和1 mol CO2,在温度为T6。、初始压强为2 - 20 - MPa时反应,该反应的Kp=___(MPa)2。 (3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。 当投料比=2.0时,要使积碳量最小,应调节温度为___℃。 (二)选考题: 35.镍及其化合物是重要的合金材料和催化剂。 (1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。 (2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。 (3)元素铜与镍的第二电离能分别为:I2(Cu)=1958 kJ/mol、I2(Ni)=1753 kJ/mol,铜的第二电离能更大的原因是___。 (4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。 (5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-半径为a pm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。 36.化合物M是有机合成重要的中间体,其合成路线如图: - 20 - 回答下列问题: (1)B的名称为___。 (2)M中的官能团名称是___;④的反应类型为___。 (3)反应⑤所需的试剂和条件是___。 (4)反应⑥中的C2H5ONa仅提供碱性环境,则⑥的反应方程式为___。 (5)化合物D有多种同分异构体,符合下列条件的同分异构体共有___种(不考虑立体异构)。 ①能与碳酸氢钠溶液反应放出气体; ②分子中含有六元环。 其中核磁共振氢谱有5组峰,且峰面积之比为1:2:3:4:4的结构简式为___。 (6)设计由乙烯和为原料制备的合成路线___(无机试剂任选)。 - 20 - 2020年高三年级化学高考模拟冲刺训练三答案解析 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 Ni-59 一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。 7.化学与生产、生活密切相关。下列说法错误的是 A. 燃煤中加入生石灰可减少温室气体的排放 B. 用纯碱溶液除油污,加热可提高去污能力 C. 我国北斗导航系统所用的芯片中含高纯硅 D. 医用护目镜片的主要成分属于有机高分子材料 7.A【解析】燃煤中加入生石灰可减少SO2气体的排放,SO2对环境的污染是酸雨,不是温室效应,故A错误;油脂在碱性条件下水解,纯碱水解呈碱性,加热促进水解,溶液碱性增强,可促进油脂的水解,故B正确;硅是半导体,高纯度的硅可制芯片,故C正确; 用作镜片的聚合树脂是有机合成高分子化合物,属于有机高分子材料,故D正确。 8.“连翘酯苷A”是“连花清瘟胶囊”的有效成分。如图有机物是“连翘酯苷A”的水解产物,其结构简式如图所示。下列有关该有机物的说法错误的是 A. 分子式C9H8O4 B. 分子中所有原子可能处于同一平面 C. 1mol该分子最多可与5molH2发生加成反应 D. 能与NaHCO3溶液反应放出CO2 8.C【解析】由结构简式可知其分子式为C9H8O4,故A正确;苯环、碳碳双键均为平面结构,羧基也可以是平面结构,则结构中所有原子可能共平面,故B正确;苯环、碳碳双键均可与H2发生加成反应,则1mol该分子最多可与4molH2发生加成反应,故C错误;分子结构中含有羧基,则能与NaHCO3溶液反应放出CO2,故D正确。 9.探究FeSO4的热分解产物的实验装置如图所示,乙和丙中盛有检验相应物质的常用试剂,实验完成后甲中残留固体为红棕色。下列有关实验操作或现象的叙述正确的是 - 20 - A. 实验过程中持续通氮气的目的是排除装置内空气 B. 用盐酸和K3[Fe(CN)6]溶液检验残留固体的主要成分 C. 乙装置中生成白色沉淀、丙装置中溶液褪色 D. 丁装置中所盛装的试剂可用澄清石灰水替代 9.C【解析】Fe2+易被空气中氧气氧化,加热前排除装置内空气,是防止FeSO4被氧化,加热过程中通氮气的目的是排出反应中生成的气体,故A错误;残留的红棕色固体是氧化铁,溶于稀盐酸得到Fe3+的溶液,应选择KSCN溶液检验,而K3[Fe(CN)6]溶液是检验Fe2+,故B错误;反应中生成的气体是SO3和SO2,乙中盛装BaCl2溶液,应有BaSO4白色沉淀生成,丙中盛装品红溶液,可观察到品红褪色,故C正确; 丁装置中盛装NaOH溶液吸收SO2的尾气,石灰水的浓度低,吸收效果差,不能代替NaOH溶液,故D错误。 10.我国科技工作者运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法错误的是 A. HCOOH吸附在催化剂表面是一个放热过程 B. Pd、Rh作催化剂时HCOOH分解产生H2的反应热不同 C. 该反应过程中有C-H键的断裂,还有C=O键的生成 D. HCOO*+H*=CO2+2H*是该历程的决速步骤 10.B【解析】HCOOH吸附在催化剂表面是能量降低过程,即为放热过程,故A正确;催化剂能改变反应速率,不改变热效应,则Pd、Rh作催化剂时HCOOH分解产生H2的反应热相同,故B错误; HCOOH催化分解生成CO2和H2 - 20 - ,原来HCOOH分子中存在的化学键1个C-H键、1个C=O键、1个C-O键和1个O-H键;而产物中有2个C=O键和1个H-H,说明反应过程中有C-H键的断裂,还有C=O键的生成,故C正确;HCOO*+H*到过渡态Ⅱ活化能最大,是反应消耗能量高的过程,速率最慢,故HCOO*+H*=CO2+2H*是该历程的决速步骤,故D正确。 11.科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是 A. 原子半径:Z>Y>X>W B. 氢化物的沸点:Y>X>Z>W C. X的氧化物的水化物是强酸 D. Y的某种单质具有杀菌消毒作用 11.D【解析】由分析知:W为C元素、X为N元素、Y为O元素、Z为Cl元素;C、N、O为同周期主族元素,核电荷数越大,原子半径越小,C、N、O、Cl四种元素的原子半径由大到小的顺序为Cl>C>N>O,即Z>W>X>Y,故A错误;H2O常温下为液体,NH3和H2O分子间存在氢键,四种元素简单氢化物的沸点由高到低的顺序为H2O>NH3>HCl>CH4,但C的氢化物包括多碳的烃,常温下有固体,有液体,即碳的氢化物沸点也可能比H2O高,故B错误;N的最高价氧化物的水化物HNO3是强酸,而+3价N的氧化物水化物HNO2是弱酸,故C错误;O3具有强氧化性,具有杀菌消毒作用,故D正确。 12.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气,原理如图所示。下列说法错误的是 A. 催化电极b与电源负极相连 B. 电解时催化电极a附近的pH增大 C. 电解时阴离子透过交换膜向a极迁移 D. 生成的甘油醛与合成气的物质的量相等 - 20 - 12.B【解析】催化电极b表面CO2还原为CO,为电解池的阴极,与电源的负极相连,故A正确;催化电极a为阳极,表面甘油(C3H8O3)氧化为甘油醛(C3H6O3),发生的电极反应为C3H8O3-2e-+2CO32-= C3H6O3+2HCO3-,则电极附近的pH减小,故B错误;电解池工作时,阴离子向阳极区移动,即阴离子透过交换膜向a极迁移,故C正确;阳极生成1mol C3H6O3转移2mole-,阴极生成1molCO和H2的混合气体转移2mole-,电解池工作时,阴、阳极转移电子的物质的量相等,则生成的甘油醛与合成气的物质的量相等,故D正确。 13.在25 ℃时,向20.00 mL 0.10 mol/L一元弱碱MOH溶液中滴0.10 mol/L HCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是 A. a+b=14 B. Q点消耗盐酸的体积小于20.00mL C. M点和N点溶液中,相等 D. 当V(HCl)=10.00 mL时,c(M+)-c(MOH)=c(OH-)-c(H+) 13.D【解析】c(H+)=10-pH=10-a时,c(OH-)=10-pOH=10-b,25℃时,c(H+)•c(OH-)=10-pH×10-pOH=10-14=10-a×10-b,则a+b=14,故A正确;MOH为弱碱,如果滴加盐酸20 mL,恰好生成MCl,溶液显酸性,而Q点pH=pOH,此时溶液显中性,则消耗盐酸的体积小于20.00mL,故B正确;==,其中温度不变,Kw和Kb是定值,则M点和N点溶液中,相等,故C正确;当V(HCl)=10.00mL时,溶液中溶质为MCl和MOH且等物质的量浓度,且c(MOH)<c(Cl-),已知溶液中存在的电荷守恒为c(M+)+ c(H+) =c(OH-)+c(Cl-),则c(OH-)-c(H+)= c(M+)- c(Cl-)<c(M+)-c(MOH),故D错误。 三、非选择题: 26.二氧化氯是国际上公认的对环境无二次污染的消毒杀菌剂。它常温下为气体,易溶于水,受热易分解。甲醇法制制备二氧化氯的工艺如图: - 20 - 回答下列问题: (1)ClO2可用于纸浆漂白、杀菌消毒是因其具有___性。 (2)加入“发生器”的浓硫酸先稀释为63%H2SO4,冷却后加入反应器的原因是___。实际操作中再“发生器”中加入适量NaCl以加快反应速率,若NaCl过量会发生成污染环境的一种气体的分子式为___。 (3)若1molCH3OH反应时转移6mole-,则“发生器”中发生反应的主要化学方程式为___。 (4)Na2SO4·10H2O和Na2SO4的溶解度曲线如图所示,则“过程Ⅱ”的操作是:加热浓缩至有大量晶体析出、___、经干燥得Na2SO4固体。 (5)采用惰性电极为阳极,通过电解亚氯酸钠溶液的方法也可以制备二氧化氯,其阳极的电极反应式为___。 (6)与甲醇法制备二氧化氯相比,电解法的优点是___(写出2点)。 26.(1)强氧化 (2)避免因浓硫酸稀释放热,使ClO2受热分解 Cl2 (3)CH3OH+6NaClO3+4H2SO4=2Na3H(SO4)2+CO2↑+6ClO2↑+5H2O (4)在高于32.4℃条件下趁热过滤、洗涤 (5)ClO2--e-=ClO2↑ (6)绿色环保;操作简便;原子利用率高 【解析】(1)利用ClO2的强氧化性,常用于纸浆漂白、杀菌消毒; (2)浓硫酸先稀释为63%H2SO4,待冷却后加入反应器,这样的操作可避免因浓硫酸稀释放热,使ClO2受热分解;加入适量NaCl可加快反应速率,但过量NaCl在酸性条件下,可被ClO2氧化生成Cl2,而污染环境; (3)CH3OH中碳元素化合价为-2价,若1 mol CH3OH反应时转移6 mol e-,则CH3OH的氧化产物为CO2,则“发生器”中发生反应的主要化学方程式为CH3OH+6NaClO3+4H2SO4=2Na3H(SO4)2+CO2↑+6ClO2↑+5H2O; - 20 - (4)当温度低于32.4 ℃时有Na2SO4·10H2O析出,则“过程Ⅱ”中加热浓缩至有大量晶体析出后,需要在高于32.4 ℃条件下趁热过滤、洗涤,最后再干燥得Na2SO4固体; (5)阳极上ClO2-失电子发生氧化反应生成ClO2,电极反应式为ClO2--e-=ClO2↑; (6)比较甲醇法与电解法,可知电解法的优点是绿色环保、操作简便、原子利用率高。 27.苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图: 实验步骤:如图所示,在装有电动搅拌器的250 mL三颈烧瓶里加入9.0 g碳酸钾(过量),70.0 mL水,加热溶解,再加入2.0 mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0 mL氯化苄。搅拌加热回流反应1~1.5 h。反应结束后冷却,并转入125 mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208 ℃的馏分,得8.4 mL苯甲醇。 回答下列问题: (1)仪器X的名称是___,冷却水应从___(填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___(填字母)。 (2)本实验中加入无水硫酸镁的目的是___。从绿色化学角度考虑,萃取剂宜采用___(填字母)。 A.乙醇 B.乙酸乙酯 C.苯 D.氯仿 - 20 - (3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___(填“是”或“否”)正确,其理由是___。 (4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___。 (5)本实验苯甲醇的产率为___%(计算结果保留一位小数)。 27. (1)球形冷凝管 下口 B (2)干燥 B (3)否 电动搅拌器使不相溶的反应液混合均匀,加快反应速率 (4)提高氯化苄在水中的溶解度,使反应物充分接触(或增大有效碰撞几率) (9). (5).89.4 【解析】(1)仪器X的名称是球形冷凝管,冷却水采用逆流的方式冷却效果较好,所以冷却水应从下口通入;由于苯甲醇的沸点较高,易液化,在蒸馏纯化操作中最适宜选用B仪器,有利于液体顺利流下; (2)加入无水硫酸镁,利用其易水形成结晶水合物,达到干燥的目的;乙醇有刺激性,苯有毒,氯仿有麻醉作用,而乙酸乙酯有特殊香味,无毒,则从绿色化学角度考虑,萃取剂宜采用乙酸乙酯,故答案为B; (3)不能用沸石代替电动搅拌器,因为使用电动搅拌器,除防暴沸,还可使不相溶的反应液混合均匀,加快反应速率; (4)四乙基溴化铵易溶于水,而氯化苄不溶于水,易溶于四乙基溴化铵,则加入四乙基溴化铵,可提高氯化苄在水中溶解度,使反应物充分接触,提高反应效率; (5)10.0 mL氯化苄质量为11 g,其物质的量为=mol,理论生成苯甲醇的质量为mol×108 g/mol=9.39 g,则苯甲醇的产率为=89.4%。 28.CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。 (1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表: 则制备合成气的反应CH4(g)+CO2(g)2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。 (2)在刚性容器中,当投料比=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。 - 20 - ①由图可知:压强p1___2 MPa(填“>”、“<”或“=”),理由是___。 ②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。 ③若起始时提高投料比,则CO2的平衡转化率将___(填“升高”或“降低”)。 ④起始时向容器中加入1 mol CH4和1 mol CO2,在温度为T6。、初始压强为2 MPa时反应,该反应的Kp=___(MPa)2。 (3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。 当投料比=2.0时,要使积碳量最小,应调节温度为___℃。 28.(1)+247 (2)①< 该正反应气体分子数增加,其它条件相同时,减小压强,平衡正向移动,CO2的平衡转化率增大 ②> ③升高 ④ 4 (3)750 【解析】(1)CH4(g)+CO2(g)2CO(g)+2H2(g)在标准状态下的反应热ΔH=(-111 kJ/mol)×2-(-75 kJ/mol)- (-394 kJ/mol)=+ 247 kJ/mol; (2)①已知CH4(g)+CO2(g)2CO(g)+2H2(g)的正反应气体分子数增加,在恒温条件下,减小压强,平衡正向移动,CO2的平衡转化率增大,即压强p1<2 MPa; ②当温度为T3、压强为p1时,a点趋于平衡状态时,CO2的转化率增大,说明此时向正反应方向进行,即v正>v逆; ③起始时提高投料比,即增大n(CH4)的量,平衡正向进行,则CO2的平衡转化率将升高; - 20 - ④起始时向容器中加入1 mol CH4和1 mol CO2,在温度为T6,初始压强为2 MPa时反应,达到平衡时CO2的转化率为50%,则: 平衡时CH4和CO2的体积分数均为,CO和H2的体积分数均为,平衡时总压强p=2 MPa×=3 MPa,则Kp= = =4(MPa)2; (3)当投料比=2.0时,要使积碳量最小,根据积碳量与投料比、温度的关系图可知,应调节温度在750℃左右。 (二)选考题: 35.镍及其化合物是重要的合金材料和催化剂。 (1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。 (2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。 (3)元素铜与镍的第二电离能分别为:I2(Cu)=1958 kJ/mol、I2(Ni)=1753 kJ/mol,铜的第二电离能更大的原因是___。 (4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。 (5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-半径为a pm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。 35. (1)3d84s2 28 (2)sp N2或CO 大 NH3中N的孤电子对形成配位键后,使N—H成键电子对所受斥力减小,键角增大 (3)Cu+的价电子排布式为3d10,处于半充满,而Ni+的价电子排布式为3d84s1,因此Cu+比Ni+稳定,更难失电子 (4)(1,,) (5) - 20 - 【解析】(1)镍原子的核电荷数为28,基态Ni原子的电子排布式为1s22s22p63s23p63d84s2,则价电子排布式为3d84s2;原子核外不存在运动状态完全相同的电子,则Ni核外有28种运动状态不同的电子; (2)CN-中碳原子的价层电子对数目为1+=2,则碳原子的杂化方式为sp;CN-的原子数目为2,价电子数为10,则与CN-互为等电子体的一种分子是N2或CO;NH3分子中N原子有1个孤对电子,[Ni(NH3)4]2+中NH3中N的孤电子对形成配位键后,使N—H成键电子对所受斥力减小,键角增大,则[Ni(NH3)4]2+中H-N-H键角大于NH3分子中H-N-H键角; (3)Cu+的价电子排布式为3d10,处于全充满,而Ni+的价电子排布式为3d84s1,因此Cu+比Ni+稳定,更难失电子,所以铜的第二电离能较大; (4)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),C在x、y、z轴上的投影分别是1、、,所以C的晶胞参数为(1,,); (5)根据图知,每个Ni原子被3个O原子包围、每个O原子被3个Ni原子包围,如图所示,相邻的3个圆中心连线为正三角形,三角形的边长为2a pm,每个三角形含有一个Ni原子,三角形的面积=[×2a×2a×sin60°×10-24] m2=×10-24a2 m2,如图实际上每个Ni原子被两个小三角形包含小平行四边形面积为2×10-24a2 m2,O原子个数=×6=1,每平方米面积上分散的该晶体的质量==g。 36.化合物M是有机合成重要的中间体,其合成路线如图: - 20 - 回答下列问题: (1)B的名称为___。 (2)M中的官能团名称是___;④的反应类型为___。 (3)反应⑤所需的试剂和条件是___。 (4)反应⑥中的C2H5ONa仅提供碱性环境,则⑥的反应方程式为___。 (5)化合物D有多种同分异构体,符合下列条件的同分异构体共有___种(不考虑立体异构)。 ①能与碳酸氢钠溶液反应放出气体; ②分子中含有六元环。 其中核磁共振氢谱有5组峰,且峰面积之比为1:2:3:4:4的结构简式为___。 (6)设计由乙烯和为原料制备的合成路线___(无机试剂任选)。 36.(1)1,3—丁二烯 (2)酯基 氧化反应 (3)C2H5OH/浓H2SO4、加热 (4)+C2H5OH (5)5 (6) - 20 - 【解析】(1)B的结构简式为,其名称为1,3—丁二烯; (2)M结构简式为,含有的官能团是酯基;反应④是被强氧化剂氧化为,反应类型为氧化反应; (3)反应⑤是与乙醇发生酯化反应,所需的试剂和条件是C2H5OH/浓H2SO4、加热; (4)G的结构简式为和I的结构简式为,结合反应⑦发生酯的水解,可知H的结构简式为,则反应⑥发生反应的反应方程式为+C2H5OH; (5)化合物D的结构简式为,其同分异构体符合下列条件:①能与碳酸氢钠溶液反应放出气体,说明分子结构中含有-COOH;②分子中含有六元环,此环应该是,则:含有1个-CH2COOH,只有1种;含有含有1个-COOH和1个-CH3,有4种;故共有5种,其中核磁共振氢谱有5组峰,且峰面积之比为1:2:3:4:4的结构简式为; (6)可由乙醇和发生酯化反应得到,而遇强氧化剂氧化可生成 - 20 - ,与乙烯发生加成反应可生成,则由乙烯和为原料制备的合成路线为。 - 20 -查看更多