2018届高考二轮复习人教版选择题第一篇专题四元素周期律和周期表课件16(67张)
专题四 元素周期律和周期表
第一篇 高考选择题满分策略
真题调研
洞察规律
角度一 微粒结构与化学键
栏目索引
角度二 元素周期表和周期律的应用
角度三 元素周期表与物质转化关系融合
真题调研
洞察规律
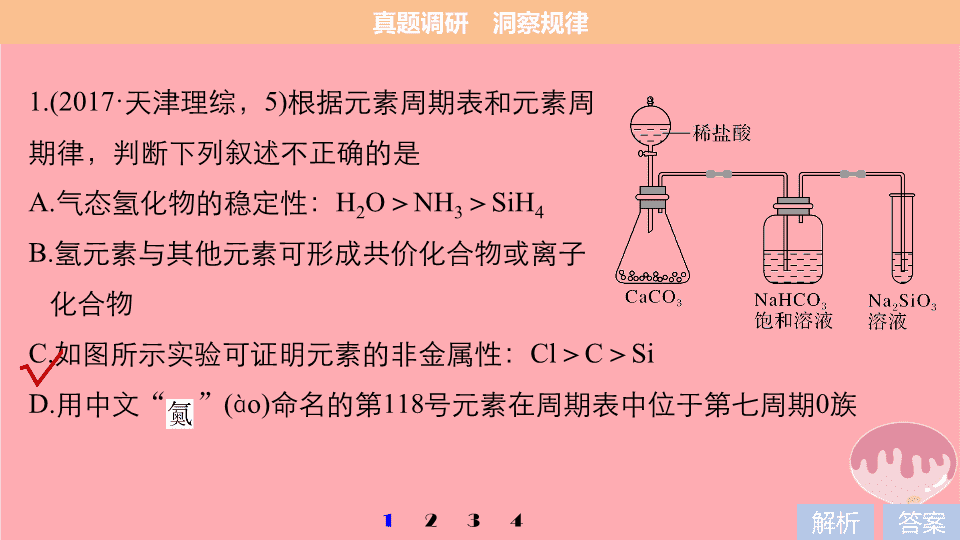
1.(2017·
天津理综,
5)
根据元素周期表和元素周
期律,判断下列叙述不正确的是
A.
气态氢化物的稳定性:
H
2
O
>
NH
3
>
SiH
4
B.
氢元素与其他元素可形成共价化合物或离子
化合物
C.
如图所示实验可证明元素的非金属性:
Cl
>
C
>
Si
D.
用中文
“ ”
(
à
o
)
命名的第
118
号元素在周期表中位于第七周期
0
族
答案
解析
√
2
3
1
4
解析
A
项,因
O
、
N
、
Si
元素的非金属性逐渐减弱,所以气态氢化物的稳定性:
H
2
O
>
NH
3
>
SiH
4
,正确;
B
项,氢元素与其他元素可形成共价化合物如
H
2
O
、
NH
3
、
SiH
4
、
H
2
S
等,也可形成离子化合物如
NaH
等,正确;
C
项,
HCl
不是最高价含氧酸,不能证明元素的非金属性:
Cl
>
C
,错误;
D
项,根据元素的原子序数与元素在周期表中位置的规律,可推出第
118
号元素在周期表中位于第七周期
0
族,正确。
2
3
1
4
2.(2017·
全国卷
Ⅱ
,
9)a
、
b
、
c
、
d
为原子序数依次增大的短周期主族元素,
a
原子核外电子总数与
b
原子次外层的电子数相同;
c
所在周期数与族数相同;
d
与
a
同族,下列叙述正确的是
A.
原子半径:
d>c>b>a
B.4
种元素中
b
的金属性最强
C.c
的氧化物的水化物是强碱
D.d
单质的氧化性比
a
单质的氧化性强
答案
解析
√
2
3
1
4
2
3
1
4
解析
a
、
b
、
c
、
d
分别为
O
、
Na
或
Mg
、
Al
、
S
。
A
项,原子半径
b
>
c
>
d
>
a
,错误;
B
正确;
C
项,
c
的氧化物的水化物为氢氧化铝,为两性氢氧化物,不是强碱,错误;
D
项,
S
的氧化性比氧气的氧化性弱,错误。
3.(2017·
全国卷
Ⅲ
,
12)
短周期元素
W
、
X
、
Y
和
Z
在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为
21
。下列关系正确的是
A.
氢化物沸点:
W
<
Z B.
氧化物对应水化物的酸性:
Y
>
W
C.
化合物熔点:
Y
2
X
3
<
YZ
3
D.
简单离子的半径:
Y
<
X
答案
解析
√
2
3
1
4
W
X
Y
Z
解析
根据短周期元素
W
、
X
、
Y
和
Z
在周期表中的相对位置可知四种元素位于第二、三周期,又知这四种元素原子的最外层电子数之和为
21
,可设
Y
的最外层电子数为
x
,则有
x
+
(
x
+
2)
+
(
x
+
3)
+
(
x
+
4)
=
21
,
x
=
3
,所以
W
、
X
、
Y
、
Z
依次为
N
、
O
、
Al
、
Cl
。
A
项,
NH
3
分子之间存在氢键,故沸点:
NH
3
>HCl
,错误;
B
项,
Y
的氧化物对应水化物为
Al(OH)
3
,
W
的氧化物对应水化物若为
HNO
3
,则
HNO
3
酸性强于
Al(OH)
3
,错误;
C
项,
Al
2
O
3
为离子晶体,而
AlCl
3
为分子晶体,离子键要比分子间作用力强得多,故一般离子晶体的熔、沸点高于分子晶体,错误;
D
项,
O
2
-
与
Al
3
+
的电子层结构相同,但
O
2
-
的核电荷数少,故其半径较大,正确。
2
3
1
4
4.(2017·
全国卷
Ⅰ
,
12)
短周期主族元素
W
、
X
、
Y
、
Z
的原子序数依次增大,
W
的简单氢化物可用于制冷剂,
Y
的原子半径是所有短周期主族元素中最大的。由
X
、
Y
和
Z
三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A.X
的简单氢化物的热稳定性比
W
的强
B.Y
的简单离子与
X
的具有相同的电子层结构
C.Y
与
Z
形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z
与
X
属于同一主族,与
Y
属于同一周期
答案
解析
2
3
1
4
√
解析
W
为氮元素,
Y
为钠元素,
X
、
Y
、
Z
形成的盐,加入盐酸生成黄色沉淀及刺激性气体,结合四种元素均是短周期元素,说明是
Na
2
S
2
O
3
与盐酸反应生成
S
和
SO
2
:
Na
2
S
2
O
3
+
2HCl===2NaCl
+
S
↓
+
SO
2
↑
+
H
2
O
,
X
为氧元素,
Z
为硫元素。
A
项,
O
的非金属性强于
N
的,稳定性:
H
2
O>NH
3
,正确;
B
项,
O
2
-
、
Na
+
均具有
Ne
的电子层结构,
B
正确;
C
项,
Na
2
S
溶液因
S
2
-
水解呈碱性,蓝色石蕊试纸不变色,错误;
D
项,
S
和
O
同属于第
Ⅵ
A
族,
S
与
Na
同属于第三周期,正确。
2
3
1
4
角度一 微粒结构与化学键
1.
一个信息丰富的粒子
(
原子或离子
)
符号
高考必备
2.
微粒间的
“
四个
”
数量关系
(1)
质子数=核电荷数=核外电子数=原子序数;
(2)
质量数=质子数+中子数;
(3)
质子数=阳离子的核外电子数+阳离子所带正电荷数;
(4)
质子数=阴离子的核外电子数-阴离子所带负电荷数。
3.
化学键与物质类别的关系
4.
表示物质组成和结构的两种模型、四种符号、六种图示
(1)
两种模型
①
球棍模型:
②
比例模型:
(
3
)
六种图示
①
化学式:
Na
2
O
2
、
NH
4
Cl
、
SiO
2
②
分子式:
C
2
H
4
、
NH
3
③
电子式:
④
结构式:
⑤
结构简式:
CH
3
CH
2
OH
⑥
原子结构示意图:
、
、
例
1
在二氯化铂的
HCl
溶液中通入乙烯气体,再加入
KCl
可得
K[Pt(C
2
H
4
)Cl
3
]·H
2
O
(
蔡氏盐
)
,下列相关表示正确的是
B.
氯离子的结构示意图:
C.
乙烯的结构简式:
CH
2
CH
2
D.KCl
的电子式:
典例剖析
答案
解析
√
解题思路
解题思路
“
三步法
”
判断化学用语的正误
解析
A
项,应表示为
;
B
项,应表示为
;
C
项,有机物官能团不能省略。
例
2
化学反应的本质是反应物化学键断裂和生成物化学键形成的过程,下列关于化学反应
2Na
2
O
2
+
2CO
2
===2Na
2
CO
3
+
O
2
的叙述正确的是
A.
反应过程中只涉及离子键和极性共价键的断裂
B.
反应过程中只涉及离子键和非极性共价键的形成
C.
反应过程中只涉及离子键和极性共价键的断裂和离子键和非极性共价
键的形成
D.
反应过程中既涉及离子键、极性和非极性共价键的断裂,又涉及离子
键、极性和非极性共价键的形成
√
解题思路
分析反应物和生成物中存在的化学键类型
→
逐项对比
→
确定答案。
答案
解析
解题思路
解析
Na
2
O
2
中存在离子键和非极性共价键,
CO
2
中存在极性共价键,
Na
2
CO
3
中存在离子键和极性共价键,
O
2
中存在非极性共价键,
D
项符合题意。
经典精练
1.
下列叙述错误的是
A.
13
C
和
14
C
属于同一种元素,它们互为同位素
B.
1
H
和
2
H
是不同的核素,它们的质子数相等
C.
14
C
和
14
N
的质量数相等,它们的中子数不等
D.
6
Li
和
7
Li
的电子数相等,中子数也相等
答案
解析
√
2
3
1
4
5
6
7
解析
13
C
和
14
C
属于碳元素的两种不同原子,二者中子数不同,互为同位素;
1
H
和
2
H
是不同的核素,它们的质子数相等,均为
1
;
14
C
和
14
N
的质量数相等,它们的中子数分别是
8
、
7
;
6
Li
和
7
Li
的电子数相等,均为
3
,但中子数不同,分别为
3
、
4
。
2
3
1
4
5
6
7
2.
下列各项表达中正确的是
A.Na
2
O
2
的电子式为
B.106 g
的乙醇和丙醇混合液完全燃烧生成的
CO
2
为
112 L(
标准状况
)
C.
在氮原子中,质子数为
7
而中子数不一定为
7
D.Cl
-
的结构示意图为
答案
解析
√
2
3
1
4
5
6
7
解析
Na
2
O
2
是离子化合物,其电子式应标出阴、阳离子,
A
错误;
只有当乙醇与丙醇按照物质的量比
1
∶
1
混合时,
106 g
混合物燃烧才生成标准状况下
CO
2
气体
112 L
,
B
错误;
Cl
-
核外有
18
个电子,即最外层电子数应为
8
,
D
错误。
2
3
1
4
5
6
7
3.
下列说法正确的是
A.
分子中既含极性键,又含非极性键
B.
只含
H
、
N
、
O
三种元素的化合物,可能是离子化合物,也可能是共价
化合物
C.
非金属元素组成的化合物只含共价键
D.
钠的单质在空气中燃烧生成只含离子键的化合物
答案
解析
√
2
3
1
4
5
6
7
解析
A
项,没有同种元素之间的共价键,因而不含非极性键;
B
项,
NH
4
NO
3
为离子化合物,
HNO
3
为共价化合物,正确;
D
项,
Na
2
O
2
中存在共价键。
2
3
1
4
5
6
7
4.
下列叙述中正确的是
A.O
3
和
NO
2
都是共价化合物
B.
有化学键断裂的变化属于化学变化
C.
在离子化合物与共价化合物中,都不存在单个小分子
D.
在反应
O
3
+
2KI
+
H
2
O===2KOH
+
I
2
+
O
2
中,参加反应的所有臭氧都作
氧化剂
答案
解析
√
2
3
1
4
5
6
7
解析
O
3
为单质,
A
项错误;
化学变化的实质是旧化学键断裂和新化学键形成,仅有化学键断裂不是化学反应,如氯化氢溶于水,
B
项错误;
离子化合物中不存在分子,共价化合物中有的不含有分子,如二氧化硅,有的含有分子,如水等,
C
项错误;
臭氧中的三个氧原子是按照一定方式结合的,虽然反应后有两个氧原子化合价没有变化,但臭氧分子作为一个整体,化合价发生了变化,
D
项正确。
2
3
1
4
5
6
7
新题预测
5.
对下列化学用语的理解和描述均正确的是
A.
电子式
可以表示羟基,也可以表示氢氧根离子
B.
比例模型
可以表示二氧化碳分子,也可以表示水分子
C.
原子结构示意图
可以表示
12
C
,也可以表示
14
C
D.
结构示意图为
的阴离子都不能破坏水的电离平衡
答案
解析
√
2
3
1
4
5
6
7
解析
电子式
只能表示羟基,氢氧根的电子式为
,
A
错误;
CO
2
是直线形结构,
B
错误;
12
C
和
14
C
只是中子数不同,核外电子排布相同,
C
正确;
结构示意图为
的阴离子,例如硫离子能破坏水的电离平衡,
D
错误。
2
3
1
4
5
6
7
A.
氮化碳属于无机非金属材料
B.
氮化碳中碳显-
4
价,氮显+
3
价
C.
氮化碳的化学式为
C
3
N
4
D.
每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
6.
氮化碳结构如图所示,其中
β-
氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是
答案
解析
√
2
3
1
4
5
6
7
解析
氮的非属性比碳强,氮应为-
3
价,碳为+
4
价。
A.
x
=
2
B.
y
=
3
C.
z
=
4 D.
图
(d)
的化学式为
BO
2
7.
四种多硼酸根离子的结构示意图如下,有关叙述正确的是
√
2
3
1
4
5
6
7
答案
解析
解析
A
项,
B
是+
3
价、
O
是-
2
价、
H
是+
1
价,原子团
“
B
3
O
6
”
带的负电荷数
x
=
2
×
6
-
3
×
3
=
3
,故
A
错误;
B
项,原子团
“
H
4
B
4
O
9
”
带的负电荷数
y
=
2
×
9
-
3
×
4
-
1
×
4
=
2
,故
B
错误;
C
项,原子团
“
B
2
O
5
”
带的负电荷数
z
=
2
×
5
-
2
×
3
=
4
,故
C
正确;
D
项,图
(d)
中最小重复结构单元为
“
BO
2
”
,所带负电荷为
2
×
2
-
1
×
3
=
1
,化学式为
,故
D
错误。
2
3
1
4
5
6
7
角度二 元素周期表和周期律的应用
1.
元素周期表的结构
高考必备
元素周期表的结构
位置与结构的关系
周
期
周期序数
元素的种数
(1)
周期序数=原子核外电子层数
(2)
对同主族元素
①
若为第
Ⅰ
A
、
Ⅱ
A
族,则这些主族某一元素的原子序数与上一周期元素的原子序数的差值为上一周期的元素种数;
②
若为第
Ⅲ
A
、
Ⅳ
A
、
Ⅴ
A
、
Ⅵ
A
、
Ⅶ
A
族,则这些主族某一元素的原子序数与上一周期元素的原子序数的差值为该周期的元素种数
短
周
期
第一周期
2
第二周期
8
第三周期
8
长
周
期
第四周期
18
第五周期
18
第六周期
32
第七周期
32
2.
元素金属性和非金属性强弱的比较方法
(1)
元素金属性、非金属性强弱的本质
原子越易失去电子,金属性就越强;原子越易得电子,非金属性就越强;即元素金属性和非金属的强弱,取决于其原子得失电子的难易程度。
(2)
判断元素金属性、非金属性强弱的事实依据:
①
置换反应:强的置换弱的,适合金属也适合非金属。
②
与水或酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强。
③
与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越强。
3.
微粒半径大小比较的规律
“
一看
”
电子层数:当电子层数不同时,电子层数越多,半径越大。
“
二看
”
核电荷数:当电子层数相同时,核电荷数越大,半径越小。
“
三看
”
核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
4.
巧记
10
电子微粒和
18
电子微粒的方法
(1)10
电子微粒:
(2)18
电子微粒:
典例剖析
答案
解析
例
1
(2016·
全国卷
Ⅲ
,
12)
四种短周期主族元素
W
、
X
、
Y
、
Z
的原子序数依次增大,
W
、
X
的简单离子具有相同电子层结构,
X
的原子半径是短周期主族元素原子中最大的,
W
与
Y
同族,
Z
与
X
形成的离子化合物的水溶液呈中性。下列说法正确的是
A.
简单离子半径:
W
Z
√
解析
四种短周期主族元素的原子序数依次增大,
X
的原子半径是短周期主族元素原子中最大的,则
X
为
Na
元素;
Z
与
X(Na
)
形成的离子化合物的水溶液呈中性,则
Z
为
Cl
元素;因
W
与
X
的简单离子电子层结构相同,且
W
与
Y
同族,则
W
可能为
N(
或
O)
元素、
Y
可能为
P(
或
S)
元素。
A
项,
Na
+
与
N
3
-
(
或
O
2
-
)
电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:
Na
+
<
N
3
-
(
或
O
2
-
)
<
Cl
-
。
B
项,
W
与
X
形成的化合物
Na
2
O
、
Na
2
O
2
(
或
Na
3
N)
溶于水后的溶液均为
NaOH
溶液
(
或
NaOH
和
NH
3
的混合溶液
)
,呈碱性。
C
项,元素的非金属性越强,其气态氢化物的热稳定性越强,故热稳定性:
W
>
Y
。
D
项,最高价氧化物对应的水化物中
HClO
4
是最强的无机酸。
例
2
(2016·
全国卷
Ⅱ
,
9)a
、
b
、
c
、
d
为短周期元素,
a
的原子中只有
1
个电子,
b
2
-
和
c
+
离子的电子层结构相同,
d
与
b
同族。下列叙述错误的是
A.a
与其他三种元素形成的二元化合物中其化合价均为+
1
B.b
与其他三种元素均可形成至少两种二元化合物
C.c
的原子半径是这些元素中最大的
D.d
与
a
形成的化合物的溶液呈弱酸性
√
答案
解析
解析
由
“
a
的原子中只有
1
个电子
”
知,
a
为氢元素;由
“
b
、
c
为短周期元素且
b
2
-
和
c
+
的电子层结构相同
”
知,
b
为氧元素、
c
为钠元素;又由
“
d
为短周期元素且
d
与
b
同族
”
知
d
为硫元素。
A
项,氢与氧、硫形成的化合物
H
2
O
、
H
2
O
2
、
H
2
S
中氢的化合价均为+
1
,氢与钠形成的化合物
NaH
中氢的化合价为-
1
价,错误;
B
项,氧与氢可形成
H
2
O
、
H
2
O
2
,氧与钠可形成
Na
2
O
、
Na
2
O
2
,氧与硫可形成
SO
2
、
SO
3
,正确;
C
项,根据同主族、同周期原子半径递变规律知,
H
、
O
、
Na
、
S
的原子半径大小为
Na
>
S
>
O
>
H
,正确;
D
项,硫和氢形成的化合物
H
2
S
的溶液,由于
H
2
S
的电离
H
2
S
H
+
+
HS
-
,使溶液呈弱酸性,正确。
经典精练
1.
原子序数依次增大的元素
a
、
b
、
c
、
d
,它们的最外层电子数分别为
1
、
6
、
7
、
1
。
a
-
的电子层结构与氦相同,
b
和
c
的次外层有
8
个电子,
c
-
和
d
+
的电子层结构相同。下列叙述错误的是
A.
元素的非金属性次序为
c
>
b
>
a
B.a
和其他
3
种元素均能形成共价化合物
C.d
和其他
3
种元素均能形成离子化合物
D.
元素
a
、
b
、
c
各自最高和最低化合价的代数和分别为
0
、
4
、
6
答案
解析
√
2
3
1
4
5
6
解析
根据题意可推知,
a
为
H
,
b
为
S
,
c
为
Cl
,
d
为
K
。非金属性:
Cl
>
S
>
H
,
A
正确;
H
和
K
形成离子化合物
KH
,
B
错误;
K
和
H
、
S
、
Cl
能分别形成离子化合物:
KH
、
K
2
S
、
KCl
,
C
正确;
H
、
S
、
Cl
各自的最高化合价分别为+
1
、+
6
、+
7
,最低化合价分别为
-
1
、-
2
、-
1
,故元素
a
、
b
、
c
各自最高和最低化合价的代数和分别为
0
、
4
、
6
,
D
正确。
2
3
1
4
5
6
2.W
、
X
、
Y
、
Z
均为短周期主族元素,原子序数依次增加,且原子核外
L
电子层的电子数分别为
0
、
5
、
8
、
8
,它们的最外层电子数之和为
18
。下列说法正确的是
A.
单质的沸点:
W
>
X
B.
阴离子的还原性:
W
>
Z
C.
氧化物的水化物的酸性:
Y
<
Z
D.X
与
Y
不能存在于同一离子化合物中
答案
√
2
3
1
4
5
6
解析
解析
由题干中信息可推知元素
W
、
X
、
Y
、
Z
分别为
H
、
N
、
P
、
Cl
。结构相似的分子,相对分子质量越大,沸点越高,即单质沸点:
H
2
<
N
2
,
A
错误;
元素非金属性越强,其相应阴离子的还原性越弱,故阴离子还原性:
H
-
>
Cl
-
,
B
正确;
元素非金属性越强,其最高价氧化物对应的水化物的酸性越强,因此无法比较
P
、
Cl
的氧化物的水化物的酸性强弱,只能比较二者的最高价氧化物对应的水化物的酸性强弱,
C
错误;
(NH
4
)
3
PO
4
是离子化合物,可见
P
、
N
可存在于同一离子化合物中,
D
错误。
2
3
1
4
5
6
3.X
、
Y
、
Z
均为短周期元素,
X
、
Y
处于同一周期,
X
、
Z
的最低价离子分别为
X
2
-
和
Z
-
,
Y
+
和
Z
-
具有相同的电子层结构。下列说法正确的是
A.
原子的最外层电子数:
X
>
Y
>
Z
B.
单质沸点:
X
>
Y
>
Z
C.
离子半径:
X
2
-
>
Y
+
>
Z
-
D.
原子序数:
X
>
Y
>
Z
答案
解析
√
2
3
1
4
5
6
解析
由于
Y
+
与
Z
-
的电子层结构相同,所以两种元素位于相邻周期,则
Y
是
Na
,
Z
是
F
,
X
是
S
。原子的最外层电子数
F
>
S
>
Na
,
A
错误;
常温下氟气是气体,钠、硫为固体,氟气的沸点最低,硫是分子晶体,钠是金属晶体,单质沸点
Na
>
S
>
F
2
,
B
错;
离子半径
S
2
-
>
F
-
>
Na
+
,
C
错;
原子序数
S
>
Na
>
F
,
D
正确。
2
3
1
4
5
6
4.
短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.W
2
-
、
X
+
B.X
+
、
Y
3
+
C.Y
3
+
、
Z
2
-
D.X
+
、
Z
2
-
答案
解析
√
2
3
1
4
5
6
解析
根据题中的选项可知
W
、
X
、
Y
、
Z
形成的简单离子分别为
W
2
-
、
X
+
、
Y
3
+
、
Z
2
-
,又知
W
、
X
、
Y
、
Z
均为短周期元素,且原子序数依次增大,可推出
W
为
O
、
X
为
Na
、
Y
为
Al
、
Z
为
S
。
Al
3
+
为弱碱阳离子、
S
2
-
为弱酸阴离子,都能水解,水解破坏了水的电离平衡;
O
2
-
不能在水溶液中存在;
Na
+
是强碱阳离子不水解,不能破坏水的电离平衡。
新题预测
5.X
、
Y
、
Z
、
W
、
R
是
5
种短周期元素,其原子序数依次增大。
X
是周期表中原子半径最小的元素,
Y
原子最外层电子数是次外层电子数的
3
倍,
Z
、
W
、
R
处于同一周期,
R
与
Y
处于同一主族,
Z
、
W
原子的核外电子数之和与
Y
、
R
原子的核外电子数之和相等。下列说法正确的是
A.
元素
Y
、
Z
、
W
具有相同电子层结构的离子,其半径依次增大
B.
元素
X
不能与元素
Y
形成化合物
X
2
Y
2
C.
元素
Y
、
R
分别与元素
X
形成的化合物的热稳定性:
X
2
Y
>
X
2
R
D.
元素
W
、
R
的最高价氧化物的水化物都是强酸
答案
√
解析
2
3
1
4
5
6
解析
从题目所给的条件可以得出
X
是
H
元素,
Y
是
O
元素,
Z
是
Na
元素,
W
是
Al
元素,
R
是
S
元素。所以,
A
项,
Y
、
Z
、
W
具有相同电子层结构的离子
(O
2
-
、
Na
+
、
Al
3
+
)
,其半径依次减小
(
判断依据:核外电子排布相同的微粒,半径随着核电荷数的增加而减小
)
,错误;
B
项,
X
和
Y
元素能形成两种化合物,
X
2
Y(H
2
O)
和
X
2
Y
2
(H
2
O
2
)
,错误;
C
项,元素
Y
、
R
分别与元素
X
形成的化合物是氢化物,因为
Y(O
元素
)
和
R(S
元素
)
的非金属性强弱:
Y
>
R
,所以对应的氢化物的稳定性:
X
2
Y
>
X
2
R
,正确;
D
项,元素
W
的最高价氧化物的水化物是
Al(OH)
3
,是两性氢氧化物,而元素
R
的最高价氧化物的水化物是
H
2
SO
4
,是强酸,错误。
2
3
1
4
5
6
6.
短周期元素
X
、
Y
、
Z
、
W
、
Q
的原子序数依次增大,各元素原子的最外层电子数之和比
Ca
2
+
的核外电子数少
1
,
X
与
Q
处于同一主族,
Y
、
Z
、
W
处于同一周期的相邻位置。下列叙述错误的是
A.X
与
Z
组成的化合物之一可作为火箭发射的高能燃料
B.Y
与
W
形成的阴离子可能有
或
C.
化合物
Q
2
W
2
与
X
2
W
反应时,
Q
2
W
2
只作氧化剂
D.CaX
2
、
CaY
2
分别与水反应可产生两种可燃性气体
答案
√
解析
2
3
1
4
5
6
解析
Ca
2
+
的核外电子数是
18
,所以各原子的最外层电子数之和为
17
,设
Z
的最外层电子数是
x
,
X
的最外层电子数是
y
,则
x
+
x
-
1
+
x
+
1
+
2
y
=
17
,解得
x
=
5
,
y
=
1
符合题意,所以
X
是
H
元素,
Q
是
Na
元素,
Y
是
C
元素,
Z
是
N
元素,
W
是
O
元素。
H
与
N
组成的化合物
N
2
H
4
可作为火箭发射的高能燃料,
A
项正确;
C
与
O
形成的阴离子可以是
,
B
项正确;
过氧化钠与水反应时,过氧化钠既作氧化剂又作还原剂,
C
项错误;
CaH
2
、
CaC
2
分别与水反应可产生氢气、乙炔两种可燃性气体,
D
项正确。
2
3
1
4
5
6
角度三 元素周期表与物质转化关系融合
典例剖析
例
(2016·
全国卷
Ⅰ
,
13)
短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增加。
m
、
p
、
r
是由这些元素组成的二元化合物,
n
是元素
Z
的单质,通常为黄绿色气体,
q
的水溶液具有漂白性,
0.01 mol·L
-
1
r
溶液的
pH
为
2
,
s
通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
答案
解析
A.
原子半径的大小
WX>Y
C.Y
的氢化物常温常压下为液态
D.X
的最高价氧化物的水化物为强酸
√
解析
由
n
是元素
Z
的单质,通常为黄绿色气体,可知
Z
元素为
Cl
,
n
为
Cl
2
,再根据
q
的水溶液具有漂白性,可知
q
为
HClO
,由
0.01 mol·L
-
1
r
溶液的
pH
为
2
,可判断
r
为一元强酸,则
r
为
HCl
,然后根据
n
和
p
的反应条件,以及
s
通常是难溶于水的混合物,可知
p
为烷烃,
s
为烷烃的氯代物;根据题意,
W
、
X
、
Y
、
Z
是短周期原子序数依次增加的四种元素,可进一步推知
W
、
X
、
Y
、
Z
分别为
H
、
C
、
O
、
Cl
。
A
项,根据原子半径的变化规律,可知原子半径:
H
<
O
<
C
,错误;
B
项,根据同周期元素非金属性的变化规律,可知非金属性:
O
>
C
,再由
CCl
4
、
ClO
2
中化合价的正负,可知非金属性:
O
>
Cl
>
C
,错误;
C
项,氧的氢化物可能为
H
2
O
或
H
2
O
2
,常温常压下二者均为液态,正确;
D
项,碳的最高价氧化物的水化物
H
2
CO
3
为弱酸,错误。
1.(2017·
江西南昌二中第四次考试
)x
、
y
、
z
三种短周期元素,原子半径的大小关系为
r
(y
)
>
r
(x
)
>
r
(z
)
,原子序数之和为
16
。
x
、
y
、
z
三种元素的常见单质在常温下均为气体,在适当条件下可发生如图所示变化,其中
B
和
C
均为
10
电子分子。下列说法不正确的是
答案
解析
经典精练
2
3
1
4
5
6
A.x
元素位于第
Ⅵ
A
族
B.A
不能溶解于
B
中
C.B
的沸点高于
C
的沸点
D.A
和
C
不可能发生氧化还原反应
√
解析
原子半径大小关系为
r
(y)
>
r
(x)
>
r
(z)
,
B
和
C
均为
10
电子分子,则
z
一定是
H
元素,
y
是
N
元素,
x
是
O
元素,满足原子序数之和为
16
,则
A
是
NO
,
C
是
NH
3
,
B
是
H
2
O
。
x
为氧元素,氧元素位于第
Ⅵ
A
族,
A
项正确;
A
为
NO
,
B
为水,
NO
不溶于水,
B
项正确;
常温下水是液体,氨气是气体,则水的沸点大于氨气的沸点,
C
项正确;
NO
和
NH
3
在一定条件下发生氧化还原反应生成氮气和水,
D
项错误。
2
3
1
4
5
6
答案
解析
2
3
1
4
5
6
2.(2016·
江苏清江中学检测
)
如图所示,
a
、
b
、
c
均为非金属单质,
d
、
e
均为含有
10
个电子的共价化合物,且分子中所含原子个数:
d
>
e
,
f
为离子化合物。则下列说法错误的是
A.
常温下,单质
a
呈气态
B.
单质
c
具有强氧化性
C.
稳定性:
d
>
e D.f
受热易分解为
d
和
e
√
解析
a
、
b
、
c
均为非金属单质,
d
、
e
均为含有
10
个电子的共价化合物,则
b
一定为氢气。
3.X
、
Y
、
Z
、
W
是原子序数依次增大的四种短周期元素,
Y
元素原子的最外层电子数是内层电子数的两倍,
Z
是地壳中含量最高的元素,四种元素原子最外层电子数之和为
12
。
A
、
B
、
C
、
D
、
E
是由其中的
2
种或
3
种元素组成的化合物,
F
是由
Z
元素形成的单质。已知:
A
+
B===D
+
F
,
A
+
C===E
+
F
。常温下,
0.1 mol·L
-
1
D
溶液的
pH
为
13
。下列说法正确的是
A.
原子半径:
W
>
Z
>
Y
>
X
B.A
、
C
中所含的化学键类型相同
C.1.0 L 0.1 mol·L
-
1
E
溶液中阴离子总的物质的量为
0.1 mol
D.1 mol A
与足量
B
完全反应共转移了
1 mol
电子
答案
解析
√
2
3
1
4
5
6
解析
Y
元素原子的最外层电子数是内层电子数的两倍,
Z
是地壳中含量最高的元素,四种元素原子最外层电子数之和为
12
,可知
X
、
Y
、
Z
、
W
分别为
H
、
C
、
O
、
Na
。常温时
0.1 mol·L
-
1
D
溶液的
pH
为
13
,可知
D
为一元强碱
NaOH
,结合
F
为单质,则可知反应
A
+
B===D
+
F
和
A
+
C===E
+
F
分别为
2Na
2
O
2
+
2H
2
O===4NaOH
+
O
2
↑
和
2Na
2
O
2
+
2CO
2
===2Na
2
CO
3
+
O
2
。原子半径:
Na
>
C
>
O
>
H
,
A
项错误。
A
、
C
分别为
Na
2
O
2
和
CO
2
,所含化学键类型不同,
B
项错误。
Na
2
CO
3
溶液中存在平衡:
+
H
2
O
+
OH
-
,水解的存在使阴离子数目增多,故阴离子总的物质的量大于
0.1 mol
,
C
项错误。
Na
2
O
2
和
H
2
O
反应,
Na
2
O
2
既是氧化剂又是还原剂,氧元素化合价由-
1
价变为-
2
价和
0
价,因此每反应
1 mol Na
2
O
2
转移
1 mol
电子,
D
项正确。
2
3
1
4
5
6
4.
短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增大,其中
Y
与
Z
为金属元素,四种元素的简单离子的电子层结构均相同。
p
、
q
是它们中的部分元素组成的化合物,
r
是
W
的单质,
s
是
Z
的单质。这些物质间的转化关系如下图所示。下列说法不正确的是
A.
原子半径:
Y
>
Z
>
W
>
X
B.
气态氢化物的稳定性:
X
>
W
C.p
能与盐酸反应,但不能与氢氧化钠溶液反应
D.
一定条件下,
r
与
s
能发生化合反应生成
p
答案
解析
√
2
3
1
4
5
6
解析
由短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增大,其中
Y
与
Z
为金属元素,而且四种元素的简单离子的电子层结构相同可推知,
W
、
X
是第二周期非金属元素,可能为
N
、
O
、
F
,且
W
在周期表中位于
X
左侧,
Y
和
Z
是第三周期的金属元素,可能为
Na
、
Mg
、
Al
。则根据元素周期律可推知,原子半径的大小顺序为
Y
>
Z
>
W
>
X
,
A
项正确;
非金属性:
X
>
W
,故
X
形成的气态氢化物稳定性强于
W
,
B
项正确;
而且可推知
p
、
q
均为由金属和非金属构成的离子化合物,由
p
电解生成
r
、
s
可知,
p
是由
W
和
Z
形成的化合物
Al
2
O
3
,
Al
2
O
3
既能和盐酸反应,又能和氢氧化钠反应,
C
项错误;
一定条件下,
Al
和
O
2
可生成
Al
2
O
3
,
D
项正确。
2
3
1
4
5
6
新题预测
5.
短周期元素
W
、
V
、
X
、
Y
、
Z
的原子序数依次增大。甲、乙、丙、丁、戊是由上述元素组成的化合物,五种化合物中均含有元素
X
,标准状况下,丁为液体,戊为气体,其他三种化合物为固体;常温下,
0.01 mol·L
-
1
乙溶液的
pH
为
12
,甲、丙中含有相同的金属元素
Z
。甲、乙、丙、丁、戊满足如图所示的转化关系
(
反应条件略去,箭头表示一步转化
)
。下列说法正确的是
A.
化合物戊为
CO
2
或
H
2
CO
3
B.
简单离子半径:
Y
>
Z
>
X
C.Z
的最高价氧化物对应的水化物是强碱
D.W
、
X
形成的简单化合物比
W
、
V
形成的简单化合物稳定
答案
解析
√
2
3
1
4
5
6
解析
由
“
短周期元素
”
及
“
常温下,
0.01 mol·L
-
1
乙溶液的
pH
为
12
”
可推知,乙为
NaOH
,结合框图中的物质转化关系和
“
甲、丙中含有相同的金属元素
Z
”
,且
Z
的原子序数比
Y
的大,可知
Y
为
Na
,
Z
为
Al
,故甲为
Al(OH)
3
,丙为
NaAlO
2
,丁为
H
2
O
,戊为
CO
2
。因此
W
、
V
、
X
、
Y
、
Z
分别为
H
、
C
、
O
、
Na
、
Al
。标准状况下,戊为气体,故戊只能是
CO
2
,
A
项错误;
离子半径:
O
2
-
>
Na
+
>
Al
3
+
,
B
项错误;
Al(OH)
3
是两性氢氧化物,
C
项错误;
O
的非金属性比
C
的强,
H
2
O
比
CH
4
稳定性强,
D
项正确。
2
3
1
4
5
6
6.
短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增大。其中一种为金属元素,
m
、
n
、
p
、
q
、
r
、
s
是由这些元素组成的二元或三元化合物。
t
是元素
Y
的常见单质,
m
是一种具有特殊颜色的气体,
p
可作漂白剂、供氧剂。上述物质的转化关系如图所示。下列说法错误的是
A.
四种元素简单离子半径:
X
>
Y
>
Z
>
W
B.p
、
s
分子中的化学键类型完全相同
C.X
、
Y
的简单氢化物的沸点:
Y
>
X
D.
常温下,
0.01 mol·L
-
1
q
溶液的
pH
为
2
√
2
3
1
4
5
6
答案
解析
2
3
1
4
5
6
解析
由性质、用途推断物质,
m
是一种具有特殊颜色的气体,
p
可作漂白剂、供氧剂,则
m
为
NO
2
,
p
为
Na
2
O
2
,结合框图转化关系可推出,
r
为
NO
,
t
为
O
2
。因此,
W
、
X
、
Y
、
Z
分别为
H
、
N
、
O
、
Na
。离子半径大小关系为
r
(N
3
-
)
>
r
(O
2
-
)
>
r
(Na
+
)
>
r
(H
+
)
,
A
项不符合题意。
p
为
Na
2
O
2
,
s
为
NaOH
,
Na
2
O
2
分子中含离子键和非极性共价键,
NaOH
分子中含离子键和极性共价键,
B
项符合题意。
H
2
O
的沸点高于
NH
3
的沸点,
C
项不符合题意。
q
为
HNO
3
,为一元强酸,常温下,
0.01 mol·L
-
1
HNO
3
溶液的
pH
为
2
,
D
项不符合题意。
本课结束