- 2021-05-21 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
知识讲解_《从实验学化学》全章复习与巩固_提高
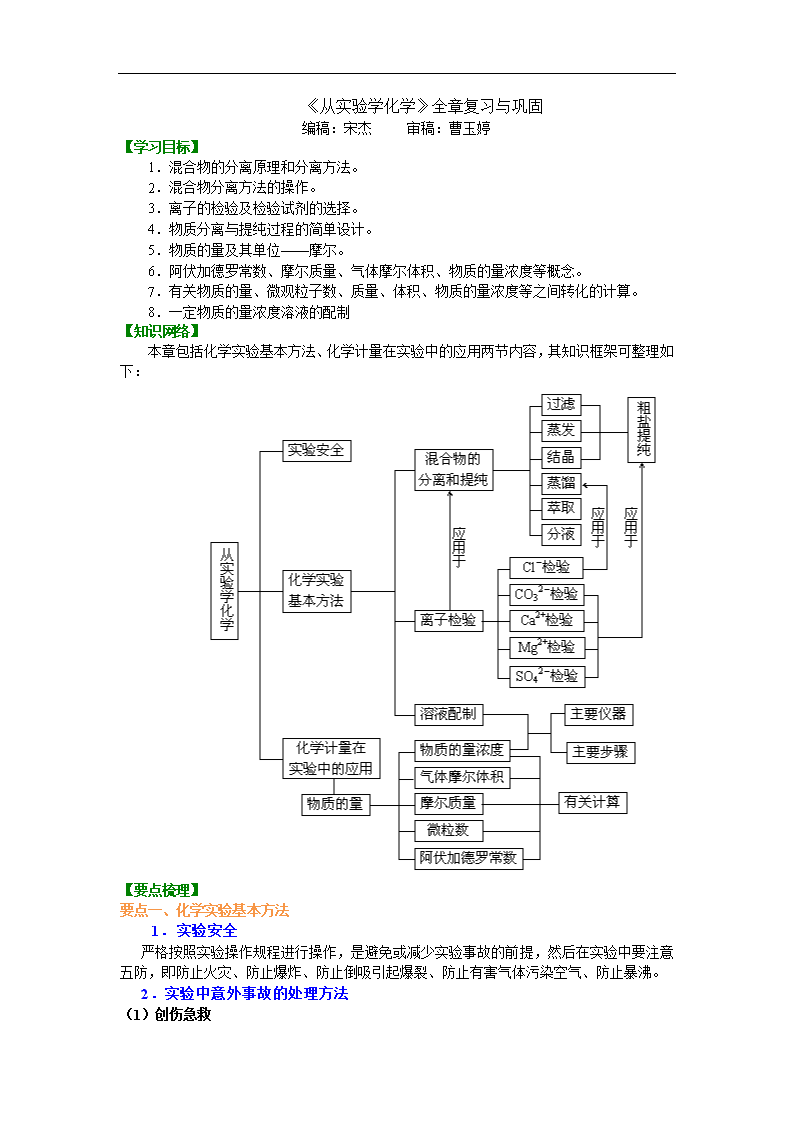
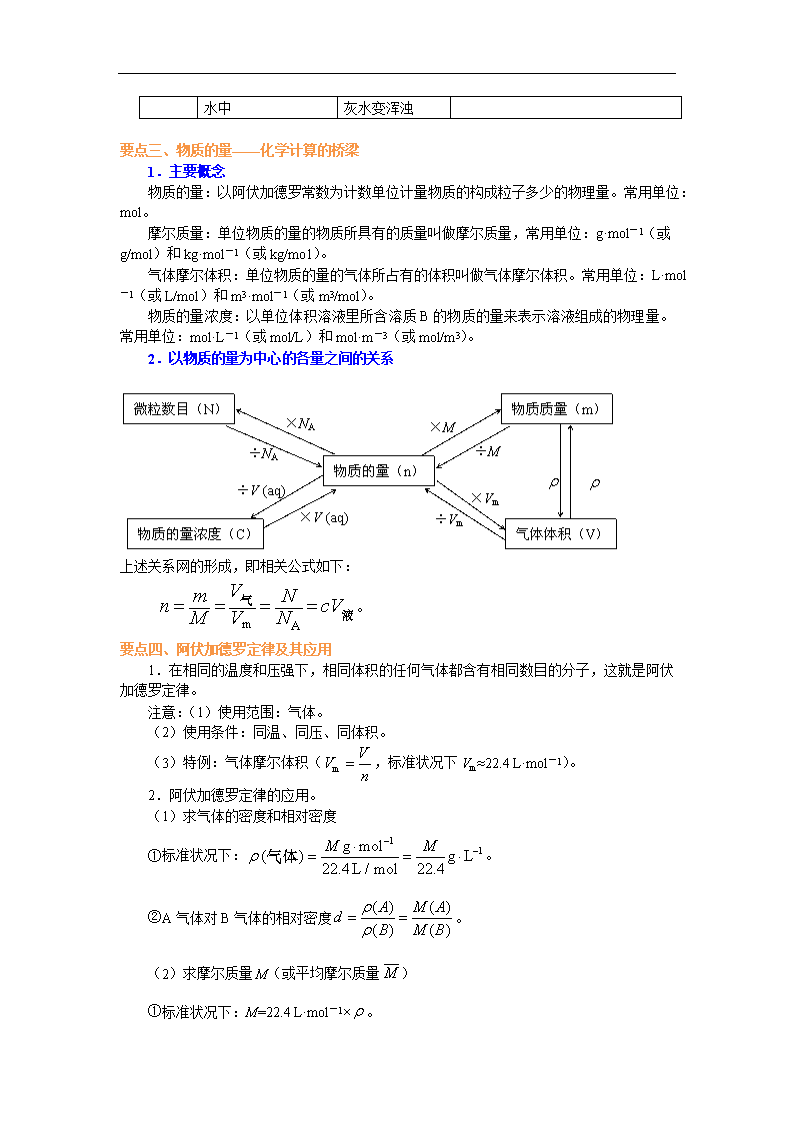
《从实验学化学》全章复习与巩固 编稿:宋杰 审稿:曹玉婷 【学习目标】 1.混合物的分离原理和分离方法。 2.混合物分离方法的操作。 3.离子的检验及检验试剂的选择。 4.物质分离与提纯过程的简单设计。 5.物质的量及其单位——摩尔。 6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。 7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。 8.一定物质的量浓度溶液的配制 【知识网络】 本章包括化学实验基本方法、化学计量在实验中的应用两节内容,其知识框架可整理如 下: 【要点梳理】 要点一、化学实验基本方法 1.实验安全 严格按照实验操作规程进行操作,是避免或减少实验事故的前提,然后在实验中要注意 五防,即防止火灾、防止爆炸、防止倒吸引起爆裂、防止有害气体污染空气、防止暴沸。 2.实验中意外事故的处理方法 (1)创伤急救 用药棉或纱布把伤口清理干净,若有碎玻璃片要小心除去,用双氧水擦洗或涂红汞水, 也可涂碘酒(红汞与碘酒不可同时使用),再用创可贴外敷。 (2)烫伤和烧伤的急救 可用药棉浸 75%—95%的酒精轻涂伤处,也可用 3%—5%的 KMnO4 溶液轻擦伤处到皮 肤变棕色,再涂烫伤药膏。 (3)眼睛的化学灼伤 应立即用大量流水冲洗,边洗边眨眼睛。如为碱灼伤,再用 20%的硼酸溶液淋洗;若 为酸灼伤,则用 3%的 NaHCO3 溶液淋洗。 (4)浓酸和浓碱等强腐蚀性药品 使用时应特别小心,防止皮肤或衣物被腐蚀。如果酸(或碱)流在实验桌上,立即用 NaHCO3 溶液(或稀醋酸)中和,然后用水冲洗,再用抹布擦干。如果只有少量酸或碱滴到 实验桌上,立即用湿抹布擦净,再用水冲洗抹布。 如果不慎将酸沾到皮肤或衣物上,立即用较多的水冲洗,再用 3%—5%的 NaHCO3 溶液 冲洗。如果碱性溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。 (5)扑灭化学火灾注意事项 ①与水发生剧烈反应的化学药品不能用水扑救。如钾、钠、钙粉、镁粉、铝粉、电石、 PCl3、PCl5、过氧化钠、过氧化钡等着火。 ②比水密度小的有机溶剂,如苯、石油等烃类、醇、醚、酮、酯类等着火,不能用水扑 灭,否则会扩大燃烧面积;比水密度大且不溶于水的有机溶剂,如 CS2 着火,可用水扑灭, 也可用泡沫灭火器、二氧化碳灭火器扑灭。 ③反应器内的燃烧,如是敞口器皿可用石棉布盖灭。蒸馏加热时,如因冷凝效果不好, 易燃蒸气在冷凝器顶端燃着,绝对不可用塞子或其他物件堵塞冷凝管口,应先停止加热,再 行扑救,以防爆炸。 要点二、混合物分离和提纯的常用方法 分离和 提纯的 方法 分离的物质 应用举例 过滤 从液体中分离出不溶的固体物质 除去粗盐中的泥沙 蒸发 获得溶液中的溶质(分离溶剂和溶质) 蒸发 NaCl 溶液,获得 NaCl 晶 体 蒸馏 分离沸点不同而又相溶的液态混合物(或分 离固、液混合物) 分离乙醇和水的混合物(加生 石灰) 萃取 分离在不同溶剂中溶解度相差较大的液态 混合物 用 CCl4 萃取碘水中的 I2 离子的检验 离子 检验试剂 实验现象 化学方程式(以两种物质为例) SO42- 加 稀 盐 酸 , 再 加 BaCl2 溶液 产生不溶于酸的 沉淀 Na2SO4+BaCl2==BaSO4↓+2NaCl CO32- 加稀盐酸,将产生的 气体通入澄清石灰 产生的无色无味 的气体使澄清石 Na2CO3+2HCl==2NaCl+H2O+CO2↑ CO2+Ca(OH)2==CaCO3↓+H2O 水中 灰水变浑浊 要点三、物质的量——化学计算的桥梁 1.主要概念 物质的量:以阿伏加德罗常数为计数单位计量物质的构成粒子多少的物理量。常用单位: mol。 摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量,常用单位:g·mol-1(或 g/mol)和 kg·mol-1(或 kg/mo1)。 气体摩尔体积:单位物质的量的气体所占有的体积叫做气体摩尔体积。常用单位:L·mol -1(或 L/mol)和 m3·mol-1(或 m3/mol)。 物质的量浓度:以单位体积溶液里所含溶质 B 的物质的量来表示溶液组成的物理量。 常用单位:mol·L-1(或 mol/L)和 mol·m-3(或 mol/m3)。 2.以物质的量为中心的各量之间的关系 上述关系网的形成,即相关公式如下: m A Vm Nn cVM V N 气 液 。 要点四、阿伏加德罗定律及其应用 1.在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,这就是阿伏 加德罗定律。 注意:(1)使用范围:气体。 (2)使用条件:同温、同压、同体积。 (3)特例:气体摩尔体积( m VV n ,标准状况下 Vm≈22.4 L·mol-1)。 2.阿伏加德罗定律的应用。 (1)求气体的密度和相对密度 ①标准状况下: 1 1g mol( ) g L22.4L / mol 22.4 M M 气体 。 ②A 气体对 B 气体的相对密度 ( ) ( ) ( ) ( ) A M Ad B M B 。 (2)求摩尔质量 M(或平均摩尔质量 M ) ①标准状况下:M=22.4 L·mol-1× 。 ② ( ) ( ) ( ) ( ) ( ) ( ) n A M A n B M BM n A n B ③ ( ) ( ) ( ) ( )M M A A M B B ( 为体积分数)。 (3)确定分子的组成 一般思路是:由体积比导出分子个数比,再根据质量守恒定律确定化学式。 要点五、物质的量浓度在化学实验中的应用 1.物质的量浓度 以单位体积溶液里所含溶质 B 的物质的量来表示溶液组成的物理量,叫做溶质 B 的物 质的量浓度。符号 cB,单位 mol/L,数学表达式 B B nc V 。 2.一定物质的量浓度的溶液的配制 (1)仪器:托盘天平或量筒、烧杯、玻璃棒、指定规格的容量瓶、胶头滴管,其他辅 助用品。 (2)步骤:①计算;②称量;③溶解;④转移;⑤洗涤;⑥定容;⑦摇匀。 (3)注意事项 ①容量瓶在使用前必须检查是否漏水,其程序为加水→倒立、观察→正立→瓶塞旋转 180°→倒立、观察。 ②定容时,视线、液体凹面最低点、刻度线处于同一水平线。 (4)误差分析 根据 n mc V MV ,判断: ①若没有洗涤烧杯内壁,使 n 减小,使浓度偏低; ②若容量瓶中原有少量蒸馏水或定容后反复摇匀,发现液面低于刻度,则对结果无影响; ③转移或搅拌溶液时有部分液体溅出,致使溶液浓度偏低; ④容量瓶内溶液的温度高于 20℃,造成所量取的溶液的体积小于容量瓶上所标注的液 体的体积,致使溶液浓度偏高; ⑤在给容量瓶定容时,仰视读数会使溶液的体积偏大,致使溶液浓度偏低;俯视读数会 使溶液的体积偏小,致使溶液浓度偏高。 要点诠释:作为高中阶段为数不多的定量实验,“一定物质的量浓度溶液的配制”仍是需 要重视的内容,在配制一定物质的量浓度的溶液时,要特别注意,不能直接将溶质放入容量 瓶中进行溶解,而要在烧杯中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到 容量瓶中。这是因为容量瓶的容积是在 20℃时标定的,而绝大多数物质溶解时都会伴随着 吸热或放热过程的发生,引起温度的升降,从而影响到溶液的体积,使所配制的溶液的物质 的量浓度不准确。 要点六、有关物质的量浓度的计算 1.常见几种计算形式 (1) A Nn N (2) mn M (3) 1 ( ) 22.4L molm V Vn V 标准状况 (4)n (B)=c (B)·V (aq) 2.常见题型解读 (1)利用 B B (aq) nc V 进行计算(有时可先用 mn M 或 m Vn V 或 A Nn N )。 (2)质量分数与物质的量浓度的换算 换算依据 1 B 1000mL L (aq) (B) (B) wc M , cB 的单位为 mol·L-1, 的单位为 g·cm-3,M 的单位为 g·mol-1。 推导:1000 mL 即 1 L 溶液的质量为 1000 mL× (aq), 1 L 溶液中所含溶质 B 的质量为 1000 mL× (aq)×w (B) 1 L 溶液中所含溶质 B 的物质的量为1000mL (aq) (B) (B) w M 所以该溶液中溶质的物质的量浓度为1000mL (aq) (B) (B) 1L w M , 即可表示为 1 B 1000mL L (aq) (B) (B) wc M 。 (3)溶解度与物质的量浓度的换算 依 据 饱 和 溶 液 的 溶 解 度 S , 可 求 算 出 饱 和 溶 液 中 溶 质 的 质 量 分 数 ( w ) 为 100%100 S S ;然后由溶液的物质的量浓度与溶质的质量分数的换算公式 c=1000 w/M, 即可推得。 (4)一定物质的量浓度溶液的稀释 ①溶液稀释定律 a.对于已知质量分数溶液的稀释:溶质的质量稀释前后不变,即 m1w1=m2w2。 b.对于已知物质的量浓度溶液的稀释:溶质的物质的量稀释前后不变,即 c1V1=c2V2。 ②相同溶质的溶液混合后溶液浓度的计算 a.等质量混合:混合后溶液质量分数为原溶液质量分数和的一半( 1 2% %% 2 a aa ), 与溶液密度无关。 b.等体积混合: 1 1 2 2 1 1 2 2 1 2 1 2 % % % %% d V a d V a d a d aa d V d V d d 。 (5)已知溶液中某种粒子的物质的量浓度,求其他粒子的物质的量浓度 解答此类题目时要依据两个规律: ①定组成规律 电解质溶液中,阴离子与阳离子浓度之比等于化学组成中离子个数之比,据此可求已知 一种离子浓度的溶液中的另一种离子浓度。 如 Na2SO4 溶液中,c (Na+)=2c (SO42-)=2c (Na2SO4)。 ②电荷守恒规律:因为任何溶液都呈电中性,故溶液中阳离子所带的正电荷总数应等于 阴离子所带的负电荷总数,这个规律称为电荷守恒规律。 例如,在 Na2SO4 溶液中,c (Na+)=2c (SO42-);在 K2SO4、MgSO4 的混合溶液中,c (K+)+2c (Mg2+)=2c (SO42-)(假定溶液中 H+、OH-的浓度相等)。 【典型例题】 类型一、化学实验基本方法 例 1.下列实验能达到目的的是( )。 A.在容量瓶中加一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 B.用稀硫酸和锌粒反应制氢气 C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度 D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质 【思路点拨】运用化学实验的基本方法逐项分析各选项的说法是否正确,特别是要注意 对实验操作的描述是否准确。 【答案】 B 【解析】 一定浓度溶液的配制不能直接在容量瓶中进行溶解和稀释,A 错;过滤时不可 搅拌漏斗中液体,以免划破滤纸,C 错;用盐酸除去硫酸钠中的少量碳酸钠杂质时引入了新 的杂质 NaCl,D 错。 【总结升华】 此类题型宜采用逐项分析法。 举一反三: 【变式 1】下列实验操作与安全事故处理错误的是( ) A.使用温度计测量烧杯中的水浴温度时,不慎打破水银球,用滴管将水银吸出放入水 封的小瓶,残破的温度计插入装有硫粉的广口瓶中 B.用试管夹从试管底由下往上夹住距离管口约 处,手持试管夹长柄末端,进行加热 C.将浓硫酸放入容量瓶中,然后加水稀释制取稀硫酸 D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔 中 【答案】C 类型二、混合物分离和提纯的常用方法 例 2.电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和 Ca2+、Mg2+、Fe3+、SO42―杂 质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下: 请回答以下问题: (1)操作 a 的名称是____________,所用玻璃仪器是 ________________________________。 (2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为________溶 液。 (3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式 ________________。 【思路点拨】先看问题再分析实验过程,问题对于实验过程的分析有一定的提示作用,比 如(2)中加入过量试剂甲后生成了两种大量的沉淀,经分析,能让 Ca2+、Mg2+、Fe3+、SO42― 中有两种离子沉淀的只有 OH-,由此判断试剂甲是一种碱,除去了 Mg2+、Fe3+,还有 Ca2+、 SO42―有待除去。除去 Ca2+用 CO32-,除去 SO42―用 Ba2+,同时为了除去引入的过量的 Ba2+, 确定了除去 Ca2+、SO42―的顺序为先用 Ba2+除去 SO42―,再用 CO32-除去 Ba2+、Ca2+。因此, 可以知道液体 H 的主要成分为 NaOH、Na2CO3 和 NaCl。 【答案】(1)过滤 玻璃棒、漏斗、烧杯 (2)NaOH (3)HCl+NaOH==NaCl+H2O Na2CO3+2HCl==2NaCl+H2O+CO2↑ 【解析】(1)把泥沙等不溶性杂质与溶液分离的操作是过滤,过滤操作中所需玻璃仪器 是玻璃棒、漏斗和烧杯。 (2)过入试剂甲后生成两种沉淀,分析杂质离子必然是 Mg(OH)2 和 Fe(OH)3,所以甲 为 NaOH。 (3)液体 H 中有过量的 NaOH 和 Na2CO3,应加入盐酸可将其除去。 【总结升华】看似比较大的实验题,往往问题都设在一些小的基本操作,所以做好此类题 要注意两点:其一要从宏观把握整个实验方案,其二是准确规范地表述基本操作。 举一反三: 【变式 1】关于粗盐提纯的下列说法正确的是( ) A.溶解粗盐时,应尽量使溶液稀些,防止食盐不完全溶解 B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 C.当蒸发到剩有少量液体时,停止加热利用余热将液体蒸干 D.将制得的晶体转移到新制过滤器中用大量水进行洗涤 【答案】C 【变式 2】 (1)除去 NaNO3 固体中混有的少量 KNO3,所进行的实验操作依次为 ________、蒸发、结晶、________。 ( 2 ) 除 去 KCl 溶 液 中 的 SO42 - , 依 次 加 入 的 溶 液 为 ( 填 溶 质 的 化 学 式 ) __________________。 【答案】 (1)溶解 过滤 (2)BaCl2 [或 Ba(OH)2]、K2CO3、HCl 类型三、物质的量——化学计算的桥梁 例 3.NA 代表阿伏加德罗常数,下列叙述错误的是( )。 A.10 mL 质量分数为 98%的 H2SO4,用水稀释至 100 mL,H2SO4 的质量分数为 9.8% B.在 H2O2+Cl2==2HCl+O2 反应中,每生成 32 g 氧气,则消耗 NA 个 Cl2 分子 C.标准状况下,分子数为 NA 的 CO、C2H4 混合气体体积约为 22.4 L,质量为 28 g D.一定温度下,1 L 0.50 mol·L-1 NaCl 溶液与 2 L 0.25 mol·L-1 Na2CO3 溶液含 Na+的物 质的量不同 【思路点拨】逐选项分析该选项中涉及到的物理量之间的关系,计算时要留心有关细 节的说法是否正确。 【答案】A 【解析】A 项中 H2SO4 的浓度越大,密度越大,故 10 mL 浓 H2SO4 稀释至 100 mL 时, 体积为原来的 10 倍,质量小于原来的 10 倍,则质量分数大于原来的十分之一,A 错;B 项 中,每消耗 1 mol Cl2。就会生成 1 mol O2,32 g O2 的物质的量为 1 mol,B 正确。分子数为 NA 的任何气体(包括混合气体),其物质的量均为 1 mol,在标准状况下的体积都约为 22.4 L, CO 和 C2H4 的相对分子质量相同,均为 28,故 1 mol 的质量为 28 g,C 正确;D 项中 1 L 0.5 mol·L-1的NaCl溶液中含有0.5 mol Na+,而2 L 0.25 mol·L-1的Na2CO3溶液中合有1 mol Na+, 故 D 正确。 【总结升华】正误判断题是化学高考命题的热点之一,常见的命题设错角度有:(1)概 念的内涵、外延有漏洞;(2)问题叙述忽略特例,如有“都是”“一定”“全部”等较绝对的 词;(3)在概念或物理量的“单位”上设错,如“摩尔质量”的单位设作“g”;(4)推论错 误;(5)不考虑条件,如“标准状况”“常温”;(6)计算错误;(7)违背有关定律。如“质 量守恒定律”、“电荷守恒”、“阿伏加德罗定律”等;(8)概念的运用错误。在分析判断时要 关注以上各点。 举一反三: 【变式 1】下列叙述错误的是( ) A.0.012 kg 的 12C 所含的原子数为 6.02×1023 B.1 mol H2O 中含有 2 mol H 和 1 mol O C.2 mol NaOH 溶于 1 L 水中配成溶液的浓度为 2 mol·L―1 D.1 L 2 mol·L―1 NaOH 溶液中含有 NaOH 2 mol 【答案】: C 类型四、阿伏加德罗定律及其应用 例 4.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,若两容器的温度和压强均相 同,且甲的密度大于乙的密度,则下列说法正确的是( )。 A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少 C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小 【思路点拨】两容器的温度和压强均相同,且气体质量相等,而甲的密度大于乙的密度, 由 m V 可知 V 甲<V 乙。 【答案】B 【解析】同温、同压下,气体的物质的量与体积成正比,V 甲<V 乙,故 n 甲<n 乙,B 项 正确;气体的分子数与物质的量成正比,甲的分子数比乙的少,A 错误;因为气体的摩尔体 积在相同温度和压强下相等,C 错误;根据 mM n 可知 M (甲)>M (乙),则 Mr (甲)>Mr (乙), D 错误。 【总结升华】在解答关于阿伏加德罗常数的问题时,应正确理解相关概念的内涵和外延, 缜密细致地分析每一个问题。 举一反三: 【变式 1】在下列条件下,两种气体的分子数一定相等的是 A.同温度、同体积的 N2 和 O2 B.同压强、同体积的 H2 和 CH4 C.同质量、不同密度的 N2 和 CO D.同体积、同密度的 CO2 和 N2 【答案】:C 类型五、物质的量浓度在化学实验中的应用 例 5.标准状况下,1 L 水可溶解 700 L 氨气,所得氨水密度为 0.9 g / mL,求氨水的物质的量 浓度。 【思路点拨】求氨水的物质的量浓度需要知道氨气的物质的量和溶液的体积,氨气的 物质的量可由标准状况下氨气的体积求得,溶液的体积可由溶液的质量和密度求得,溶液的 质量为溶剂的质量和溶质的质量之和,这样来逐步分析,解析过程就变得非常明了。 【答案】18.4 mol·L-1 ,然后再由 ,其中 。 【解析】氨气的物质的量: ,溶液的体积: ,所以 。 【总结升华】本题考查气体溶于水后物质的量浓度的计算。首先求气体溶质的物质的量, 抓住定义表达式,准确理解各物理量的含义,同时化学计算中一定要带单位运算。 类型六、有关物质的量浓度的计算 例 6.在 a L Al2(SO4)3 和(NH4)2SO4 的混合溶液中加入 b mol BaCl2,恰好使溶液中的 SO42-完 全沉淀;如加入足量强碱并加热可得到 c mol NH3 气体,则原溶液中的 Al3+浓度(mol/L) 为( )。 A. 2 2 b c a B. 2( ) 3 b c a C. 2 3 b c a D. 2 6 b c a 【思路点拨】Ba2++ SO42-= BaSO4↓,NH4++OH- NH3↑+H2O,根据方程式中的数 量关系,再运用电荷守恒计算。 【答案】C 【解析】由于产生 c mol NH3,则必定有 c mol NH4+,使 SO42-完全沉淀需 b mol Ba2+, 因此 SO42-有 b mol。根据电荷守恒:2c (SO42-)=c (NH4+)+3c (Al3+), 则 33 (Al ) (2 )mol / Lb cc a a , 3 2(Al ) mol / L3 b cc a 。 【总结升华】本题的立足点是有关物质的量浓度的计算,要注意反应中的定量关系和电荷守 恒的应用。查看更多