- 2021-05-21 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】广东省清远市方圆培训学校2020届高三模拟试题精练(一)(解析版)
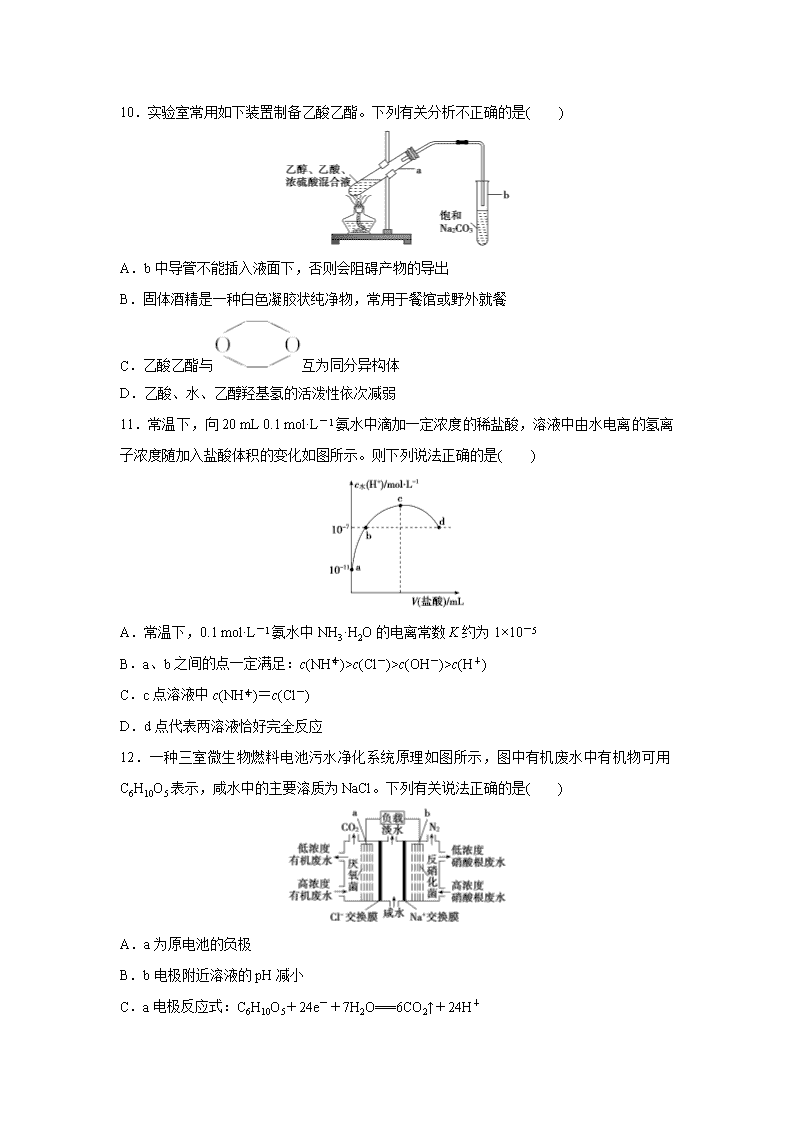
广东省清远市方圆培训学校2020届高三模拟试题精练(一) 一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.下列说法不正确的是( ) A.《本草图经》中“绿矾形似朴硝(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”“色赤”物质是Fe(OH)3 B.《本草纲目》中“黄连”条目下记载:“吐血不止,用黄连一两,捣碎,加鼓二十粒,水煎去渣,温服。”该过程中涉及称量、加热、浸取、过滤等操作 C.蛋白质溶液中加重金属盐溶液,“饮鸩止渴”均是化学变化 D.“固体需匙或纸槽,一送、二竖、三弹弹;块固还是镊子好,一横、二放、三慢竖。”前一个固体一般是指粉末状固体 8.一种新型的合成氨的方法如图所示,下列说法错误的是( ) A.反应①属于“氮的固定” B.反应②属于非氧化还原反应 C.反应③可通过电解LiOH水溶液实现 D.上述三步循环的总结果为2N2+6H2O===4NH3+3O2 9. 厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是( ) A.1 mol NH 所含的质子总数为10NA B.联氨(N2H4)中含有极性键和非极性键 C.过程Ⅱ属于氧化反应,过程IV属于还原反应 D.过程Ⅰ中,参与反应的NH与NH2OH的物质的量之比为1∶1 10.实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是( ) A.b中导管不能插入液面下,否则会阻碍产物的导出 B.固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐 C.乙酸乙酯与互为同分异构体 D.乙酸、水、乙醇羟基氢的活泼性依次减弱 11.常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( ) A.常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5 B.a、b之间的点一定满足:c(NH)>c(Cl-)>c(OH-)>c(H+) C.c点溶液中c(NH)=c(Cl-) D.d点代表两溶液恰好完全反应 12.一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示,咸水中的主要溶质为NaCl。下列有关说法正确的是( ) A.a为原电池的负极 B.b电极附近溶液的pH减小 C.a电极反应式:C6H10O5+24e-+7H2O===6CO2↑+24H+ D.中间室:Na+移向左室,Cl-移向右室 13. 短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物结构如图所示。且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。下列说法正确的是( ) A.YW3的水溶液呈酸性 B.W2Z的稳定性大于YW3 C.YCl3分子中Y原子不是稳定的8电子结构 D.Y元素的氧化物对应的水化物为强酸 二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。) (一)必考题:共43分。 26.(15分)工业上以钛铁矿[主要成分为钛酸亚铁( FeTiO3),含有MgO、SiO2等杂质]为原料,制备金属钛和铁红的工艺流程如下: 已知:①酸浸时, FeTiO3转化为Fe2+和TiO2+;②本实验温度下,Ksp[Mg(OH)2]=1.0×10-11;③溶液中离子浓度小于等于1.0×10-5 mol/L时,认为该离子沉淀完全。 请回答下列问题: (1)酸浸时如何提高浸取速度和浸取率_____________________________________(至少答两种方法)。 (2)“水解”生成H2TiO3的离子方程式为_________________________。 (3)“沉铁”过程中,气态产物的电子式为__________________;该过程需控制反应温度低于35 ℃,原因为___________________________________________________。 (4)滤液3可用于制备Mg(OH)2。若滤液3中c(Mg2+)=1.2×10-3 mo/L,向其中加入NaOH固体,调整溶液pH值大于________时,可使Mg2+沉淀完全。 (5)“电解”时,电解质为熔融的CaO,两电极材料为石墨棒。则_______极石墨棒需要定期更换,原因是__________________________________________________________ ________________________________________________________________________。 (6)测定铁红产品纯度:称取m g铁红,溶于一定量的硫酸之中,配成500.00 mL溶液。从其中量取20.00 mL溶液,加入过量的KI,充分反应后,用 c mol/L硫代硫酸钠(Na2S2O3)标准液滴定至终点,发生反应:I2+2S2O===S4O+2I-。平行滴定三次,硫代硫酸钠平均消耗体积为V mL。则铁红产品的纯度为________(用c、V、m表示)。 27.(14分)硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下: 已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问题: (1)下列操作或描述正确的是 _________。 A.“抽滤洗涤”时,将洗液与溶液Ⅰ合并,有利于提高皓矾的产率 B.溶液Ⅰ中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4 C.重结晶时,需加少量稀盐酸抑制Zn2+水解 D.“洗涤干燥”时,可用95%的酒精作为洗涤剂 (2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的操作顺序补充完整: 在布氏漏斗中加入滤纸→______ →______→______→______→确认抽干。 ①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸 (3)某同学设计了一个实验方案,证明晶体Ⅱ中的杂质Fe3+含量低于晶体Ⅰ ,请把该方案补充完整______________________________________________(填操作), 分别加入2滴稀硝酸和6滴15% KSCN,____________________________________ ________________________________________________________________________(填现象),证明晶体Ⅱ中的杂质含量低于晶体Ⅰ。 (4)某同学称取28.700 g研细的皓矾晶体(0.100 mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100 g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为________________________。 (5)将烟道灰在氧气中高温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________________________________________________________________________ ________________________________________________________________________。 28.(14分)中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0 化学键 H—H C—H C=C C—C E(kJ/mol) a b c d (1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。 图1 图2 (2)T1温度时,向1 L的恒容反应器中充入2 mol CH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1,测得10~15 min时H2的浓度为1.6 mol/L。 ①0~ 10 min内CH4表示的反应速率为____mol/(L·min)。 ②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。 ③15 min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。 (3)实验测得v正=K正c2(CH4),v逆=K逆c(C2H4)·c2(H2)其中K正、K逆为速率常数仅与温度有关,T1温度时K正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是________________________________。 (4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。 ①C极的Pt为______ 极(填“阳”或“阴” )。 ②该电池工作时负极反应方程式为_____________________。 ③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液在25 ℃时pH=_______ (假设电解前后NaCl溶液的体积均为500 mL)。 (二)选考题:共15分。请考生从2道化学题中任选一题作答。如果多做则按所做的第一题计分。 35.【化学——选修3:物质结构与性质】(15分) 化学与生活密切相关。 Ⅰ.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O(橙色)+CH3CH2OH―→Cr3+(绿色)+CH3COOH (未配平) (1)基态Cr 原子的价电子排布图为_________________。 (2)CH3COOH分子中所含元素的电负性由大到小的顺序为____________________________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为_______。 (3)已知Cr3+等过渡元素水合离子的颜色如下表所示: 离子 Sc3+ Cr3+ Fe2+ Zn2+ 水合离子的颜色 无色 绿色 浅绿色 无色 请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为_________________________。 Ⅱ.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。 (4)Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________(填选项字母);溶液中[Zn(OH)Cl2]—的结构式为_____________________。 A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键 Ⅲ.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。 (5)锌的堆积方式为_____________________,配位数为_______。 (6)若锌原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为________g/cm3 (用含a的代数式表示)。 36.【化学——选修5:有机化学基础】(15分) 2018年8月3日我国确诊首例非洲猪瘟疫情。目前某有效药物的主要成分—姜黄素(分子式为C21H20O6)的一种合成路线如图所示。 (1)A的名称为________________;试剂X名称为_______________。 (2)D中含有的官能团名称______________。 (3)反应D→E的化学方程式为____________________________________________________,其反应类型是__________。 (4)下列有关G(C8H8O3)的叙述不正确的是__________(填正确答案编号)。 a.能与NaHCO3溶液反应 b.能与浓溴水发生取代反应 c.能与FeCl3溶液发生显色反应 d.1 mol G最多能与3 mol H2发生加成反应 (5)姜黄素的结构简式为____________________________________。 (6)G(C8H8O3)的同分异构体中,写出符合下列条件的结构简式为__________。 ①苯环上的一取代物只有2种; ②核磁共振氢谱中有4组吸收峰; ③1 mol该物质与烧碱溶液反应,最多消耗3 mol NaOH。 【参考答案】 7.解析:选A A项绿矾是FeSO4·7H2O,绿矾受热分解生成的是氧化铁。 8.解析:选C 反应①中N2由游离态转变为化合态,A项正确;反应②中各元素的化合价均未发生改变(Li3N+3H2O===3LiOH+NH3↑),B项正确;锂是活泼金属,电解LiOH溶液得不到金属锂,C项错误;由题图知转化的原料是N2和H2O,产物为NH3和O2,D项正确。 9.解析:选A。A.质子数等于原子序数,1 mol NH中含有质子总物质的量为11 mol,故A说法错误;B.联氨(N2H4)的结构式为,含有极性键和非极性键,故B说法正确;C.过程Ⅱ,N2H4→N2H2→2H,此反应是氧化反应,过程Ⅳ,NO→NH2OH,添H或去O是还原反应,故C说法正确;D.NH中N显-3价,NH2OH中N显-1价,N2H4中N显-2价,因此过程Ⅰ中NH与NH2OH的物质的量之比为1∶1,故D说法正确。 10.解析:选B。A.饱和碳酸钠溶液可以溶解乙醇,反应消耗乙酸,同时降低乙酸乙酯的溶解度,为防止产生倒吸现象,b中导管不能插入液面下,否则不仅可能会产生倒吸现象,而且还会阻碍产物的导出,A正确;B.固体酒精制作方法如下:将碳酸钙固体放入醋酸(CH3COOH)溶液中,充分反应后生成醋酸钙(CH3COO)2Ca、CO2、H2O,将醋酸钙溶液蒸发至饱和,加入适量酒精冷却后得胶状固体即固体酒精,可见固体酒精是混合物,B错误;C.乙酸乙酯与的分子式都是C4H8O2,二者分子式相同,结构不同,故二者互为同分异构体,C正确;D.乙酸、水、乙醇分子中都含有羟基,电离产生H+的能力:乙酸>水>乙醇,所以羟基氢的活泼性依次减弱,D正确;故选B。 11.解析:选A。A.常温下,0.1 mol·L-1的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=mol/L=0.001 mol/L,Kb===1×10-5,故A正确;B.a、b之间的任意一点,溶液都呈碱性,则c(H+)查看更多