- 2021-05-21 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018中考科学化学计算专项训练
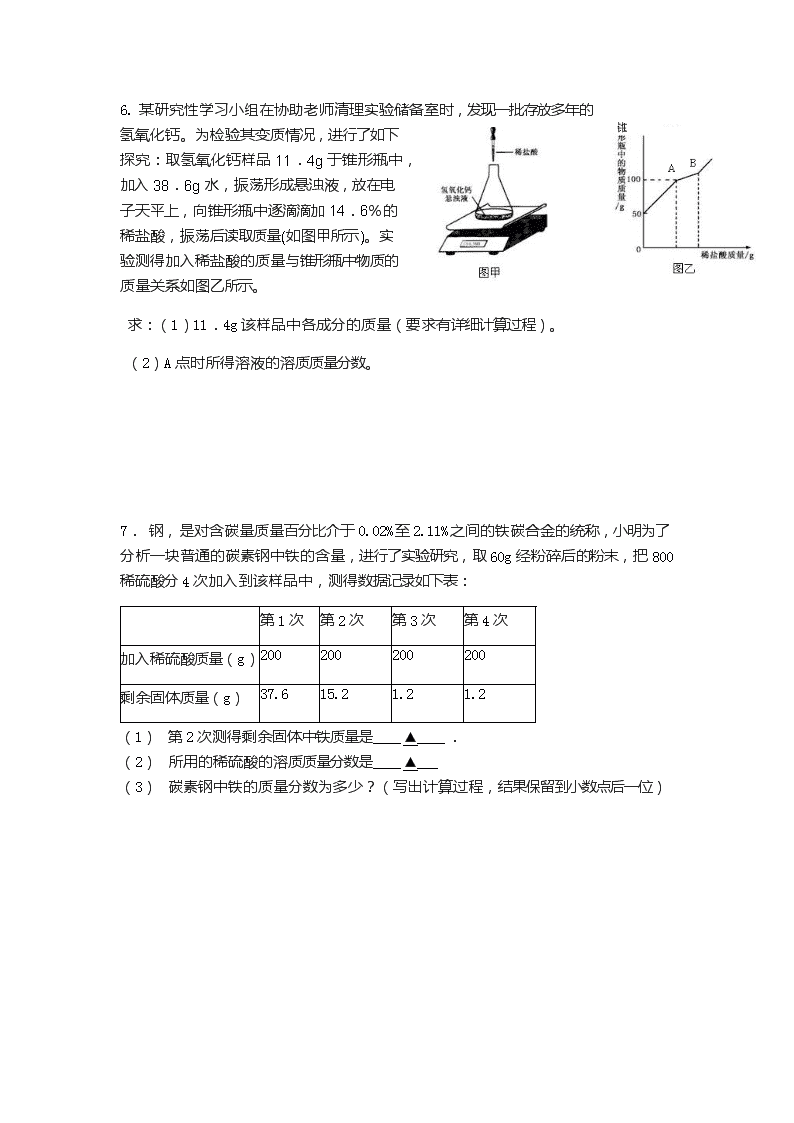
2018中考科学化学计算专项训练 1. 某班同学完成碳酸钙制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取62.44 g该混合溶液于烧杯中,向烧杯中滴入溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如图所示。求:【资料】 (1)所取盐酸和氯化钙混合溶液中HCl的质量; (2)求恰好完全反应时,烧杯内所得溶液的溶质质量分数。 2、某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验室中称取生铁样品10.0g放入烧杯中,加入足量的稀硫酸,加热使之充分反应(杂质不参加反应),然后冷却,称量,反应后烧杯中物质的质量比反应前减少了0.34g。 计算:(1)生铁样品中杂质的质量. (2)求生产100t这种生铁,至少需要含氧化铁80%的赤铁矿的质量多少吨? 3. 某同学取某地石灰石样品25g进行测定实验,现将200g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:试求: 第1次 第2次 第3次 第4次 第5次 加入稀盐酸的质量/g 20 20 20 20 20 生成气体的总质量/g 1.1 2.2 m 4.4 4.4 (1)m的值为 。 (2)石灰石样品中碳酸钙的质量等于 。 (3)所加盐酸的溶质质量分数?(写出计算过程,计算结果精确至0.1) 4.为了测定一瓶未密封保存的NaOH固体中NaOH的质量分数,小金采用沉淀法进行如下操作:①取15克样品于烧杯中,加足量水配成溶液;②在样品溶液中加入足量的BaCl2溶液;③待反应完全后,过滤。有关数据记录如表: 反应前 反应后 烧杯和样品溶液总质量/g 加入的氯化钡溶液质量/g 过滤后烧杯和溶液总质量/g(滤液的损失忽略不计) 95 65 140.3 请回答下列问题: (1)反应共生成沉淀 ▲ 克 (2)原样品中NaOH的质量分数是多少? ▲ 5.某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验: ①取8.5g Fe粉放入一定量的CuSO4中,反应完成后,滤出固体,洗涤、干燥后称量,固体质量为9.2g. ②将9.2g固体与一定质量分数的稀盐酸充分反应,消耗盐酸50.0g,根据实验绘制反应产生氢气的质量与反应时间的关系见图.求: (1)稀盐酸的质量分数、与稀盐酸反应的Fe的质量. (2)与CuSO4反应的Fe的质量. (3)与CuSO4反应的Fe的质量及与盐酸反应的Fe的质量之和__▲__8.5g(选填“>”、“<”或“=”).对此结果作出你的解释___▲___ 6. 某研究性学习小组在协助老师清理实验储备室时,发现一批存放多年的氢氧化钙。为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,振荡后读取质量(如图甲所示)。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图乙所示。 求:(1)11.4g该样品中各成分的质量(要求有详细计算过程)。 (2)A点时所得溶液的溶质质量分数。 7. 钢,是对含碳量质量百分比介于0.02%至2.11%之间的铁碳合金的统称,小明为了分析一块普通的碳素钢中铁的含量,进行了实验研究,取60g经粉碎后的粉末,把800稀硫酸分4次加入到该样品中,测得数据记录如下表: 第1次 第2次 第3次 第4次 加入稀硫酸质量(g) 200 200 200 200 剩余固体质量(g) 37.6 15.2 1.2 1.2 (1) 第2次测得剩余固体中铁质量是____▲____. (2) 所用的稀硫酸的溶质质量分数是____▲___ (3) 碳素钢中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位) 8.某同学用一定质量分数的Na2CO3溶液做“Na2CO3+CaCl2═2NaCl+CaCO3↓”的实验。其五次实验结果如下表所示,根据实验结果回答下列问题: 实验次数 氯化钙的质量/g 碳酸钠溶液的质量/g 碳酸钙的质量/g 1 5.55 200 5 2 11.1 200 10 3 22.2 200 20 4 33.3 250 25 5 44.4 300 X (1)表中X的值是 。 (2)试计算碳酸钠溶液中溶质的质量分数。 9、某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水)。把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如下表所示。 时间/s 0 20 30 40 60 80 100 120 硫酸溶液增 加的质量/g 0 0.7 1.0 1.2 1.5 1.6 1.7 1.7 试回答下列问题: (1)样品中氯化铵的质量分数。 (2)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失)。 10.小明对废弃的易拉罐很有兴趣,为测定易拉罐中铝元素的质量分数,他剪取W克镁铝合金的易拉罐,先用过量稀硫酸溶解,然后再向溶液中滴加一定量的NaOH溶液得到Al(OH)3和Mg(OH)2沉淀,继续滴加NaOH溶液时Al(OH)3被溶解[已知:Al(OH)3与NaOH反应生成NaAlO2和H2O],而Mg(OH)2不溶于NaOH溶液,沉淀质量与滴加NaOH溶液质量关系如图所示。 (1)在a点时,溶液中的溶质有哪些? ▲ (填化学式); (2)易拉罐中铝元素的质量分数为多少?(用字母表示。假定易拉罐只由镁和铝组成) 11.(4分)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。 (1)当催化剂中FeO与Fe2O3的质量比为9∶20时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 ▲ (用小数表示,保留2位小数)。 (2)以Fe2O3为原料制备上述催化剂,可向其中加入适量焦炭,发生如下反应: 要制得480 kg这种活性最高的催化剂,需要焦炭多少千克? 12.(4分)为践行2017年浙江“决战治污水”的五水共治新目标,小金对我市某地工业废水(含有硫酸和盐酸)中的H2SO4 进行测定。取50g该废水于烧杯中,加入足量的BaCl2溶液,充分反应中,过滤、洗涤、干燥得到BaSO4固体11.65g。通过计算回答下列问题: (1)50g该废水中H2SO4 的质量。 (2)若改用KOH溶液来测定50g该废水中H2SO4 的含量,结果会 ▲ (选填“偏高”“偏低”、“不变”),理由是: ▲ 。 13. 工业合成盐酸中通常溶有少量的FeCl3。工业合成盐酸的国家质量标准规定:含铁(以Fe计) 的质量分数>0.01%的产品为不合格产品。某厂质检室对本厂生产的某一批次工业合成盐酸进行质量检验,方法是:取该批次产品l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如右图所示。 请你计算产品中含铁(以Fe计) 的质量分数,及所用NaOH溶液的质量分数。(写出计算过程) 14.学校购买了生石灰放于桶中用来做干燥剂,一段时间后,实验员老师发现块状的生石灰部分变成颗粒状和粉末状,为验证生石灰是否变质,请学生取了少量生石灰样品放于试管中,加水溶解,并加入过量HCl,发现无气泡产生。 (1)为此实验员老师确定生石灰样品中肯定没有 (2)为进一步确定样品的成分,老师沉淀洗涤干燥后称量共10克。试推测样品的组成并通过计算确定样品的纯度。 15.(6分)在一烧杯中盛有35.4g Na2CO3和NaCl 组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:(改编) (1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH ▲ 7(填>、=、<). (2)原混合物中碳酸钠的质量. (3)当滴加稀盐酸至图中B点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数.(计算结果保留一位小数). 参考答案 1、(1)设HCl的质量为x,设生成的KCl的质量为y,设生成的CO2的质量为z。 与HC1反应的K2CO3 质量为10g×13.8% =1.38g 2HCl + K2CO3 = 2KCl + H2O + CO2 ↑ 73 138 149 44 x 1.38g y z 73/x=138/1.38g=149/y=44/z x =0.73g y=1.49g z=0.44g (2)设与CaCl2反应的生成KCl的质量为ag,由图可知生成CaCO3的质量为2g, 与CaCl2反应的K2CO3 质量为20g×13.8% =2.76g K2CO3 + CaCl2 = CaCO3↓+ KCl 138 149 2.76g a 138/2.76g =149/a a =2.98g 2、(1)设生铁样品中杂质的质量为x. Fe+H2SO4=FeSO4+H2↑ 56 2 10.0g-x 0.34g x=0.48g (2)设需要赤铁矿的质量为y. 所得生铁的含铁质量分数为×100%=95.2% Fe2O3+3CO 2Fe+3CO2 160 112 y×80% 100t×95.2% 160/(y×80%)=112/(100t×95.2%) 解得y=170t 3、(1)3.3;(2)10;(3)3.7%. 4、5、 6、(1)氢氧化钙7.4g;碳酸钙有4g;(2)11.6% 7、(1) 14g (2) 19.6% (3) Fe%=(60g-1.2g)/60=98% 8、35. (4分)40 10.6% 9、(1)89.1% (2)解:设样品中NH4Cl的质量为x,生成的氯化钠质量为y。 NH4Cl+NaOH==NaCl+H2O+NH3↑ 53.5 58.5 17 x y 1.7g x=5.35g y=5.85g 反应后溶液质量=5.35g+18g+7.6g-1.7g=29.25g 则氯化钠溶液的溶质质量分数=5.85g/29.25g×100%=20% 答: 氯化钠溶液的溶质质量分数为20%. 10、(1) Al2(SO4)3 MgSO4 Na2SO4 (2)(100-1200m2/29w)% 11. 解:(1) 0.72 (2)设反应生成FeO的质量为x,消耗Fe2O3的质量为y,需要加入碳的质量为z 高温 2Fe2O3 + C ===== 4FeO + CO2↑ 320 12 288 y z x 320/y=288/x y=320x/288 12/z=288/x Z=12x/288 x/(480g – 320x/288) = 9:20 x=144g 则应加入碳的质量=144g×12/288=6g 答:(2)应向480gFe2O3粉末中加入碳6克。 12、 (2)偏高(1分);废水中的盐酸也会与氢氧化钾发生反应 13.(4分)解:(1)由图可知,生成Fe(OH)3沉淀的质量为1.07g,含铁: 所以盐酸中含铁的质量分数为: (2)设与FeCl3反应的氢氧化钠质量为x, FeCl3 + 3NaOH Fe(OH)3↓ + 3NaCl 120 107 x 1.07g 120 :107= x :1.07g ∴ x=1.2g 与FeCl3反应的NaOH溶液的质量为:181g﹣175g=6g 。 NaOH溶液的溶质质量分数为: (2分) 14.(4分)解:(1)碳酸钙(CaCO3) (2)氧化钙和氢氧化钙混合物 解:设与Na2CO3 反应的Ca(OH)2质量为x,原样品中CaO质量为y Na2CO3+Ca(OH)2===2NaOH+CaCO3↓ 74 100 x 10g 74:x==100:10g 解得x=7.4g CaO+ H2O=== Ca(OH)2 56 74 y 74y/56 74y/56+(6.5g-y)=7.4g 解得y=2.8g 则原样品中纯度是2.8 g÷6.5 g=43.1% 15.(1)< (2)10.6g (3)20.6% 【解析】(2)(3)据稀盐酸的质量,根据化学方程式进行计算; 故答案为:73g10%的稀盐酸中含HCl的质量是:73g×10%=7.3g,设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,生成的二氧化碳的质量为z. Na2CO3+2HCl═2NaCl+CO2↑+H2O 106 73 117 44 x 7.3g y z =,x=10.6g =,y=11.7g =,z=4.4g 原混合物中碳酸钠的质量为10.6g. 杯里不饱和溶液中溶质的质量为:11.7g+(35.4g﹣10.6g)=36.5g 烧杯里不饱和溶液的质量为:8.4g+146g﹣4.4g=177g 烧杯里不饱和溶液中溶质的质量分数为:36.5/177×100%=20.6%查看更多