- 2021-05-21 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第二章化学反应与能量第三节化学反应的速率和限度第2课时学案新人教版必修21
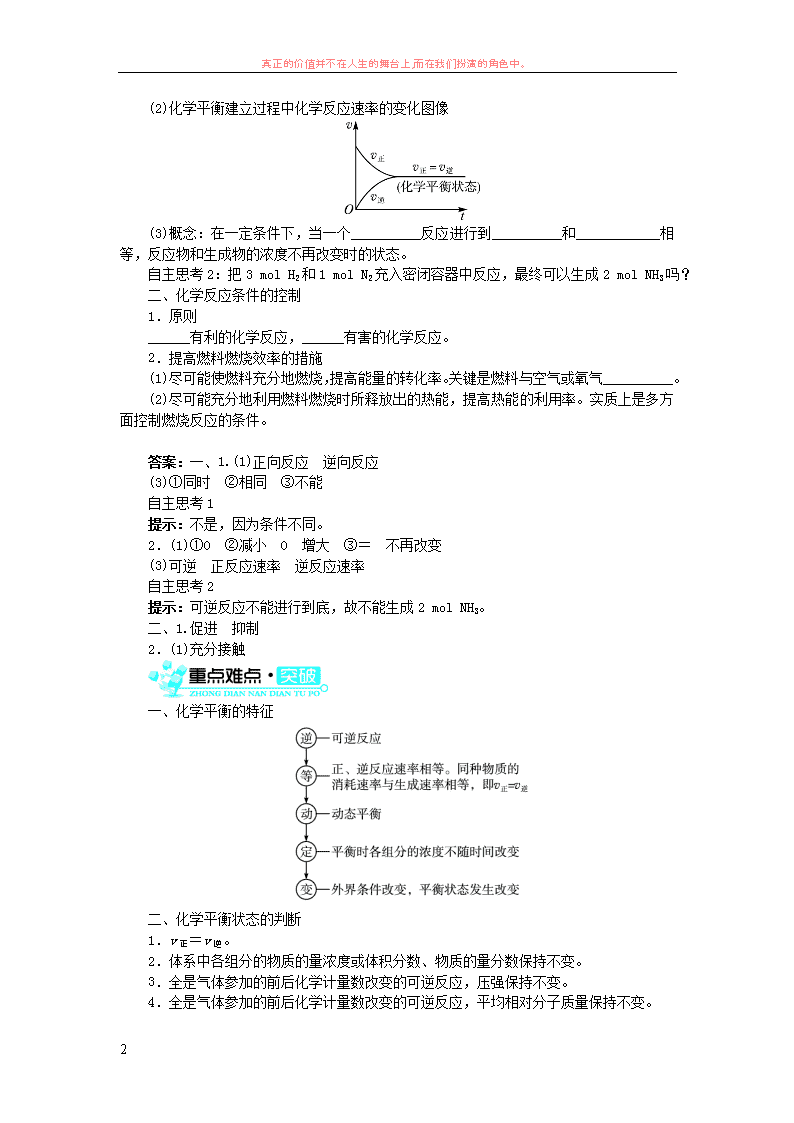
真正的价值并不在人生的舞台上,而在我们扮演的角色中。 1 第三节 化学反应的速率和限度(第 2 课时) 内容标准 活动与探究建议 1.了解可逆反应以及化学反应的限度。 2.知道控制反应条件的意义以及相应的措施。 设计实验:证明某些化学反应的可逆性。 在火灾现场人的呼吸存在下述反应:CO+Hb·O2 O2+Hb·CO(血液中的血红蛋白用 Hb 表示),实验表明,Hb·CO 即使只有 Hb·O2 的 2%,就足以使人的智力受损。当空气中的 CO 浓度较大时,人体就会感到缺氧,胸闷。而当过多的血红蛋白与一氧化碳结合时,人就 会因窒息而引起死亡。 火灾逃生演练 为什么在逃生和自救时应迅速有序地离开火灾现场,到通风较好的地方或吸氧呢? 提示:通风较好的地方或吸氧有利于上述反应逆向移动。 一、化学反应的限度 1.可逆反应 (1)定义:在同一条件下,__________和__________能同时进行的化学反应。 (2)表示方法:书写可逆反应的化学方程式时不用“===”而用“ ”。 (3)特点: ①正向反应和逆向反应______进行; ②正向反应和逆向反应的条件______; ③在一定条件下,反应物______全部转化为生成物。 自主思考 1:2H2+O2 2H2O 与 2H2O 2H2↑+O2↑属于可逆反应吗? 2.化学平衡状态——化学平衡 (1)化学平衡的建立 ①反应开始时,v 正最大,v 逆为____。 ②反应过程中:反应物浓度逐渐减少―→v 正逐渐____,生成物浓度逐渐增大―→v 逆从 ____开始逐渐______。 ③反应达到平衡时:v 正____v 逆,反应物和生成物各组分浓度__________。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 2 (2)化学平衡建立过程中化学反应速率的变化图像 (3)概念:在一定条件下,当一个__________反应进行到__________和____________相 等,反应物和生成物的浓度不再改变时的状态。 自主思考 2:把 3 mol H2 和 1 mol N2 充入密闭容器中反应,最终可以生成 2 mol NH3 吗? 二、化学反应条件的控制 1.原则 ______有利的化学反应,______有害的化学反应。 2.提高燃料燃烧效率的措施 (1)尽可能使燃料充分地燃烧,提高能量的转化率。关键是燃料与空气或氧气 __________。 (2)尽可能充分地利用燃料燃烧时所释放出的热能,提高热能的利用率。实质上是多方 面控制燃烧反应的条件。 答案:一、1.(1)正向反应 逆向反应 (3)①同时 ②相同 ③不能 自主思考 1 提示:不是,因为条件不同。 2.(1)①0 ②减小 0 增大 ③= 不再改变 (3)可逆 正反应速率 逆反应速率 自主思考 2 提示:可逆反应不能进行到底,故不能生成 2 mol NH3。 二、1.促进 抑制 2.(1)充分接触 一、化学平衡的特征 二、化学平衡状态的判断 1.v 正=v 逆。 2.体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。 3.全是气体参加的前后化学计量数改变的可逆反应,压强保持不变。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 3 4.全是气体参加的前后化学计量数改变的可逆反应,平均相对分子质量保持不变。 5.对于有颜色的物质参加或生成的可逆反应,颜色不随时间发生变化。 6.对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。 知识点 1 可逆反应 【例题 1】 下列各组反应中,不属于可逆反应的是( )。 A.N2+3H2 2NH3 和 2NH3 N2+3H2 B.H2+I2 2HI 和 2HI H2+I2 C.2H2+O2 2H2O 和 2H2O 2H2↑+O2↑ D.2SO2+O2 2SO3 和 2SO3 2SO2+O2 解析:根据可逆反应的定义,在相同条件下,既能向正反应方向进行,又能向逆反应方 向进行的反应叫做可逆反应。所以,C 中的反应不是可逆反应。 答案:C 点拨:判断依据看反应是否是在相同的条件下进行的。 知识点 2 化学反应限度及化学平衡的特征 【例题 2】 对于化学反应限度的叙述,错误的是( )。 A.任何可逆反应都有一定的限度 B.化学反应达到限度时,正逆反应速率相等 C.化学反应的限度与时间的长短无关 D.化学反应的限度是不可改变的 解析:任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时 v 正=v 逆。对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时 间长短无关,但当外界条件发生改变,引起 v 正与 v 逆不相等时,化学平衡被破坏,化学反应 的限度也会发生改变。 答案:D 点拨:(1)任何可逆反应在给定条件下的进程都有一定的限度。 (2)一定条件下,可逆反应达到化学平衡时,该反应即达到最大限度,此时反应物的转 化率达最大值。 知识点 3 化学平衡状态的判断 【例题 3】在一个不传热的固定容积的密闭容器中,可逆反应 mA(g)+nB(g) pC(g) +qD(g),当 m、n、p、q 为任意整数时,达到平衡的标志是( )。 ①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组 分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时 间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应 A.③④⑤⑥ B.②③④⑥ C.①③④⑤ D.①③④⑥ 解析:判断化学平衡的根本标志是 v 正=v 逆,⑥中 m mol A 断键,则同时生成 p mol C, 而 p mol C 也发生断键反应,因此对 C 而言 v 正=v 逆,⑥正确;而⑤中未指明反应速率表示 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 4 的方向,无论反应是否处于平衡状态均存在该关系,错误;平衡状态的直接标志是各组分的 浓度不再改变,则各组分的质量分数不再改变,③④正确;间接标志是体系的温度不再改变, 故②正确。但因(m+n)与(p+q)的相对大小不确定,故①无法确定。若 m+n=p+q,则压 强始终不变化,此情况下无法说明反应是否平衡,故①错误。因此选 B。 答案:B 点拨:(1)因未仔细审题,即未读懂“不传热的密闭容器”而错误地认为体系的温度始 终不变化而不选②。 (2)片面地认为 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q(即反应速率之比等于化学计量 数之比)就是 v 正=v 逆,忽视了反应的方向问题,从而错选⑤,而导致本题错选 A。 1.下列关于化学反应限度的说法中正确的是( )。 A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零 C.平衡状态时,各物质的浓度保持相等 D.化学反应的限度不可以通过改变条件而改变 2.一定温度下,可逆反应:A(g)+3B(g) 2C(g)达到限度的标志是( )。 A.C 的生成速率与 A 的消耗速率相等 B.单位时间生成 n mol A,同时生成 3n mol B C.A、B、C 的浓度不再变化 D.A、B、C 的分子数之比为 1∶3∶2 3.下列措施,能使煤炭燃烧更充分,提高热能利用率的是( )。 A.多加煤以使炉火更旺 B.把煤炭做成大煤球 C.在煤中掺和一些黄泥做成蜂窝煤 D.把煤粉碎,在煤粉燃烧器中燃烧 4.可逆反应 N2+3H2 一定条件 2NH3 的正、逆反应速率可用各反应物或生成物浓度的变 化来表示。下列各关系中能说明反应已达到平衡状态的是( )。 A.3v 正(N2)=v 正(H2) B.v 正(N2)=v 逆(NH3) C.2v 正(H2)=3v 逆(NH3) D.v 正(N2)=3v 逆(H2) 5.在已达到平衡的可逆反应 2SO2+O2 一定条件 2SO3 中,充入由 18O 构成的氧气一段时 间后,18O 存在于下列物质中的( )。 A.多余的氧气中 B.生成的三氧化硫中 C.氧气和二氧化硫中 D.二氧化硫、氧气和三氧化硫中 6.在 200 ℃时,将 a mol H2(g)和 b mol I2(g)充入到体积为 V L 的密闭容器中,发生 反应:I2(g)+H2(g) 一定条件 2HI(g)。 (1)反应刚开始时,由于 c(H2)=____________,c(I2)=______。而 c(HI)=______,所 以化学反应速率______最大,而________最小(为 0)。 (2) 随 着 反 应 的 进 行 , 反 应 混 合 物 中 各 组 分 浓 度 的 变 化 趋 势 为 c(H2)______ , c(I2)________,而 c(HI)______,从而化学反应速率 v 正__________,而 v 逆________。 (3)当反应进行到 v 正与 v 逆______时,此可逆反应达到了最大限度。若保持外界条件不 变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率 和生成物的产率都将________。 真正的价值并不在人生的舞台上,而在我们扮演的角色中。 5 答案:1.A 平衡状态就是一个可逆反应在该条件下所能达到的最大限度,A 正确;反 应达到平衡时,v 正=v 逆≠0,各物质浓度保持不变但不一定相等,且当外界条件发生改变时, 这种状态也会发生改变,B、C、D 错误。 2.C A 项中 C 的生成速率和 A 的消耗速率不可能相等;B 项中均表示的是逆反应速率, 没有说明 v 正、v 逆是否相等,因此不能确定是否处于平衡状态;C 项中表示各物质的浓度保 持不变,即“定”,表明化学反应已达到平衡状态;D 项中平衡时,A、B、C 的分子数之比 与化学计量数之比没有必然关系,不一定相等或成比例,关键是能否保持不变。 3.D A 项中只会增加煤的用量,不会使煤炭燃烧充分,也不能提高热能的利用率;B、 C 项无论从煤的粉碎程度,还是空气用量上都比不上 D 项。 4.C 达到化学平衡状态,正、逆反应速率相等,用氨气、氢气、氮气表示化学反应速 率之比等于它们的化学计量数之比。结合这两个条件,可以得出正确选项是 C。 5.D 化学平衡是动态平衡,18O2 会与二氧化硫结合生成含 18O 的三氧化硫,同时含 18O 的三氧化硫又会分解得到二氧化硫和氧气,使二氧化硫、氧气中也含有 18O,因此 18O 存在于 二氧化硫、氧气、三氧化硫这三种物质中。 6.答案:(1) a V mol·L-1 b V mol·L-1 0 v 正 v 逆 (2)减小 减小 增大 减小 增大 (3)相等 保持不变 解析:本题主要考查化学平衡建立的过程,开始时,c(H2)和 c(I2)为最大值,正反应速 率最大,由于此时没有 HI,逆反应速率最小,为 0,随着反应的进行,c(H2)和 c(I2)越来越 小,正反应速率越来越小,逆反应速率逐渐变大,直到平衡,v 正=v 逆。查看更多