2020届高考化学一轮复习原子结构与性质作业(5)
核心素养提升练 三十五
原子结构与性质
(25分钟 50分)
一、选择题(本题包括5小题,每题4分,共20分)
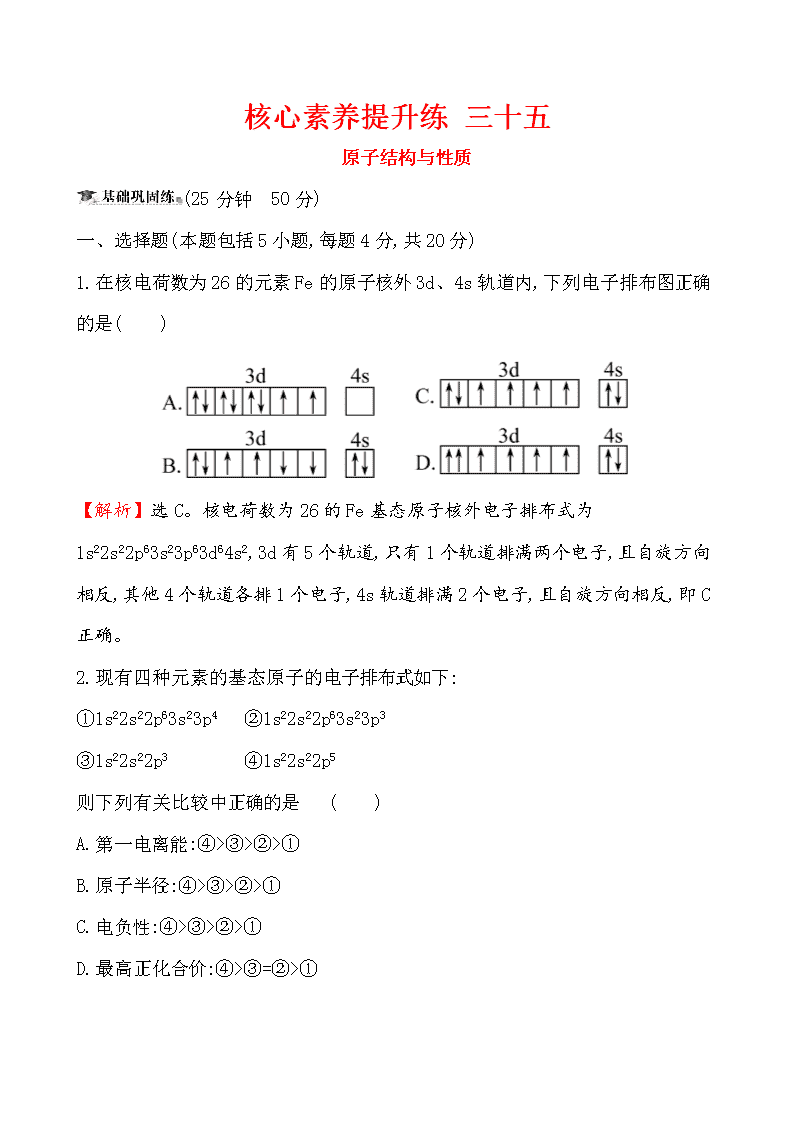
1.在核电荷数为26的元素Fe的原子核外3d、4s轨道内,下列电子排布图正确的是( )
【解析】选C。核电荷数为26的Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,3d有5个轨道,只有1个轨道排满两个电子,且自旋方向相反,其他4个轨道各排1个电子,4s轨道排满2个电子,且自旋方向相反,即C正确。
2.现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3
③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
【解析】选A。①~④四种元素分别为S、P、N、F,第一电离能F>N、P>S,又由于第一电离能N>P,A正确;原子半径N>F,B错误;电负性应S>P,即①>②,C错误;F无正化合价,N、S、P最高正化合价分别为+5、+6、+5价,故应为①>③=②,D错误。
3.如图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是 ( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
【解析】选B。对于第3周期11~17号元素,随着原子序数的增大,第一电离能呈现增大的趋势,但Mg、P特殊,A错误;原子半径逐渐减小,C错误;形成基态离子转移的电子数依次为Na为1,Mg为2,Al为3,Si不易形成离子,P为3,S为2,Cl为1,D错误。
4.下列有关电子排布图的表述正确的是 ( )
A.可表示单核10电子粒子基态时电子排布
B.此图错误,违背了泡利原理
C.表示基态N原子的价电子排布
D.表示处于激发态的B的电子排布图
【解析】选A。A.单核10电子粒子基态时电子排布式为1s22s22p6,每个轨道内排布2个电子,自旋方向相反,正确;B.此图违背了洪特规则,错误;C.正确的价电子排布图为,错误;D.该电子排布图中的电子没有激发跃迁到能量更高的轨道上,错误。
5.周期表中27号元素钴的方格中注明“3d74s2”,由此可以推断 ( )
A.它位于周期表的第4周期ⅡA族
B.它的基态核外电子排布式可简写为[Ar]4s2
C.Co2+的核外价电子排布式为3d54s2
D.Co位于周期表中第9列
【解析】选D。从左向右数,应为过渡元素,A项错误;“3d74s2”为Co的价电子排布,其简写式中也要注明3d轨道,B项错误;失电子时,应失去最外层的电子,即先失去4s上的电子,Co2+的价电子排布为3d7,C项错误;“7+2=9”,说明它位于周期表的第9列,D项正确。
二、非选择题(本题包括2小题,共30分)
6.(14分)已知X、Y、Z、W、Q、R、E七种元素中,原子序数X
”“<”或“=”)
【解析】A、B、C、D、E 5种元素核电荷数都小于20,A、E同主族且最外层电子排布式为ns1,故为ⅠA族,而A为非金属元素,则A为H;B、D同主族,其原子最外层的p能级电子数是s能级电子数的两倍,故其最外层电子排布式为ns2np4,为ⅥA族元素,B核电荷数小于D,则B为O,D为S,E为K;C原子最外层上的电子数为硫原子最外层上电子数的一半,则C为Al。同主族元素自上而下电负性逐渐减小,故B(O)的电负性大于D(S),E(K)的第一电离能小于Na,Na的第一电离能小于C(Al),故第一电离能Al>K。
答案:(1)H O Al S K(写元素名称也可)
(2)KAl(SO4)2·12H2O 作净水剂
(3)1s22s22p63s23p1 (4) (5)> >
(30分钟 50分)
一、选择题(本题包括3小题,每题6分,共18分)
1.下列说法中正确的是 ( )
A.第3周期所包含的元素中钠的原子半径最小
B.钠的第一电离能比镁的第一电离能大
C.在所有元素中,氟的电负性最大
D.电子云示意图中的每个小黑点都表示一个电子
【解析】选C。同一周期,从左到右,原子半径逐渐减小,第3周期所包含的元素中钠的原子半径最大,A错误;同一周期,从左到右,虽然有个别特殊,但总体上元素第一电离能是逐渐增大的,钠的第一电离能比镁的第一电离能小,B错误;电负性就是以氟作为标准的,氟的电负性最大,C正确;电子云示意图中的小黑点表示电子出现在核外空间中的概率,D错误。
2.下列各组原子中,彼此化学性质一定相似的是 ( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子
D.最外层都只有一个电子的X、Y原子
【解析】选C。原子核外电子排布式为1s2的X原子是He,原子核外电子排布式为1s22s2的Y原子是Be,二者的性质不同,A错误;原子核外M层上仅有两个电子的X原子是Mg,原子核外N层上仅有两个电子的Y原子不一定是Ca,还可以为副族元素,二者的性质不一定相似,B错误;2p轨道上只有2个电子的X原子与3p轨道上只有2个电子的Y原子分别是ⅣA族的C和Si,性质相似,C正确;最外层都只有一个电子的X、Y原子可以是H和Na等,性质不同,D错误。
3.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是 ( )
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径小于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
【解析】选C。根据题意,Z元素为Mg,Y元素原子最外电子层电子排布为ns2np2,是C或Si,X为N或O,W为Al或Cl,氮的氢化物的水溶液显碱性,
但氧的氢化物的水溶液显中性或弱酸性,A错误; 的半径比Mg2+小,B错误;氮气、氧气均能与镁反应,C正确;CO2形成的晶体熔、沸点低,D错误。
二、非选择题(本题包括3小题,共32分)
4.(10分)(新题预测)A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第4周期元素,F还是前四周期中电负性最小的元素。
已知:A原子的核外电子数与电子层数相等;B元素原子的核外p电子数比s电子数少1个;C原子的第一至第四电离能为I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=
7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D原子核外所有p轨道均为全充满或半充满;E元素的族序数与周期序数的差为4。
(1)写出E元素在周期表中的位置:________;D元素的原子的核外电子排布式为________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为。该同学所画的轨道式违背了________。
(3)已知BA5为离子化合物,写出其电子式:________________。
【解析】(1)由题意分析知F为K,A为H,B为N;由电离能知C的常见化合价为+2价,为Mg,D为P,E为Cl。
(2)原子的核外电子分能级排布,按构造原理先排能量低的能级,再排能量高的能级,遵循能量最低原理时,该原子才最稳定。该同学未排满3s能级就排3p能级,违背了能量最低原理。
(3)NH5为离子化合物,则为铵盐,存在N和H-。
答案:(1)第3周期ⅦA族 1s22s22p63s23p3
(2)能量最低原理
5.(10分)(1)C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第________周期第________族。
②N的基态原子核外电子排布式为________;Cu的基态原子最外层有________个电子。
③用“>”或“<”填空:
原子半径
电负性
熔点
沸点
Al____Si
N____O
金刚石__
晶体硅
CH4__
SiH4
(2)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能
I1
I2
I3
I4
……
In/(kJ·mol-1)
578
1 817
2 745
11 578
……
则该元素是________(填写元素符号)。
②基态锗(Ge)原子的电子排布式是________。Ge的最高价氯化物的分子式是________。
③锗元素可能的性质或应用有________。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
【解析】(1)①Si是14号元素,位于元素周期表中第3周期ⅣA族。②N是7号元素,其基态原子核外电子排布式为1s22s22p3;Cu是29号元素,其基态原子核外电子排布式为1s22s22p63s23p63d104s1,故最外层有1个电子。③同周期元素,原子序数越大,原子半径越小,故原子半径:Al>Si;同周期元素,原子序数越大,电负性越强,故电负性:NSi—Si,故熔点:金刚石>晶体硅;CH4和SiH4都是分子晶体,且两者结构相似,SiH4的相对分子质量大,故沸点:CH4 < > <
(2)①Al ②1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2 GeCl4 ③C、D
6.(12分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)元素p为26号元素,请写出其基态原子的电子排布式________。
(2)d与a反应的产物的分子中,中心原子的杂化形式为________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: ________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素
o
p
电离能/
(kJ·mol-1)
I1
717
759
I2
1 509
1 561
I3
3 248
2 957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是________________________。
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________(填图中的序号)。
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________(填元素符号)。
【解析】(1)26号为铁元素,其基态原子的电子排布式为1s22s22p63s23p63d64s2。
(2)d为氮元素,a为氢元素,二者反应的产物为NH3,中心原子氮原子的价层电子对数为=4,所以氮原子的杂化形式为sp3。
(3)h为镁元素,Mg单质在空气中燃烧发出耀眼的白光,原因是电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量。
(4)o元素为Mn,其基态原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的基态离子的电子排布式为1s22s22p63s23p63d5,其3d能级为半充满结构,相对比较稳定,当其失去第三个电子时比较困难,而p2+的基态离子的电子排布式为1s22s22p63s23p63d6,其3d能级再失去一个电子即为半充满结构,形成相对比较稳定的结构,故其失去第三个电子比较容易。
(5)第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氯、氩为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。
(6)由图可知,该元素的电离能I4 远大于I3,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
答案:(1)1s22s22p63s23p63d64s2 (2)sp3
(3)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量
(4)Mn2+的3d轨道电子排布为半满状态,比较稳定
(5)2 (6)Al
关闭Word文档返回原板块