- 2021-05-21 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习专题十八实验方案设计与评价作业
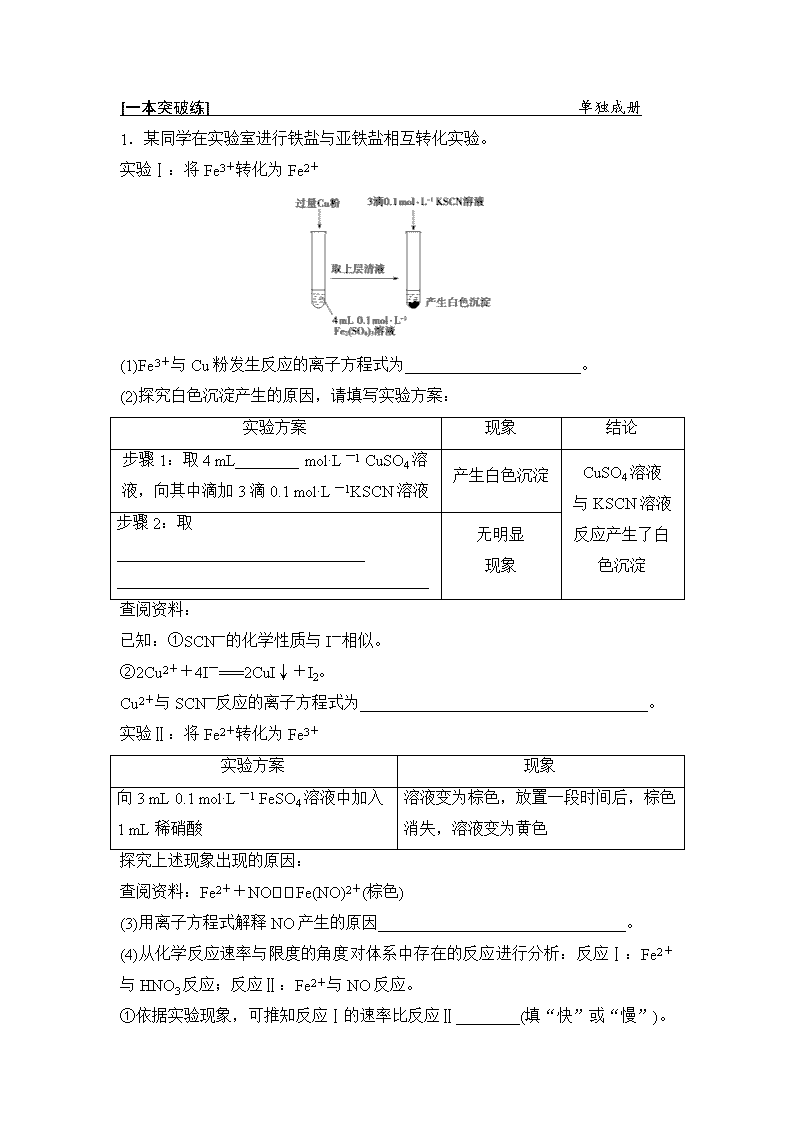
[一本突破练] 单独成册 1.某同学在实验室进行铁盐与亚铁盐相互转化实验。 实验Ⅰ:将Fe3+转化为Fe2+ (1)Fe3+与Cu粉发生反应的离子方程式为______________________。 (2)探究白色沉淀产生的原因,请填写实验方案: 实验方案 现象 结论 步骤1:取4 mL________ mol·L-1 CuSO4溶液,向其中滴加3滴0.1 mol·L-1KSCN溶液 产生白色沉淀 CuSO4溶液 与KSCN溶液反应产生了白色沉淀 步骤2:取_______________________________ _______________________________________ 无明显 现象 查阅资料: 已知:①SCN-的化学性质与I-相似。 ②2Cu2++4I-===2CuI↓+I2。 Cu2+与SCN-反应的离子方程式为____________________________________。 实验Ⅱ:将Fe2+转化为Fe3+ 实验方案 现象 向3 mL 0.1 mol·L-1 FeSO4溶液中加入 1 mL稀硝酸 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 探究上述现象出现的原因: 查阅资料:Fe2++NOFe(NO)2+(棕色) (3)用离子方程式解释NO产生的原因_______________________________。 (4)从化学反应速率与限度的角度对体系中存在的反应进行分析:反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应。 ①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ________(填“快”或“慢”)。 ②反应Ⅰ是一个不可逆反应,设计实验方案加以证明 ____________________________________________________________________ ____________________________________________________________________。 ③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________。 解析:(1)Fe3+与Cu粉发生反应生成Fe2+和Cu2+,反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。(2)由反应2Fe3++Cu===2Fe2++Cu2+,可知题图得到的溶液中Fe2+为0.2 mol·L-1、Cu2+为0.1 mol·L-1,分别取0.1 mol·L-1的CuSO4溶液、0.2 mol·L-1的FeSO4溶液,滴入KSCN溶液进行对照实验,故步骤1:取 4 mL 0.1 mol·L-1 CuSO4溶液,向其中滴加3滴0.1 mol·L-1 KSCN溶液;步骤2:取4 mL 0.2 mol·L-1 FeSO4溶液,向其中滴加3滴0.1 mol·L-1 KSCN溶液。由题目已知信息①、②可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应的离子方程式为:2Cu2++4SCN-===2CuSCN↓+(SCN)2。(3)Fe2+具有还原性,酸性条件下NO具有强氧化性,两者反应生成Fe3+、NO与水,反应的离子方程式为:3Fe2++4H++NO===3Fe3++NO↑+2H2O。(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,故反应Ⅰ的速率比反应Ⅱ的慢。②若反应Ⅰ是一个可逆反应,则反应Ⅰ结束后溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取少量反应Ⅰ的溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应Ⅰ是不可逆反应。③Fe2+被硝酸氧化为Fe3+,溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色。 答案:(1)2Fe3++Cu===2Fe2++Cu2+ (2)0.1 4 mL 0.2 mol·L-1 FeSO4溶液,向其中滴加3滴0.1 mol·L-1 KSCN溶液 2Cu2++4SCN-===2CuSCN↓+(SCN)2 (3)3Fe2++4H++NO===3Fe3++NO↑+2H2O (4)①慢 ②取少量反应Ⅰ的溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应Ⅰ是一个不可逆反应 ③Fe2+被硝酸氧化为Fe3+,溶液中Fe2+浓度降低,导致平衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色 2.(2018·福州模拟 )蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。 Ⅰ.确定该蛋白质中的某些组成元素 (1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_________________________________________________________ ________________________________________________________________。 (2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。 ①装置B中的试剂是____________。 ②装置D的作用是_____________________________________________。 ③当装置B、C、E、F依次出现下列现象:______________________,品红溶液褪色,____________,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。 结论:该蛋白质中含碳、氢、硫、氮等元素。 Ⅱ.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。 已知:2S2O+I2===S4O+2I-。 (3)写出二氧化硫与碘水反应的化学方程式:________________________。 (4)测定终点的现象为______________________________。 (5)取蛋白质样品m g进行测定,采用C1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘水时消耗C2 mol·L-1硫代硫酸钠溶液V2 mL。该蛋白质中的硫元素的质量分数为______________。 (6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值________(填“偏大”“偏小”或“无影响”)。 解析:(1)证明铵盐存在,一般通过将铵盐转化为NH3进行验证,实验操作:注入氢氧化钠溶液,加热,生成能使湿润的红色石蕊试纸变蓝的气体。(2)①装置B的作用是检验蛋白质的燃烧产物中含有H2O,装置B盛放的试剂为无水硫酸铜。 ②装置C的作用是检验SO2,装置D的作用是除去SO2,避免对CO2的检验产生干扰,装置E的作用是检验SO2是否除尽,装置F的作用是检验CO2。③证明燃烧产物中含有H2O的现象为装置B中白色粉末变为蓝色;证明含有SO2的现象为装置C中品红溶液褪色;证明含有CO2的现象是装置E中品红不褪色,装置F中出现白色浑浊。(3)SO2与I2发生反应,SO2被氧化为H2SO4,I2被还原为HI,化学方程式为:I2+SO2+2H2O===H2SO4+2HI。(4)淀粉遇碘单质变蓝色,达滴定终点时,I2转化为I-,则现象为滴入最后一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色。(5)根据I2+SO2+2H2O===H2SO4+2HI、2S2O+I2===S4O+2I-,得n(I2)=n(SO2)+n(Na2S2O3),故n(SO2)=n(I2)-n(Na2S2O3)=C1V1×10-3 mol-0.5C2V2×10-3mol=(C1V1-0.5C2V2)×10-3mol,则该蛋白质中的硫元素的质量分数为(C1V1-0.5C2V2)×10-3 mol×32 g·mol-1÷m g×100%=%。(6)若燃烧时过量氧气进入吸收液中,会发生反应:2SO2+O2+2H2O===2H2SO4,导致硫元素的质量分数测定值偏小。 答案:(1)注入氢氧化钠溶液,加热,生成能使湿润的红色石蕊试纸变蓝的气体 (2)①无水硫酸铜 ②除去SO2,避免对CO2的检验造成干扰 ③粉末由白色变为蓝色 不褪色(或仍显红色) (3)I2+SO2+2H2O===H2SO4+2HI (4)当滴入最后一滴Na2S2O3溶液后,溶液的蓝色褪去,且半分钟内不恢复原色 (5)% (6)偏小 3.某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。 实验Ⅰ 制取氯酸钾、次氯酸钠和氯水 (1)写出装置A实验室制取Cl2的化学方程式:________________________。 (2)实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程中需要的玻璃仪器有胶头滴管、烧杯、________、________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是________________________。 (3)装置C中反应需要在冰水浴中进行,其原因是_____________________。 (4)装置D中的实验现象是溶液先变红后褪色,最后又变为________色。 实验Ⅱ 尾气处理 实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。 (5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响) ①提出合理假设。 假设1:只存在SO; 假设2:既不存在SO,也不存在ClO-; 假设3:______________________________________。 ②设计实验方案,进行实验。请在下表中写出实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1 NaOH溶液、0.01 mol·L-1酸性KMnO4溶液、KI淀粉溶液。 实验步骤 预期现象和结论 步骤1:取少量吸收液分别置于A、B试管中 步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 a.若溶液褪色,则假设1成立; b.若溶液不褪色,则假设2或3成立 步骤3:___________________________________ ___________________________________________________________________________________ 答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)漏斗 玻璃棒 在A和B之间添加盛有饱和NaCl的洗气装置 (3)温度升高会生成氯酸钠 (4)黄绿色 (5)①只存在ClO- ②向B试管中滴加KI淀粉溶液 a.若溶液变蓝,则假设3成立;b.若溶液不变蓝,结合步骤2中的b则假设2成立 4.已知硫酸亚铁铵 [(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)可溶于水,在100~110℃时分解。为探究其化学性质,甲、乙两同学设计了如下实验。 Ⅰ.探究莫尔盐晶体加热时的分解产物。 (1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是____________,由此可知分解产物中有________。 (2)乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。 ①乙同学的实验中,装置依次连接的合理顺序:A→H→(______)→(______)→E→G。 ②证明含有SO3的实验现象是_________________________________; 安全瓶H的作用是_________________________________________________。 Ⅱ.为测定硫酸亚铁铵纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。{已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]的相对分子质量为392} 甲方案:取25.00 mL样品溶液用0.100 0 mol·L-1的酸性K2Cr2O7溶液分三次进行滴定。 乙方案:(通过NH测定)实验设计装置如下图所示。 取25.00 mL样品溶液进行该实验。 请回答: (1)甲方案中的离子方程式:______________________________。 (2)乙方案中量气管中最佳试剂是________(填字母)。 A.水 B.饱和NaHCO3溶液 C.CCl4 (3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是__________。 (4)若测得NH3(已折算为标准状况下)为V L,则硫酸亚铁铵纯度为_____________。 答案:Ⅰ.(1)溶液变红 NH3 (2)①F D ②F中出现白色沉淀 防倒吸 Ⅱ.(1)Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O (2)C (3)上下移动量气管(滴定管),使左右两边液面相平 (4)×100%(或×100%)查看更多