湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题
2019年下学期高二期中大联考
化学题卷
相对原子质量:H-1,C-12,N-14,O-16,Na-23,S—32
一、选择题(本题共18小题,每小题3分,共54分。在每小题列出的四个选项中,只有一项符合题目要求,请将答案填在答题卡上。)
1.下列说法中,不正确的是( )
A.用10mL量简量取9.2 mL NaCl溶液
B.用干燥的广泛pH试纸测稀盐酸的pH=3.2
C.施用适量石膏可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
2.下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
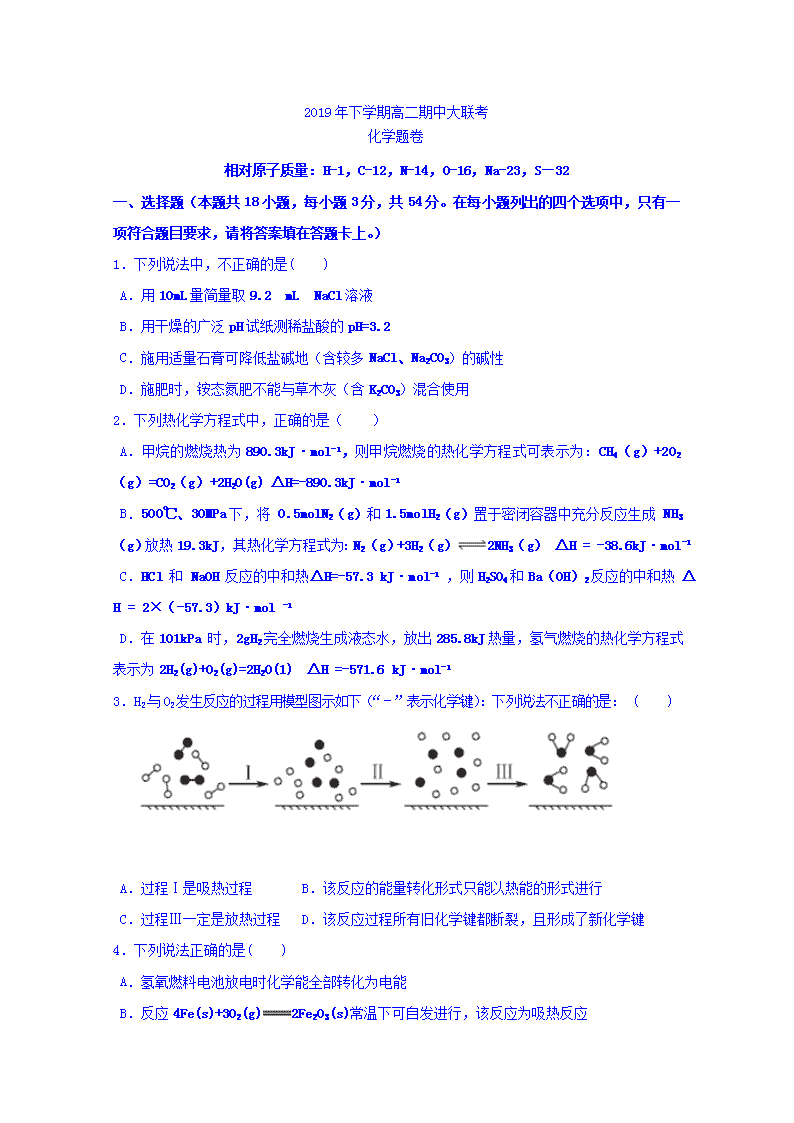
3.H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是: ( )
A.过程Ⅰ是吸热过程 B.该反应的能量转化形式只能以热能的形式进行
C.过程Ⅲ一定是放热过程 D.该反应过程所有旧化学键都断裂,且形成了新化学键
4.下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
5.无论化学反应过程是一步完成或分为数步完成,这个过程的热效应是相同的
已知:H2O(g)=H2O(l); △H1=Q1 kJ·molˉ1
C2H5OH(g)=C2H5OH(l); △H2=Q2 kJ·molˉ1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g); △H3=Q3 kJ·molˉ1
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.1.5Q1-0.5Q2+0.5Q3 D.0.5Q1-1.5Q2+0.5Q3
6.在373K时,把0.1molN2O4气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.压缩容器,颜色加浅 B.在平衡时体系内含N2O40.04mol
C.以N2O4的浓度变化表示的平均反应速率为0.002mol/(L·s)
D.平衡时,如果再充入一定量N2O4,则可提高N2O4的转化率
7.向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是( )
A.该温度下反应的平衡常数K=1620 B.SO2和O2的平衡转化率相等
C.平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D.若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
8.下列各表述与示意图一致的是( )
A.图①表示N2O4(g)2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+
)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
9.下列各组离子在指定溶液中一定能大量共存的是( )
A.含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl-
B.含有Fe3+的溶液中:Na+、AlO2一、C6H5-、I-
C.加入Al能放出H2的溶液中:Cl-、NO3-、SO42-、K+
D.由水电离出的c(OH—)=l×10—13mol•L—1的溶液中:Na+、Ba2+、Cl-、NH4+
10.pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.物质的量浓度HA
c(NH4+)
B.N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C.Q 点盐酸与氨水恰好中和
D.M 点到Q点所示溶液中水的电离程度先变大后减小
二、填空题(本题共4小题,共46分,请将答案填在答题卡相应的位置。)
19.(12分)用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)<0.7时,滤液1中能够检验出有Fe2+;c(H+)/c(Fe2+)≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想试剂是_(填序号) a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
20.(12分)氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g)向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为: 2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、C两点的浓度平衡常数关系:Kc(A)_____Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=_______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
21.(10分)Ⅰ.火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3
又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g)=2NO2(g) △H= +67.7kJ·mol-1
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534.0kJ·mol-1
NO2(g)1/2N2O4(g) △H=-26.35kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:____________________________________________。
Ⅱ.1100℃时,体积为2L的恒容容器中发生如下反应:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是____。
A.容器中压强不变 B.混合气体密度不变
C.1molH-H键断裂同时形成2 mol H-O D.H2的体积分数不变
(2)若2min时反应达平衡,此时气体质量增加8g,则用H2表示该反应的反应速率为___________________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____。
(4)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___(填“增大”、“减小”或“不变”)。
22.(12分)I.某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号
KOH溶液的浓度(mol/L)
滴定完成时,KOH溶液滴入的体积(mL)
待测盐酸溶液的体积(mL)
1
0.10
22.62
20.00
2
0.10
22.72
20.00
3
0.10
22.80
20.00
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为___(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:
(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有(_______)
A.起始读数时平视,终点读数时俯视 B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
2019年下期高二期中考试化学(参考答案)
1-5 BDBCC
6-10 BDBAA
11-15 BDDCB
16-18 DBB
19.(12分)
(1)A
(2)Cu2++ S2- = CuS↓
(3)①B ② b
(4)
(5)393.3
20.(12分) 放热 0.01mol/(L·min) = C 3.2MPa
21.(10分)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1083.0kJ·mol-1 BD 0.125mol/(L·min) 81 不变
22.(12分) 0.11mol/L 酸式(1分) 检漏(或查漏)(1分) 润洗(1分) 淀粉溶液(1分) 滴最后一滴时,溶液由无色变为浅蓝色,且半分钟内不褪色 B