- 2021-05-20 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】山西省临猗县临晋中学2020-2021学年高一9月月考试卷
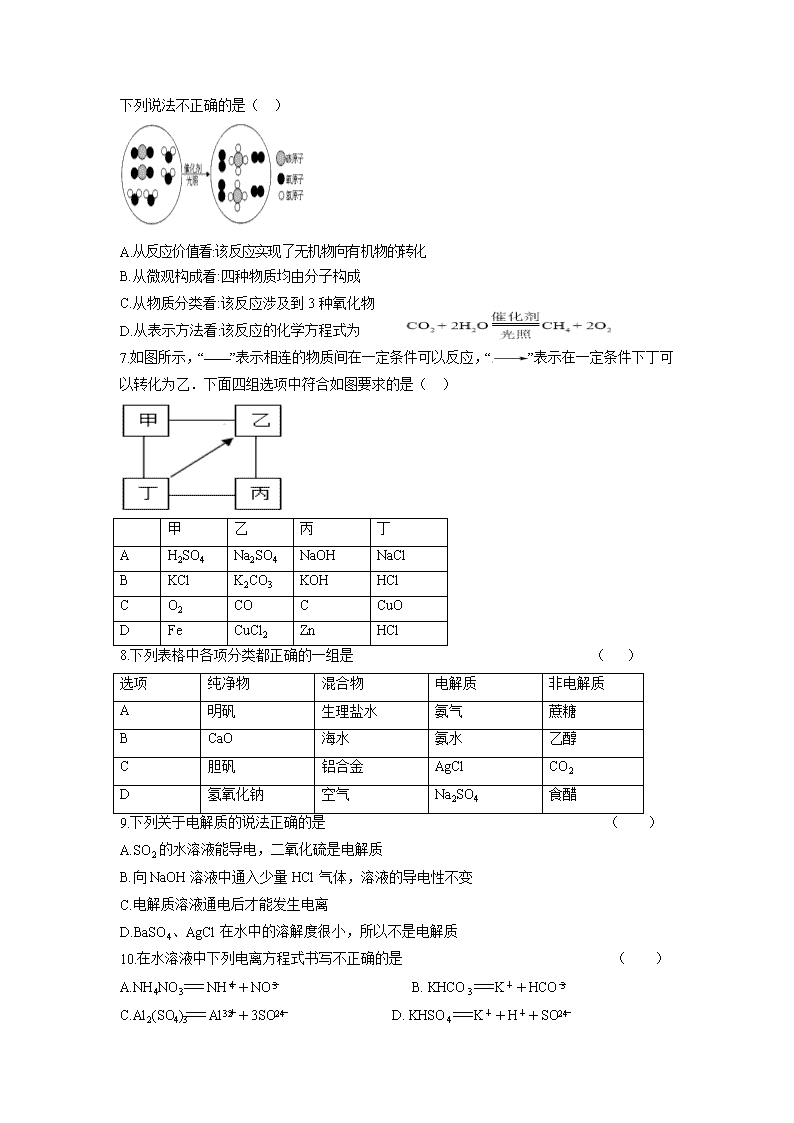
山西省临猗县临晋中学2020-2021学年高一9月月考试卷 (测试范围必修一第一章 时间60分钟) 一、选择题(每小题只有一个正确选项,共16个小题,每小题3分,共48分) 1.古诗词是我们宝贵的精神财富。下列诗句中不涉及氧化还原反应的是 ( ) A.泉眼无声惜细流,树阴照水爱晴柔 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.野火烧不尽,春风吹又生 D.爆竹声中一岁除,春风送暖入屠苏 2.雾霾、PM2.5已经成为公众耳熟能详的热词。“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物。下列有关说法中,错误的是 ( ) A.雾霾有可能产生丁达尔效应 B.雾霾的形成与工业排放的烟气和汽车尾气有关 C.“PM2.5”分散在大气中形成气溶胶,性质稳定,没有必要纳入空气质量评价指标 D.雾霾天气严重危害人体健康 3.下列事实与胶体性质无关的是 ( ) A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 B.明矾可用作净水剂 C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 D.硫酸铜应用于游泳池水的消毒 4.关于物质的分类,下列组合中正确的是 ( ) 选项 酸 碱 盐 酸性氧化物 碱性氧化物 纯净物 A 硫酸 纯碱 磷酸铵 二氧化碳 氧化铁 水煤气 B 盐酸 烧碱 氯化钠 二氧化氮 氧化钠 明矾 C 醋酸 火碱 氟化钙 二氧化硫 氧化铜 碱式碳酸铜 D 硝酸 苛性钾 碳酸钙 三氧化硫 氧化钙 只含一种元素的物质 5.氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下: 在上述流程中没有涉及的化学反应类型是( ) A.化合反应 B.氧化还原反应 C. 离子反应 D.复分解反应 6.“宏观—微观—符号”是学习化学的重要内容和方法。某化学反应的微观示意图如图所示,下列说法不正确的是( ) A.从反应价值看:该反应实现了无机物向有机物的转化 B.从微观构成看:四种物质均由分子构成 C.从物质分类看:该反应涉及到3种氧化物 D.从表示方法看:该反应的化学方程式为 7.如图所示,“——”表示相连的物质间在一定条件可以反应,“”表示在一定条件下丁可以转化为乙.下面四组选项中符合如图要求的是( ) 甲 乙 丙 丁 A H2SO4 Na2SO4 NaOH NaCl B KCl K2CO3 KOH HCl C O2 CO C CuO D Fe CuCl2 Zn HCl 8.下列表格中各项分类都正确的一组是 ( ) 选项 纯净物 混合物 电解质 非电解质 A 明矾 生理盐水 氨气 蔗糖 B CaO 海水 氨水 乙醇 C 胆矾 铝合金 AgCl CO2 D 氢氧化钠 空气 Na2SO4 食醋 9.下列关于电解质的说法正确的是 ( ) A.SO2的水溶液能导电,二氧化硫是电解质 B.向NaOH溶液中通入少量HCl气体,溶液的导电性不变 C.电解质溶液通电后才能发生电离 D.BaSO4、AgCl在水中的溶解度很小,所以不是电解质 10.在水溶液中下列电离方程式书写不正确的是 ( ) A.NH4NO3== NH+NO B. KHCO3== K++HCO C.Al2(SO4)3== Al+3SO D. KHSO4== K++H++SO 11.下列离子方程式中正确的是 ( ) A.金属铜与稀盐酸反应 Cu+2H+== Cu2++H2↑ B.氢氧化铜与稀硫酸反应 H++OH—== H2O C.铝与硝酸汞溶液反应 Al+Hg2+== Al3++Hg D.氢氧化钠溶液与碳酸氢钠溶液反应OH—+HCO== CO+H2O 12.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是 ( ) A.氢氧化铜与盐酸、氢氧化钠与硫酸 B.氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与硫酸钾溶液 C.碳酸钠溶液与盐酸、碳酸钙与盐酸 D.石灰石与硝酸溶液、石灰石与醋酸溶液 13.在下列溶液中,各组离子一定能够大量共存的是 ( ) A.在强碱性溶液中:Na+、Cl—、SO、NH B.在碳酸钠溶液中:Na+、Cl—、OH—、K+ C.在无色的溶液中:K+、H+、Cl—、MnO D.在强酸性溶液中:Fe2+、Na+、CO、Cl— 14.含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( ) A.该过程中可得到化工产品H2SO4 B.该过程中化合价发生改变的元素为Fe和S C.该工艺流程是除去煤燃烧时产生的SO2 D.图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O == 2FeSO4+2H2SO4 15.下列关于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O的叙述正确的是 ( ) A.Cl2只做氧化剂 B.每生成1个NaClO3转移6个电子 C.NaCl是氧化产物 D.被氧化的物质和被还原的物质的质量之比为1∶5 16.已知有如下反应:①2BrO+Cl2== Br2+2ClO ② ClO+5Cl—+6H+== 3Cl2+3H2O ③2FeCl2+Cl2== 2FeCl3 。根据上述反应,判断下列结论中错误的是 ( ) A.Cl2在反应②中既是氧化产物又是还原产物 B.Cl2在①、③反应中均作氧化剂 C.氧化性强弱的顺序为:BrO> ClO> Cl2 >Fe3+ D.溶液中可发生:ClO+6Fe2++ 6H+ == Cl—+6Fe3++3H2O 17.(12分)铁及其化合物在生产、生活中有及其重要的用途,请回答下列问题: (1)FeCl3溶液呈黄色,FeCl3溶液的分散质是 ,分散剂是 。 (2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是 (3)Fe(OH)3胶体呈红褐色,具有良好的净水效果.由饱和FeCl3溶液制备Fe(OH)3胶体的方法是 。离子方程式是 。 (4)鉴别FeCl3溶液和Fe(OH)3胶体,除了可通过观察颜色以外,还有的方法是 。 (5)下列关于Fe(OH)3胶体和Fe(OH)3悬浊液的描述,正确的是 A.两者颜色相同 B.两者稳定性相同 C.两者的分子直径均大于100nm D.滴加稀盐酸后,两者现象完全相同 (6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业制备高铁酸钠有多种方法,其中一种方法的原理可用离子方程式表示为3ClO—+2Fe3++10OH—== 2FeO+3Cl—+5H2O,则Na2FeO4中铁元素的化合价为 ,该离子反应中氧化剂与还原剂的个数比为 ,生成1个高铁酸钠转移 个电子 18.(12)书写下列反应的离子方程式 (1)铁与稀硫酸 (2)氧化铁与盐酸 (3)稀硫酸与氢氧化钡溶液反应 (4)氯化铁溶液与氨水 (5)碳酸钙与盐酸反应 (6)碳酸氢钠溶液与硫酸氢钠溶液 19.(10分)现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3固体.相应的实验流程如图表示: 请回答下列问题: (1)产生沉淀A的离子方程式是 。 (2)试剂X是 (填化学式)。 (3)上述实验流程中①②③步骤均要用到的主要玻璃仪器有 。 (4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是 。 (5)按此实验方案得到的溶液3中肯定含有杂质。为了解决这个问题,可以向溶液3中加入适量的 (填化学式),并写出离子方程式 。 20.(9分)氧化还原反应反应是重要的化学反应类型,仔细思考回答下列问题 下列有水参与的反应 ①2Na+2H2O== 2NaOH+H2↑ ②2Na2O2+2H2O== 4NaOH+O2↑ ③Na2O+H2O== 2NaOH ④2H2O2H2↑+O2↑⑤2F2+2H2O == 4HF+O2 (1)其中不属于氧化还原反应的是 (填编号). (2)在这些氧化还原反应中,水只作氧化剂的反应是 (填编号);水只作还原剂的反应是 (填编号);水既作氧化剂,又作还原剂是 (填编号);水既不作氧化剂,又不作还原剂是 (填编号). (3)根据你的理解,氧化还原反应的实质是 A.分子中的原子重新组合 B.氧元素的得失 C.电子的得失或共用电子对的偏移 D.化合价的改变 (4)请你运用所学知识分析3NO2+H2O== 2HNO3+NO是否属于氧化还原反应? (填“是”或“不是”),若是,这个反应的氧化剂是 ,氧化产物是 . 21.(9分)实验室迅速制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)此反应常温下就可以迅速进行,结合信息,回答下列问题. (1)上述反应中被氧化的元素为 (填元素符号),还原产物是 . (2) Fe2+也能与MnO反应生成Mn2+,反应后Fe2+转化为 。反应中Fe2+表现 (填“氧化”或“还原”下同)性,发生 反应。 (3)如果上述化学方程式方程式中KMnO4和MnCl2的化学计量数都是2,则HCl的化学计量数是 。 (4)实验室通常利用MnO2与浓盐酸共热反应制得氯气,另知Cl2+2I—=I2+2Cl—,据此可知MnO2、Cl2、MnO、I2四种物质氧化性由强到弱的顺序 。 【参考答案】 1 2 3 4 5 6 7 8 A C D C B C D C 9 10 11 12 13 14 15 16 B C D B B B D B 17.(1)FeCl3、水(每空1分) (2)过滤(1分) (3)将饱和FeCl3溶液逐滴滴入沸水中,继续煮沸至溶液呈红褐色,停止加热;Fe3++3H2OFe(OH)3(胶体)+3H+(每空2分) (4)丁达尔效应(1分) (5) A (1分) (6) +6(1分)3∶2(1分)3(1分) 18.(每空2分)答案略 19.(1)Ba2++SO=BaSO↓(2分) (2)AgNO3。(1分) (3)烧杯、玻璃棒和漏斗(2分) (4)Ag2CO3和Ba CO3(2分) (5) HNO3(1分)2H++CO=CO2↑+H2O(2分) 20.(每空1分,共9分) (1) ③ (2) ①; ⑤; ④;② (3)C (4)是;NO2;HNO3 21.(1)Cl,MnCl2.(每空1分) (2) Fe3+;还原,氧化。(每空1分) (3)16(2分) (4) MnO>MnO2>Cl2>I2(2分)查看更多