- 2021-05-20 发布 |
- 37.5 KB |
- 22页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考二轮复习苏教版第2讲氧化还原反应课件(22张)
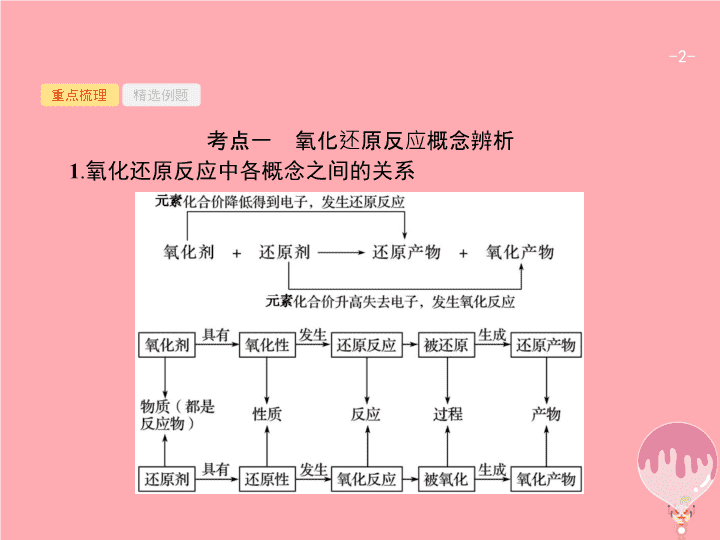
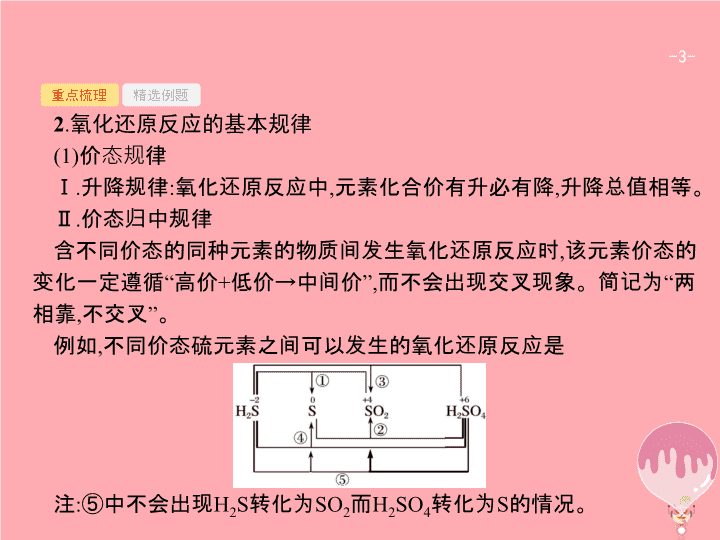
第 2 讲 氧化还原反应 - 2 - 重点梳理 精选例题 考点一 氧化还原反应概念辨析 1 . 氧化还原反应中各概念之间的关系 - 3 - 重点梳理 精选例题 2 . 氧化还原反应的基本规律 (1) 价态规律 Ⅰ . 升降规律 : 氧化还原反应中 , 元素化合价有升必有降 , 升降总值相等。 Ⅱ . 价态归中规律 含不同价态的同种元素的物质间发生氧化还原反应时 , 该元素价态的变化一定遵循 “ 高价 + 低价 → 中间价 ”, 而不会出现交叉现象。简记为 “ 两相靠 , 不交叉 ” 。 例如 , 不同价态硫元素之间可以发生的氧化还原反应是 注 : ⑤ 中不会出现 H 2 S 转化为 SO 2 而 H 2 SO 4 转化为 S 的情况。 - 4 - 重点梳理 精选例题 (2) 强弱规律 自发进行的生成氧化还原反应 , 一般遵循强氧化剂生成弱氧化性产物 , 强还原剂生成弱还原性产物 , 即 “ 由强制弱 ” 。 - 5 - 重点梳理 精选例题 (3) 先后规律 Ⅰ . 体系中同时含有几种还原剂时 , 加入氧化剂 , 将按照还原性由强到弱的顺序依次反应。如 : 在 FeBr 2 溶液中通入少量 Cl 2 时 , 因为还原性 Fe 2+ >Br - , 所以 Fe 2+ 先与 Cl 2 反应。 Ⅱ . 同时含有几种氧化剂时 , 加入还原剂 , 将按照氧化性由强到弱的顺序依次反应。如在含有 Fe 3+ 、 Cu 2+ 、 H + 的溶液中加入铁粉 , 因为氧化性 Fe 3+ >Cu 2+ >H + , 所以铁粉先与 Fe 3+ 反应 , 然后依次与 Cu 2+ 、 H + 反应。 (4) 电子守恒规律 氧化还原反应中 , 氧化剂得电子总数等于还原剂失电子总数。 - 6 - 重点梳理 精选例题 3 . 氧化性和还原性比较的六种方法 - 7 - 重点梳理 精选例题 - 8 - 重点梳理 精选例题 答案 解析 解析 关闭 答案 解析 关闭 - 9 - 重点梳理 精选例题 答案 解析 解析 关闭 A 项氧元素被还原 ;B 、 D 项氧元素价态未改变 ;C 项氧元素被氧化 ;A 符合题意。 答案 解析 关闭 A - 10 - 重点梳理 精选例题 答案 解析 解析 关闭 根据单质中元素化合价为 0 、化合物中元素正负化合价代数和为 0 可知 , 反应物中化合价降低的元素是氯 , 氯气是氧化剂 , 故选 A 。 答案 解析 关闭 A - 11 - 重点梳理 精选例题 规律小结 解答氧化还原反应有关概念题的 “ 三个步骤 ” 第一步 : 依据题意分析概念。 “ 升失氧 , 降得还 ; 剂性一致 , 其他相反。 ”“ 剂性一致 ” 即氧化剂具有氧化性 , 还原剂具有还原性。 “ 其他相反 ” 即氧化剂被还原 , 发生还原反应 , 生成还原产物 ; 还原剂被氧化 , 发生氧化反应 , 生成氧化产物。 第二步 : 依据规律判断反应的合理性。氧化还原反应遵循同种元素化合价互不交叉规律、强弱规律等。同学们应掌握元素化合价与物质氧化性的关系 ,“ 高价氧化低价还 , 中间价态两俱全 ” 。 第三步 : 利用电子守恒进行定量判断。有关氧化还原反应的定量问题 , 利用得失电子守恒法可以简化计算过程。对于生疏的或多步氧化还原反应 , 可直接找出起始的氧化剂、还原剂和最终的还原产物、氧化产物 , 利用原子守恒和电子守恒 , 建立已知量与未知量的关系 , 快速列等式求解。 - 12 - 重点梳理 精选例题 考点二 氧化还原反应的综合应用 1 . 配平氧化还原反应方程式的基本原则 - 13 - 重点梳理 精选例题 2 . 配平氧化还原反应方程式的一般步骤 - 14 - 重点梳理 精选例题 3 . 陌生情景下氧化还原反应方程式的书写 “ 四步 ” 突破陌生情景下氧化还原反应方程式的书写 : - 15 - 重点梳理 精选例题 4 . 氧化还原反应在滴定中的应用 (1) 原理 : 一般以氧化还原反应为基础 , 用已知浓度的氧化剂或还原剂为滴定剂 , 滴定一些具有还原性或氧化性的物质 , 根据这些物质发生反应时溶液的颜色变化 ( 有时需借助特殊的指示剂 ), 测定未知浓度反应物的浓度 , 其步骤及使用仪器等与酸碱中和滴定类似。 (2) 典型示例 : ① 碘量法 用 I 2 标准溶液直接滴定还原剂 , 如可用 I 2 标准溶液测定一定体积维生素 C 溶液中维生素 C 的含量等。或是利用 I - 与强氧化剂作用生成定量的 I 2 , 再用还原剂标准溶液 ( 一般用 Na 2 S 2 O 3 溶液 ) 与 I 2 反应 , 测定氧化剂的方法。如可在一定体积的加碘盐溶液中加入过量的 KI, 使 KI 与 KIO 3 反应生成 I 2 , 再用标准 Na 2 S 2 O 3 溶液滴定生成的 I 2 , 从而测定加碘盐中的碘含量。使用碘量法时 , 一般需加淀粉溶液作指示剂。 - 16 - 重点梳理 精选例题 ② 高锰酸钾法 利用酸性高锰酸钾溶液的强氧化性 , 可用直接滴定法测定如 H 2 C 2 O 4 、 Na 2 C 2 O 4 、 H 2 O 2 、 Fe 2+ 等还原性物质的浓度或含量等 ( 有时也可将被测物质先转化为此类还原性物质 , 再用酸性高锰酸钾溶液滴定 ) 。使用高锰酸钾滴定法时 , 一般不需要另加指示剂 , 可利用高锰酸钾自身颜色变化指示终点 ( 出现淡红色 30 秒不褪 ) 。 - 17 - 重点梳理 精选例题 (2017· 宁波统考 ) 将一定量的氯气通入 50 mL10.00 mol·L -1 的氢氧化钠浓溶液中 , 加热少许时间后 , 溶液中形成 NaCl 、 NaClO 、 NaClO 3 共存体系 ( 不考虑氯气和水的反应 ) 。下列说法正确的是 ( ) A. 若反应中转移的电子为 n mol, 则 0.25< n <0.5 B. 溶液中 n (NaCl) ∶ n (NaClO) ∶ n (NaClO 3 ) 可能为 3 ∶ 2 ∶ 1 C. 与 NaOH 反应的氯气物质的量 :0.25 mol< n (Cl 2 )<0.75 mol D. 当溶液中 n (NaClO) ∶ n (NaClO 3 )=5 ∶ 1 时 , 反应的离子方程式为 答案 解析 解析 关闭 答案 解析 关闭 - 18 - 重点梳理 精选例题 跟踪训练 1 .(2017· 北京卷 ) 下列变化中 , 气体被还原的是 ( ) A. 二氧化碳使 Na 2 O 2 固体变白 B. 氯气使 KBr 溶液变黄 C. 乙烯使 Br 2 的四氯化碳溶液褪色 D. 氨气使 AlCl 3 溶液产生白色沉淀 答案 解析 解析 关闭 答案 解析 关闭 - 19 - 重点梳理 精选例题 2 .(2017· 全国卷 3 节选 ) 工业上常将含砷废渣 ( 主要成分为 As 2 S 3 ) 制成浆状 , 通入 O 2 氧化 , 生成 H 3 AsO 4 和单质硫。写出发生反应的化学方程式 。 答案 解析 解析 关闭 答案 解析 关闭 - 20 - 重点梳理 精选例题 规律小结 1 . 几种特殊的配平方法 - 21 - 重点梳理 精选例题 - 22 - 重点梳理 精选例题 2 . 氧化还原反应与电化学知识的综合运用 (1) 根据可自发进行的氧化还原反应设计原电池或书写原电池的电极反应式。此类题目在解答时 , 应先弄清楚在该氧化还原反应中哪些元素化合价升高 , 哪些元素化合价降低 , 从而确定正负极得失电子的物质 , 然后书写电极反应式或是确定电极材料、电解质溶液等。 (2) 根据离子氧化性、还原性强弱判断电解池中阴阳极离子的放电顺序 , 从而书写电极反应式或进行相关的计算等。 (3) 综合利用氧化还原反应与电化学知识 , 设计各类电池、分离提纯物质、处理废水等实际问题。查看更多