- 2021-05-20 发布 |
- 37.5 KB |
- 32页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
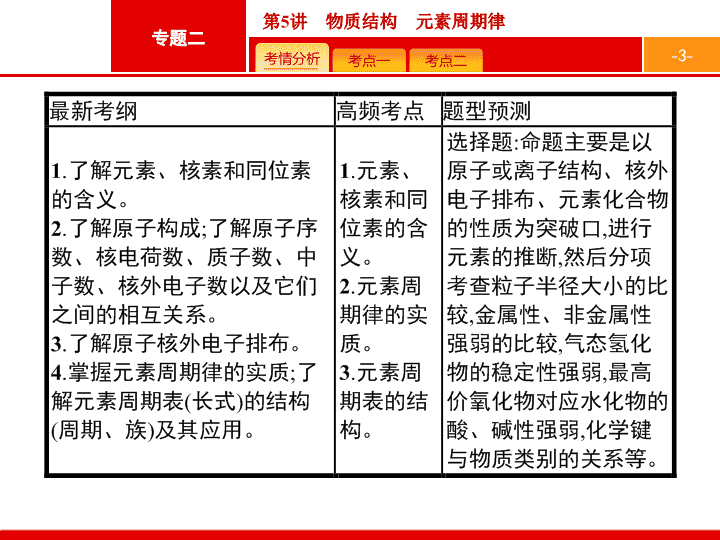
2019届二轮复习5物质结构 元素周期律课件(32张)
专题二 化学基本理论 第 5 讲 物质结构 元素周期律 - 3 - - 4 - - 5 - 精要排查 真题示例 知能提升 对点演练 原子结构及化学键 1 . 判断正误 , 正确的划 “ √ ”, 错误的划 “×” 。 (3) 同位素的化学性质基本相同 , 其物理性质不一定相同 ( √ ) (4) 两种原子 , 若核外电子排布相同 , 则一定属于同种元素 ( √ ) (5) 不存在质子数和电子数完全相同的阳离子和阴离子 ( √ ) (6) 化学变化中一定存在化学键的断裂和形成 , 物理变化中一定不存在化学键的断裂和形成 ( × ) (7) 在离子化合物里 , 只存在离子键 , 没有共价键 ( × ) (8) 非极性键只存在于双原子的单质分子 ( 如 Cl 2 ) 中 ( × ) - 6 - 精要排查 真题示例 知能提升 对点演练 2 .(1) 质量数 = 质子数 + 中子数 。 (2) 质子数 = 阳离子的核外电子数 + ( 填 “+” 或 “-”, 下同 ) 阳离子所带电荷数。 (3) 质子数 = 阴离子的核外电子数 - 阴离子所带电荷数。 3 . 用 “ 同素异形体 ”“ 同位素 ”“ 同系物 ” 或 “ 同分异构体 ” 填空。 (2)O 2 、 O 3 —— 同素异形体 。 (3)CH 3 CH 3 、 CH 3 CH 2 CH 3 —— 同系物 。 (4) 正戊烷、新戊烷 —— 同分异构体 。 - 7 - 精要排查 真题示例 知能提升 对点演练 4 . 指出下列物质中含有的化学键类型。 (1)Na 2 O 2 离子键、共价键 ;(2)AlCl 3 共价键 ; (3)NH 4 Cl 离子键、共价键 ;(4)NaH 离子键 ;(5)NH 3 ·H 2 O 共价键 。 - 8 - 精要排查 真题示例 知能提升 对点演练 1 .(2018 课标 Ⅲ ,8,6 分 ) 下列叙述正确的是 ( ) A.24 g 镁与 27 g 铝中 , 含有相同的质子数 B. 同等质量的氧气和臭氧中 , 电子数相同 C.1 mol 重水与 1 mol 水中 , 中子数比为 2 ∶ 1 D.1 mol 乙烷和 1 mol 乙烯中 , 化学键数相同 答案 解析 解析 关闭 24 g 镁和 27 g 铝的物质的量都是 1 mol, 分别含有 12 N A 、 13 N A 个质子 ,A 项错误 ; 氧气和臭氧是同素异形体 , 两种分子均由氧原子构成 , 故同等质量氧气和臭氧所含原子数相同 , 则电子数也相同 ,B 项正确 ; 重水和水分子中的中子数分别是 10 、 8, 相同物质的量的重水和水所含的中子数之比为 5 ∶ 4,C 项错误 ; 乙烷分子中有 7 个化学键 , 乙烯分子中有 5 个化学键 ,D 项错误。 答案 解析 关闭 B - 9 - 精要排查 真题示例 知能提升 对点演练 2 .(2017 北京 ,7,6 分 )2016 年 IUPAC 命名 117 号元素为 Ts( 中文名 “ ”, tián ),Ts 的原子核外最外层电子数是 7 。下列说法不正确的是 ( ) A.Ts 是第七周期第 ⅦA 族元素 B.Ts 的同位素原子具有相同的电子数 C.Ts 在同族元素中非金属性最弱 答案 解析 解析 关闭 答案 解析 关闭 - 10 - 精要排查 真题示例 知能提升 对点演练 3 .(2017 课标 Ⅱ ,9,6 分 )a 、 b 、 c 、 d 为原子序数依次增大的短周期主族元素 ,a 原子核外电子总数与 b 原子次外层的电子数相同 ;c 所在周期数与族数相同 ;d 与 a 同族。下列叙述正确的是 ( ) A. 原子半径 :d>c>b>a B.4 种元素中 b 的金属性最强 C.c 的氧化物的水化物是强碱 D.d 单质的氧化性比 a 单质的氧化性强 答案 解析 解析 关闭 由于都是主族元素 , 故 a 原子核外电子总数只能是 8,a 为氧元素 ;a 、 b 、 c 、 d 为短周期元素 , 原子序数依次增大 ,c 所在周期序数与族序数相同 ,c 为 Al, 则 b 为 Na 或 Mg 元素 ;d 与 a 同族 , 则 d 为硫元素。 A 项 , 同周期主族元素 , 从左到右原子半径逐渐减小 , 电子层数越多 , 原子半径越大 , 故原子半径 :Na( 或 Mg)>Al>S>O,A 项错误 ;4 种元素中 Na( 或 Mg) 的金属性最强 ,B 项正确 ; 铝的氧化物对应的水化物是两性氢氧化物 ,C 项错误 ;D 项 ,S 的氧化性弱于 O 2 ,D 项错误。 答案 解析 关闭 B - 11 - 精要排查 真题示例 知能提升 对点演练 名师揭密 原子结构、离子结构是物质结构的核心内容 , 同样也是高考的重要考点。相关的题目主要是以原子 ( 或离子 ) 结构、核外电子排布、元素化合物的性质为突破口 , 进行元素的推断 , 然后判断或解决相关的问题 , 主要题型为选择题。复习该部分内容要注意识记重要定义 , 掌握常用规律 , 从而提高解题能力 ; 同时要重视知识迁移和化学用语的规范使用。 - 12 - 精要排查 真题示例 知能提升 对点演练 1 . 原子或离子中各微粒间的数量关系 (1) 对于原子 : 质子数 = 核电荷数 = 核外电子数 = 原子序数。 (2) 质量数 = 质子数 + 中子数。 (3) 质子数 = 阳离子的核外电子数 + 阳离子所带正电荷数。 (4) 质子数 = 阴离子的核外电子数 - 阴离子所带负电荷数。 2 . 元素、核素、同位素之间的关系 - 13 - 精要排查 真题示例 知能提升 对点演练 3 . 化学键与物质类别的关系 (1) 只含非极性共价键的物质 : 某些非金属元素组成的单质 ( 稀有气体除外 ), 如 I 2 、 N 2 、 P 4 、金刚石、晶体硅等。 (2) 只含有极性共价键的物质 : 一般是不同非金属元素组成的共价化合物 , 如 HCl 、 NH 3 、 SiO 2 、 CS 2 等。 (3) 既有极性键又有非极性键的物质 , 如 H 2 O 2 、 C 2 H 4 、 CH 3 CH 3 、 C 6 H 6 等。 (4) 只含有离子键的物质 : 活泼非金属元素与活泼金属元素形成的化合物 , 如 Na 2 S 、 CsCl 、 K 2 O 、 NaH 等。 (5) 既有离子键又有非极性共价键的物质。如 Na 2 O 2 、 CaC 2 等。 (6) 由极性共价键构成但又不是强电解质的物质 , 如 HF 等。 - 14 - 精要排查 真题示例 知能提升 对点演练 题组一 原子结构及微粒间关系 1 .(2018 黑龙江大庆实验中学月考 ) 下列说法正确的是 ( ) A. 由 H 、 D 、 T 与 16 O 、 17 O 、 18 O 相互结合为水 , 可得水分子 18 种 , 其中相对分子质量不同的水分子种数为 8 种 B.H 2 、 D 2 、 T 2 互为同素异形体 C.H 2 、 D 2 、 T 2 在相同条件下的密度之比为 1 ∶ 2 ∶ 3 D. 氕、氘发生核聚变成为其他元素 , 属于化学变化 答案 解析 解析 关闭 H 、 D 、 T 组合为 H 2 、 D 2 、 T 2 、 HD 、 HT 、 DT 共 6 种 , 16 O 、 17 O 、 18 O 共 3 种 , 所以构成的水分子共有 6×3=18 种 , 相对分子质量介于 18~24 之间 , 共有 7 种 ,A 项错误 ;H 2 、 D 2 、 T 2 均为氢气单质 , 属于同一种物质 ,B 项错误 ;H 2 、 D 2 、 T 2 在相同条件下的密度比等于气体的相对分子质量之比 , 即 H 2 、 D 2 、 T 2 的密度之比为 2 ∶ 4 ∶ 6=1 ∶ 2 ∶ 3,C 项正确 ; 氕、氘发生核聚变成为其他元素 , 此过程属于核反应 , 不是化学变化 ,D 项错误。 答案 解析 关闭 C - 15 - 精要排查 真题示例 知能提升 对点演练 题组二 核外电子排布的规律及应用 2 .(2018 辽宁鞍山第一中学模拟 )X 、 Y 、 Z 、 W 、 R 是 5 种短周期元素 , 其原子序数依次增大。 X 是元素周期表中原子半径最小的元素 ,Y 原子最外层电子数是次外层电子数的 3 倍 ,Z 、 W 、 R 处于同一周期 ,R 与 Y 处于同一族 ,Z 、 W 原子的核外电子数之和与 Y 、 R 原子的核外电子数之和相等。下列说法正确的是 ( ) A. 元素 Y 、 Z 、 W 形成的简单离子具有相同的电子层结构 , 其半径依次增大 B. 元素 Y 、 R 分别与元素 X 形成的简单化合物的稳定性 :X m Y 强于 X m R C. 元素 Z 、 Y 形成的 1 mol 化合物中含有的分子数约为 1.806×10 24 D. 元素 Z 、 R 的最高价氧化物的水化物之间相互反应生成的盐溶液呈中性或碱性 答案 解析 解析 关闭 X 是周期表中原子半径最小的元素 , 应为氢元素 ,Y 原子最外层电子数是次外层电子数的 3 倍 , 应为氧元素 ; 根据 R 与 Y 处于同一族 , 则 R 为硫元素 ,Z 、 W 原子的核外电子数之和与 Y 、 R 原子的核外电子数之和相等 , 则 Z 、 W 原子的核外电子数之和为 8+16=24, 又因为 Z 、 W 、 R 处于同一周期 , 应为第三周期 ,Z 、 W 分别为 Na 和 Al 。 Y 、 Z 、 W 具有相同电子层结构的离子 (O 2- 、 Na + 、 Al 3+ ), 根据核外电子排布相同的离子 , 半径随着核电荷数的增加而减小 , 故 A 项错误 ; 元素 Y 、 R 分别与元素 X 形成的化合物是氢化物 , 因为 Y(O) 和 R(S) 的非金属性强弱 :Y>R, 所以对应的氢化物的稳定性 :H 2 O>H 2 S, 故 B 项正确 ;Y 为氧 ,Z 为钠 , 元素 Z 、 Y 形成的化合物均为离子化合物 , 不存在分子 , 故 C 项错误 ; 元素 Z 、 R 的最高价氧化物的水化物之间相互反应生成的盐溶液可能呈酸性 , 例如硫酸氢钠水溶液显酸性 ,D 项错误。 答案 解析 关闭 B - 16 - 精要排查 真题示例 知能提升 对点演练 题组三 物质类别与微粒间的相互作用 3 .(2018 河南豫西名校联考 ) 下列说法正确的是 ( ) ① 离子化合物中一定含离子键 , 也可能含共价键 ② 共价化合物中可能含离子键 ③ 含金属元素的化合物不一定是离子化合物 ④ 由非金属元素组成的化合物一定是共价化合物 ⑤ 构成单质分子的粒子不一定存在共价键 ⑥ 不同元素组成的多原子分子里的化学键一定是极性键 ⑦ 有化学键断裂的变化属于化学变化 A. ①③⑤ B. ②④⑥ C. ①③④ D. ③⑤⑦ 答案 解析 解析 关闭 ①离子化合物一定含离子键 , 也可能含极性键或非极性键 , 如 NaOH 中含离子键和 O—H 极性键 , 过氧化钠中含离子键和 O—O 非极性键 , ①正确 ; ②共价化合物一定含共价键 , 一定不含离子键 , 含离子键的一定为离子化合物 , ②错误 ; ③含金属元素的化合物不一定是离子化合物 , 如氯化铝为共价化合物 , ③正确 ; ④由非金属元素组成的化合物不一定是共价化合物 , 如铵盐为离子化合物 , ④错误 ; ⑤由分子组成的物质中不一定存在共价键 , 如稀有气体中不含化学键 , ⑤正确 ; 不同元素组成的多原子分子里的化学键 , 若为同种元素之间形成的是非极性共价键 , 不同元素之间形成的是极性共价键 , ⑥错误 ; ⑦有旧化学键断裂和新化学键形成的变化属于化学变化 , 有化学键断裂的变化不一定属于化学变化 , 如 HCl 溶于水 ,H—Cl 键断裂 , 属于物理变化 , ⑦错误 ; 综上所述符合题意的是①③⑤ ,A 项正确。 答案 解析 关闭 A - 17 - 精要排查 真题示例 知能提升 对点演练 元素周期律 元素周期表 1 . 判断正误 , 正确的划 “ √ ”, 错误的划 “×” 。 (1) 主族元素的最高正价一定等于族序数 ( × ) (2) 元素的非金属性越强 , 其氧化物对应水化物的酸性就越强 ( × ) (3) 失电子难的原子得电子的能力一定强 ( × ) (4) 得失电子数多的原子 , 得失电子的能力一定强 ( × ) (5) 第 ⅦA 族元素的非金属性是同周期元素中最强的 ( √ ) (6) 同周期的主族元素中 , Ⅶ A 族元素的原子半径最小 ( √ ) (7) Ⅵ A 族元素的原子 , 其半径越大 , 气态氢化物越稳定 ( × ) (8) 元素周期表中从 Ⅲ B 族到 Ⅱ B 族十个纵列的元素都是金属元素 ( √ ) - 18 - 精要排查 真题示例 知能提升 对点演练 (9) 第 Ⅰ A 族元素的金属性一定比第 Ⅱ A 族元素的金属性强 ( × ) - 19 - 精要排查 真题示例 知能提升 对点演练 2 .(1) 形成化合物最多的元素是 C ( 填元素符号 , 下同 ), 地壳中含量最多的元素是 O 。 (2)116 号元素在周期表中的位置是 第七周期 Ⅵ A 族 。 (3) 同周期中 ( 稀有气体除外 ) 左边元素的原子半径比右边元素的原子半径 大 , 同主族中下边元素的原子半径比上边元素的原子半径大。 (4) 主族元素最高正化合价数 = 最外层电子数 = 主族序数 ( O 、 F 除外 ) 。 (5) 最高正价 +| 最低负价 |= 8 (F 、 O 除外 ) 。 - 20 - 精要排查 真题示例 知能提升 对点演练 1 .(2018 天津 ,2,6 分 ) 下列有关物质性质的比较 , 结论正确的是 ( ) A. 溶解度 :Na 2 CO 3查看更多