- 2021-05-20 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习综合实验探究题作业
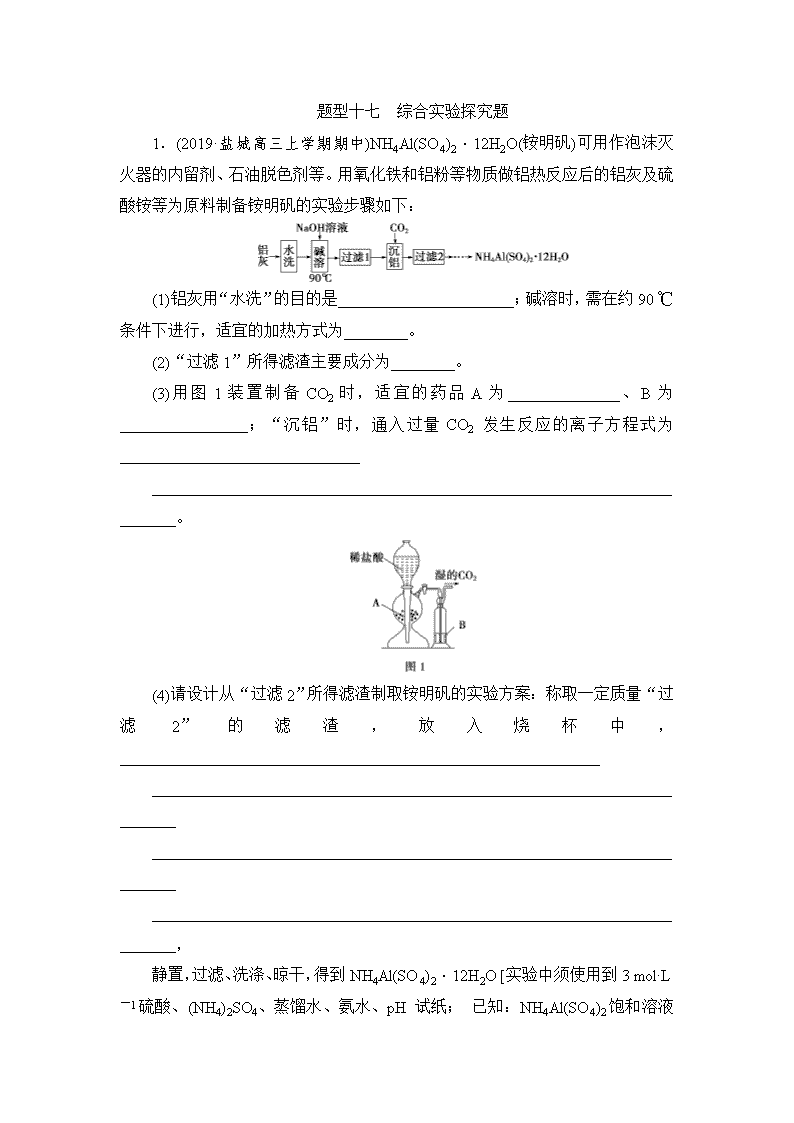
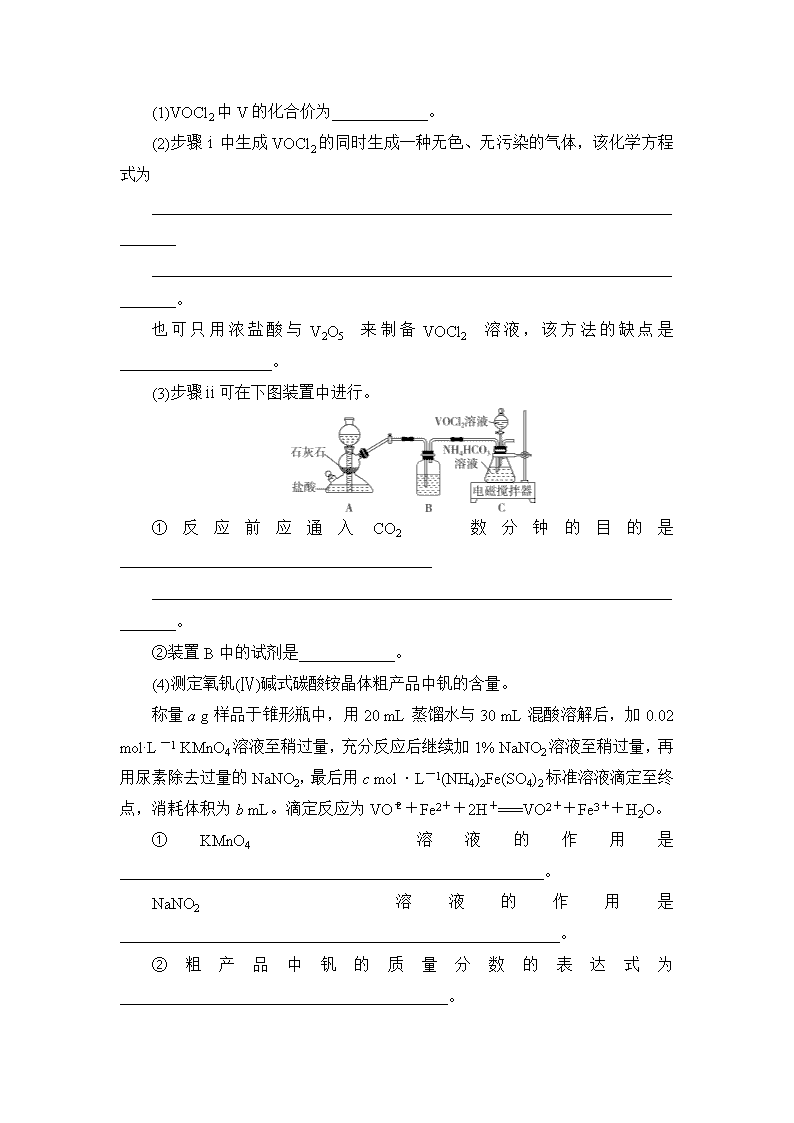
题型十七 综合实验探究题 1.(2019·盐城高三上学期期中)NH4Al(SO4)2·12H2O(铵明矾)可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁和铝粉等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下: (1)铝灰用“水洗”的目的是______________________;碱溶时,需在约90 ℃条件下进行,适宜的加热方式为________。 (2)“过滤1”所得滤渣主要成分为________。 (3)用图1装置制备CO2时,适宜的药品A为______________、B为________________;“沉铝”时,通入过量CO2 发生反应的离子方程式为______________________________ ________________________________________________________________________。 (4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案:称取一定质量“过滤2”的滤渣,放入烧杯中,____________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________, 静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O [实验中须使用到3 mol·L-1硫酸、(NH4)2SO4、蒸馏水、氨水、pH 试纸; 已知:NH4Al(SO4)2 饱和溶液的pH约为1.5,几种物质的溶解度曲线如图2]。 1.解析:铝灰水洗的目的是洗去表面可溶性杂质,在90 ℃水浴条件下,用NaOH溶液进行溶解,发生反应Al2O3+2OH-===2AlO+H2O,过滤除去铁等不溶性杂质,向滤液中通入过量的CO2,发生反应AlO+CO2+2H2O===Al(OH)3↓+HCO,提纯得到较纯的Al(OH)3再制备NH4Al(SO4)2·12H2O。 (3)制备CO2时,适宜的药品A为块状石灰石(或大理石、CaCO3等)、B为饱和NaHCO3溶液(除去挥发出来的HCl气体)。 答案:(1)除去KCl等可溶性杂质 水浴加热 (2)Fe (3)块状石灰石(或大理石、CaCO3等) 饱和NaHCO3溶液 AlO+CO2+2H2O===Al(OH)3↓+HCO (4)加入适量蒸馏水,加热并在不断搅拌下加入3 mol·L-1硫酸至沉淀恰好完全溶解,再加入计算量的 (NH4)2SO4,用3 mol·L-1硫酸和氨水调节溶液的pH在1~2之间,蒸发浓缩,冷却结晶 2.二氧化钒(VO2)是一种新型热敏材料。+4价的钒化合物在弱酸性条件下易被氧化。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下: 回答下列问题: (1)VOCl2中V的化合价为____________。 (2)步骤ⅰ中生成VOCl2的同时生成一种无色、无污染的气体,该化学方程式为 ________________________________________________________________________ ________________________________________________________________________。 也可只用浓盐酸与V2O5来制备VOCl2溶液,该方法的缺点是___________________。 (3)步骤ⅱ可在下图装置中进行。 ①反应前应通入CO2数分钟的目的是_______________________________________ ________________________________________________________________________。 ②装置B中的试剂是____________。 (4)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。 称量a g样品于锥形瓶中,用20 mL蒸馏水与30 mL混酸溶解后,加0.02 mol·L-1 KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为VO+Fe2++2H+===VO2++Fe3++H2O。 ①KMnO4溶液的作用是_____________________________________________________。 NaNO2溶液的作用是_______________________________________________________。 ②粗产品中钒的质量分数的表达式为_________________________________________。 2.解析:(1)由化合价规则知,VOCl2中V的化合价为+4价。(2)无色、无污染的气体是N2,根据得失电子守恒,反应式可先写成V2O5+N2H4·2HCl+6HCl―→VOCl2+N2↑+H2O,再根据原子守恒配平即可。用浓盐酸与V2O5反应时,氧化产物是有毒的Cl2,Cl2能污染空气。(3)①通入CO2的目的是排除装置中的空气,防止其氧化+4价的钒。②装置B中的试剂是饱和NaHCO3溶液,以除去从装置A中挥发出来的HCl。(4)①KMnO4用于氧化+4价钒的化合物,NaNO2用于除去过量的KMnO4。②(NH4)5[(VO)6(CO3)4(OH)9]·10H2O~6VO~6(NH4)2Fe(SO4)2,样品中钒的物质的量为n(V)=cb×10-3mol,质量为51cb×10-3 g,故质量分数为×100%。 答案:(1)+4价 (2)2V2O5+N2H4·2HCl+6HCl===4VOCl2+N2↑+6H2O 有氯气生成,污染空气 (3)①排除装置中的空气,避免产物被氧化 ②饱和NaHCO3溶液 (4)①将+4价钒的化合物氧化为VO 除去过量的 KMnO4 ②×100% 3.实验室回收利用废旧锂电池正极材料锰酸锂(LiMn2O4)的一种流程如下: (1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________________________________________________________________________。 (2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3 等产物。请写出该反应离子方程式:_______________________________________ ________________________________________________________________________。 如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合液的缺点是________________________________________________________________________。 (3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________________________________ ________________________________________________________________________ ________________________________________________________________________。 (4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1∶4混合均匀加热可重新生成LiMn2O4,升温到515 ℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723 ℃)低很多,可能的原因是_________________________________________________ ________________________________________________________________________。 (5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100 ℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_____________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ _________________________________________ _______________________________。 3.解析:(1)废旧电池可能残留有单质锂,锂化学性质活泼,可与空气中的O2和H2O反应,故对拆解环境的要求是隔绝空气和水分。 (2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物,LiMn2O4被还原成Mn(NO3)2,则H2O2被氧化成O2,反应中1 mol LiMn2O4参与反应得到3 mol电子,1 mol H2O2失去2 mol电子,根据得失电子守恒和原子守恒,反应的化学方程式为2LiMn2O4+10HNO3+3H2O2===2LiNO3+4Mn(NO3)2+3O2↑+8H2O,离子方程式为2LiMn2O4+10H++3H2O2===2Li++4Mn2++3O2↑+8H2O。若采用盐酸溶解,盐酸做还原剂被氧化成Cl2,故以盐酸代替HNO3和H2O2混合液的缺点是反应生成Cl2,污染环境。 (5)根据题目提供的试剂分析,制备MnCO3的原理为Mn(OH)2+H2SO4===MnSO4+2H2O、MnSO4+Na2CO3===MnCO3↓+Na2SO4,pH=7.7时开始形成Mn(OH)2沉淀,则加入Na2CO3沉淀Mn2+时需控制溶液pH<7.7;故制备MnCO3的步骤为向Mn(OH)2中加入H2SO4,固体溶解转化为MnSO4溶液,向MnSO4溶液中加入Na2CO3并控制溶液pH<7.7获得MnCO3沉淀;由于“MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100 ℃开始分解”,所以为了减少MnCO3的氧化变质和分解以及溶解损失,过滤分离出MnCO3后,用乙醇洗涤,在低于100 ℃条件下真空干燥。 答案:(1)隔绝空气和水分 (2)2LiMn2O4+10H++3H2O2===2Li++4Mn2++3O2↑+8H2O 反应生成Cl2,污染环境 (3)沿着玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流出,重复操作2~3次 (4)MnO2作为催化剂,降低了碳酸锂的分解温度 (5)H2SO4溶液,固体溶解,加入 Na2CO3,并控制溶液 pH<7.7,过滤,用少量的乙醇洗涤滤渣,在低于100 ℃条件下真空干燥 4.二氯化钴晶体因含结晶水的数量不同而呈现不同的颜色,据此可以判断硅胶(含CoCl2)的干燥能力。AgNO3标准溶液常用作溶液中Cl-的滴定剂。 水合物 CoCl2·6H2O CoCl2·2H2O CoCl2·H2O CoCl2 颜色 粉红 紫红 蓝紫 蓝色 实验一 配制AgNO3溶液 某学生实验需要800 mL 0.1 mol·L-1AgNO3溶液,配制该溶液的步骤:准确称取m g AgNO3固体溶于硝酸溶液中,转入容量瓶中,加入蒸馏水并定容。 (1)m=______。 (2)硝酸溶液的作用是____________。 (3)实验室保存硝酸银溶液的方法是____________________________________________ ________________________________________________________________________。 实验二 测定CoCl2·xH2O组成 (4)滴定法:已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.2×10-12,Ag2CrO4呈砖红色。准确称取2.02 g CoCl2·xH2O样品溶于蒸馏水中配制成250 mL溶液,取25.00 mL配制的溶液于锥形瓶中,滴加几滴K2CrO4溶液做指示剂,用0.1 mol·L-1AgNO3标准溶液滴定至终点,消耗20.00 mL滴定液。 ①x=______。 ②若加入K2CrO4溶液过多,测得的x________(填“偏大”“偏小”或“不变”)。 ③该晶体颜色可能是______(填字母)。 A.蓝色 B.蓝紫色 C.紫红色 D.红色 (5)重量法:取a g CoCl2·xH2O样品按如图装置进行实验,当样品全部失去结晶水后,停止反应。 测得反应前后装置C、D的质量如下: 装置C 装置D 实验前/g m1 m3 实验后/g m2 m4 ①试剂R可能是______(填字母)。 a.无水硫酸铜 b.五氧化二磷 c.无水氯化钙 ②x=________(填字母)。 a. b. 4.解析:(1)实验室没有800 mL容量瓶,应选择1 000 mL容量瓶,m(AgNO3)=1 L×0.1 mol·L-1×170 g·mol-1=17.0 g。(2)硝酸银是强酸弱碱盐,应溶解在硝酸中,以抑制Ag+水解。(3)硝酸银溶液见光易分解,故应密闭保存于棕色试剂瓶中并放在阴凉处。(4)①n(Cl-)=n(Ag+)=0.002 mol,n(CoCl2·xH2O)=0.001 mol,M(CoCl2·xH2O)==202 g·mol-1,x=4。②由溶度积知,氯化银先沉淀,铬酸银后沉淀,如果加入铬酸钾过多,c(CrO)较大,在c(Ag+)较小时即产生铬酸银沉淀,提前到达滴定终点,消耗硝酸银溶液体积偏小,测得相对分子质量偏大,使x偏大。③根据表格中物质颜色,CoCl2·4H2O可能呈红色。(5)①装置D的作用是避免装置E中水蒸气挥发到装置C中且吸收装置C中产生的水,因此试剂R可选用五氧化二磷或无水氯化钙,无水硫酸铜吸水效率差,常用于检验水。②装置E用于吸收尾气中氯化氢,盛装的液体可能是水、氢氧化钠溶液等,水蒸气易挥发到装置D中,计算时应选择装置C中测得的数据。m(H2O)=(m1-m2) g,m(CoCl2)=(m2-m1+a) g,=,解得x=。 答案:(1)17.0 (2)抑制AgNO3水解 (3)密闭保存于棕色试剂瓶中,存放于阴凉处 (4)①4 ②偏大 ③D (5)①bc ②a 5.苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。 已知有机物的相关数据如下表所示: 有机物 沸点/℃ 密度/ g·cm-3 相对分 子质量 溶解性 苯甲醛 178.1 1.04 106 微溶于水,易溶于乙醇、醚和卤代烃 苯甲醇 205.7 1.04 108 微溶于水,易溶于乙醇、醚和卤代烃 二氯甲烷 39.8 1.33 难溶于水,易溶于有机溶剂 实验步骤: ①向容积为500 mL的三颈烧瓶中加入90.0 mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.0 mL苯甲醇、75.0 mL二氯甲烷,不断搅拌。 ②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。 ③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。 ④蒸馏有机混合物,得到2.08 g苯甲醛产品。 请回答下列问题: (1)仪器b的名称为 ,搅拌器的作用是 。 (2)苯甲醇与NaClO反应的化学方程式为 。 (3)步骤①中,投料时,次氯酸钠不能过量太多,原因是 ;步骤③中加入无水硫酸镁,若省略该操作,可能造成的后果是 。 (4)步骤②中,应选用的实验装置是 (填序号),该操作中分离出有机相的具体操作方法是 。 (5)步骤④中,蒸馏温度应控制在 左右。 (6)本实验中,苯甲醛的产率为 (保留到小数点后一位)。 答案 (1)球形冷凝管 使物质充分混合 (2) +NaClO +NaCl+H2O (3)防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 (4)C 打开分液漏斗上面的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯内壁流下,当有机层恰好全部放出时,迅速关闭活塞 (5)178.1 ℃ (6)67.9% 解析 (1)仪器b为球形冷凝管,搅拌器可以使物质充分混合,反应更充分。 (2)根据题意,苯甲醇与NaClO反应,苯甲醇被氧化生成苯甲醛,次氯酸钠本身被还原为氯化钠,反应的化学方程式为+NaClO +NaCl+H2O。 (3)次氯酸钠具有强氧化性,除了能够氧化苯甲醇,也能将苯甲醛氧化,因此步骤①中,投料时,次氯酸钠不能过量太多;步骤③中加入无水硫酸镁的目的是除去少量的水,提高产品的纯度,若省略该操作,产品中混有水,纯度降低。 (4)步骤②中,充分反应后,用二氯甲烷萃取水相3次,萃取应该选用分液漏斗进行分液,应选用的实验装置是C;分液时分离出有机相的具体操作方法为打开分液漏斗上面的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯内壁流下,当有机层恰好全部放出时,迅速关闭活塞。 (5)根据题给相关有机物的数据可知,步骤④是将苯甲醛蒸馏出来,蒸馏温度应控制在178.1 ℃左右。 (6)根据 +NaClO +NaCl+H2O可知,1 mol苯甲醇理论上生成1 mol苯甲醛,则3.0 mL苯甲醇的质量为1.04 g·cm-3×3.0 cm3=3.12 g,其物质的量为,则理论上生成苯甲醛的质量为×106 g·mol-1,苯甲醛的产率=×100%≈67.9%。 6.某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知: 物质 BaSO4 BaCO3 AgI AgCl 溶解度/g (20 ℃) 2.4×10-4 1.4×10-3 3.0×10-7 1.5×10-4 (1)探究BaCO3和BaSO4之间的转化,实验操作如下: 试剂A 试剂B 试剂C 加入盐酸后的现象 实验Ⅰ BaCl2 Na2CO3 Na2SO4 …… 实验Ⅱ Na2SO4 Na2CO3 有少量气泡产生,沉淀部分溶解 ①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后, 。 ②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是 。 ③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因: 。 (2)探究AgCl和AgI之间的转化 实验Ⅲ: 实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。 装置 步骤 电压表 读数 ⅰ.如图连接装置并加入试剂,闭合K a ⅱ.向B中滴入AgNO3(aq),至沉淀完全 b ⅲ.再向B中投入一定量NaCl(s) c ⅳ.重复i,再向B中加入与ⅲ等量NaCl(s) a 注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。 ①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是 (填序号)。 a.AgNO3溶液 b.NaCl溶液 c.KI溶液 ②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 。 ③结合信息,解释实验Ⅳ中b查看更多