- 2021-05-20 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习人教版实验方案的设计与评价作业
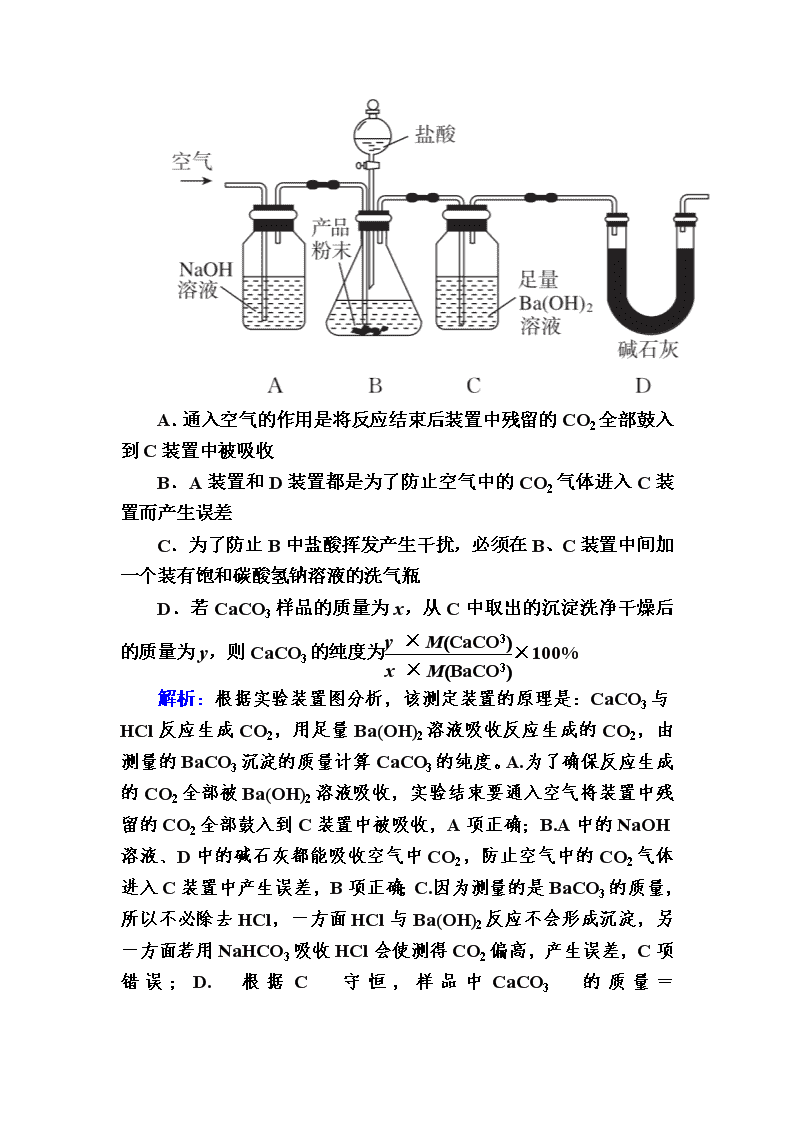
实验方案的设计与评价 时间:45分钟 1.以下各项中,由实验操作及现象不能推出结论的是( B ) 选项 实验操作 现象 结论 A 将甲烷与氯气在光照条件下反应后的混合气体通入紫色石蕊试液中 紫色石蕊试液变红且不褪色 混合气体中含有HCl B 向久置Na2O2粉末中滴加过量的盐酸 产生无色气体 Na2O2没有 变质 C 将5滴 0.1mol/LNa2CO3溶液分别滴入2 mL 0.1 mol/L醋酸溶液和2 mL 0.1 mol/L硼酸溶液中 醋酸溶液中产生气泡,硼酸溶液中无明显现象 酸性:醋酸>碳酸>硼酸 D 向FeCl3溶液中滴入几滴30%H2O2 有气体产生,一段时间后溶液颜色加深 Fe3+能催化H2O2分解且该分解反应为放热反应 解析:A.将甲烷与氯气在光照条件下反应生成甲烷的取代物和氯化氢,氯化氢能够使紫色石蕊试液变红,不褪色说明不是氯气的作用的结果,故A正确;B.久置的Na2O2粉末混有碳酸钠,加盐酸生成无色气体中有氧气和二氧化碳,结论不合理,故B错误;C.醋酸中有气泡产生,硼酸中没有气泡产生,说明醋酸可生成碳酸,酸性比碳酸强,可说明酸性:醋酸>碳酸>硼酸,故C正确;D.FeCl3能够催化H2O2分解放出氧气,一段时间后溶液颜色加深,说明双氧水的分解是放热反应,使铁离子的水解平衡发生了移动,故D正确;故选B。 2.某浅黄色固体XY和焦炭混合,加强热,发生如下反应: 先通入氮气,然后点燃Ⅰ、Ⅲ酒精灯,实验中观察到Ⅰ生成银白色金属,Ⅱ、Ⅳ中溶液变浑浊、Ⅲ中黑色粉末变红色粉末。下列推断不正确的是( C ) A.开始通入氮气的目的是排尽装置中的空气 B.XY与焦炭在高温下反应生成CO2和CO C.X可能是钠,Y一定是氧元素 D.用燃烧法处理Ⅳ排放的尾气 解析:开始通入氮气,排尽装置内空气,避免氧元素干扰实验,A项正确;Ⅱ中溶液变浑浊,说明生成了二氧化碳,Ⅲ中黑色粉末变红色,说明有一氧化碳生成,B项正确;XY不可能是过氧化钠,组成不符,碳不能还原过氧化钠生成钠,可能是氧化铅(浅黄色)粉末,C项错误;尾气中一氧化碳可以用燃烧法、收集法、还原法等处理,D项正确。 3.某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是( C ) A.通入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收 B.A装置和D装置都是为了防止空气中的CO2气体进入C装置而产生误差 C.为了防止B中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶 D.若CaCO3样品的质量为x,从C中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为×100% 解析:根据实验装置图分析,该测定装置的原理是:CaCO3与HCl反应生成CO2,用足量Ba(OH)2溶液吸收反应生成的CO2,由测量的BaCO3沉淀的质量计算CaCO3的纯度。A.为了确保反应生成的CO2全部被Ba(OH)2溶液吸收,实验结束要通入空气将装置中残留的CO2全部鼓入到C装置中被吸收,A项正确;B.A中的NaOH溶液、D中的碱石灰都能吸收空气中CO2,防止空气中的CO2气体进入C装置中产生误差,B项正确;C.因为测量的是BaCO3的质量,所以不必除去HCl,一方面HCl与Ba(OH)2反应不会形成沉淀,另一方面若用NaHCO3吸收HCl会使测得CO2偏高,产生误差,C项错误;D.根据C守恒,样品中CaCO3的质量=× M(CaCO3),则CaCO3的纯度为×100%,D项正确;答案选C。 4.NCl3可用于杀菌、消毒,熔点约为-40 ℃,沸点约为71 ℃,不溶于冷水,在热水中会水解。某学习小组用下列实验装置制备少量NCl3并验证NCl3的部分化学性质。已知:NH4Cl(s)+3Cl2(g)===NCl3(g)+4HCl(g)。下列说法错误的是( D ) A.E装置中冷水的作用是冷却使NCl3液化 B.F中装有碱石灰,目的是除去尾气中的Cl2和HCl,防止污染空气 C.取少许NCl3与水反应后的溶液于试管中,滴加足量NaOH溶液,微热,将湿润的红色石蕊试纸置于试管口,若红色石蕊试纸变蓝,则说明有NH3生成,从而证明NCl3水解 D.试剂b、c、d分别为MnO2、浓硫酸、饱和食盐水 解析:A为制取Cl2的装置,B中装有饱和食盐水,除去Cl2中的HCl,C中装有浓硫酸,干燥Cl2,D为反应制取装置,E为冷却收集NCl3的装置,F中装有碱石灰,是尾气处理装置,NCl3水解生成NH3和HClO。故选D项。 5.NiS可用作陶瓷和搪瓷的着色剂。NiS在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS沉淀,装置如图所示: 下列对实验的叙述正确的是( C ) A.在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C装置中与NiSO4溶液反应 B.装置B中盛放浓硫酸 C.装置D中的洗涤液应用煮沸过的蒸馏水 D.反应结束后继续通入N2可将C装置中产生的沉淀压入过滤沉淀漏斗中 解析:A.NiS在有水存在时能被氧气氧化成Ni(OH)S,在装置A中滴加蒸馏水前通入N2,是为了将除去装置中的空气,故A错误;B.硫化氢能够被浓硫酸氧化,故B错误;C.NiS在有水存在时能被氧气氧化成Ni(OH)S,为了防止被氧化,装置D中的洗涤液应用煮沸过的蒸馏水,故C正确;D.反应结束后继续通入N2可将C装置中产生的H2S赶出吸收,防止污染空气,故D错误;故选C。 6.氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题: (1)写出a中的固体药品的名称____________,制取氨气的原理为__________________________________________________ (结合化学方程式并用简要的文字加以说明)。 (2)恒压滴液漏斗的作用是__________________。 (3)有同学建议CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种):________。 (4)反应器C中发生反应的化学方程式为______________。 (5)双通玻璃管的作用是________;b中溶液的作用是_______。 (6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。设计方案,进行成分探究,请填写表中空格。限选试剂:蒸馏水、稀硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。 实验步骤 预期现象和结论 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 得到无色溶液 步骤2:向试管中加入过量的BaCl2溶液,静置。 溶液不变浑浊,则证明固体中不含有________。 步骤3:取步骤2的上层清液于试管中加入少量的________。 溶液变浑浊,则证明固体中含有________。 解析:由题意结合实验装置可得,三颈烧瓶中产生氨气,锥形瓶中产生CO2,经除杂、干燥后的氨气和CO2在反应器C中反应生成氨基甲酸铵。(1)恒压滴液漏斗中盛有浓氨水,是利用NH3·H2O受热分解产生氨气,所以a中的固体药品可以是新制生石灰或氢氧化钠固体、碱石灰等。(2)a中产生气体,使压强增大,使用恒压滴液漏斗可以平衡漏斗与三颈烧瓶中的压强,使漏斗内液体顺利滴下。(4)氨气和CO2在反应器C中反应生成氨基甲酸铵,化学方程式为2NH3+CO2===H2NCOONH4。(5)双通玻璃管的作用是防止倒吸;锥形瓶中用稀盐酸与碳酸钙制取二氧化碳,二氧化碳中会有氯化氢气体,所以b的作用是吸收氯化氢气体。(6)碳酸铵能与BaCl2溶液反应生成BaCO3沉淀,碳酸氢铵与BaCl2溶液不反应,所以步骤2中溶液不变浑浊,则证明固体中不含(NH4)2CO3;碳酸氢铵能与Ba(OH)2溶液反应生成BaCO3沉淀,所以步骤3中加入的试剂可以是Ba(OH)2溶液,溶液变浑浊,则证明固体中含有NH4HCO3。 答案:(1)新制生石灰(NaOH、碱石灰均可) CaO+NH3·H2O===Ca(OH)2+NH3↑,CaO吸水且放热促进氨气生成(答案合理即可) (2)平衡压强,使漏斗内液体顺利滴下 (3)装置简单,无需干燥;低温环境,提高产率(答其中一点即可) (4)2NH3+CO2===H2NCOONH4 (5)防止倒吸 吸收氯化氢气体 (6)(NH4)2CO3 Ba(OH)2溶液 NH4HCO3 7.为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再滴定测量。实验装置如图所示。 (1)a的作用是________,仪器d的名称是________。 (2)检查装置气密性:_____________________________________ (填操作),关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。 (3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使b中产生的水蒸气进入c。 ①下列物质可代替高氯酸的是________(填序号)。 A.硝酸 B.盐酸 C.硫酸 D.磷酸 ②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将________(填“偏高”“偏低”或“不受影响”)。 ③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是________。 (4)向馏出液中加入V1mL c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1∶1配合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为______________________________________。 (5)用样品进行实验前,需要用0.084 g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________。 解析: (1)a的作用是平衡压强,防止圆底烧瓶中压强过大,引起爆炸。仪器d的名称是直形冷凝管。(2)检查装置气密性时在b和f中加水,使水浸没a和e的末端,从而形成密闭体系。(3)①此实验是利用高氯酸(高沸点酸)将样品中的氟元素转化为HF(低沸点酸)蒸出。硝酸和盐酸易挥发,A、B项错误;硫酸和磷酸沸点高,难挥发,C、D项正确。②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,不影响实验结果。③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是充分吸收HF气体,防止其挥发损失。(5)用样品进行实验前,需要用0.084 g氟化钠代替样品进行实验,改变条件(高氯酸的用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次,该操作的目的是通过做对比实验,寻找最佳的实验条件。 答案:(1)平衡压强 直形冷凝管 (2)在b和f中加水,水浸没导管a和e末端 (3)①CD ②不受影响 ③充分吸收HF气体,防止其挥发损失 (4)×100% (5)寻找最佳实验条件 8.某实验小组为探究KI与Cu(NO3)2的反应,进行实验一: 注:本实验忽略Cu2+在此条件下的水解。 (1)取棕黄色清液,加入少量________溶液(试剂a),清液变为________色,说明生成了I2。 (2)探究生成I2的原因。 ①甲同学进行如下实验:向2 mL 1 mol·L-1KI溶液中加入1 mL________溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,NO氧化了I-。②乙同学认为仅由甲同学的实验还不能得出相应结论。他的理由是该实验没有排除___________________ 氧化I-的可能性。 ③若要证明实验一中是NO氧化了I-,应在实验一的基础上进行检验________的实验。 (3)探究棕黑色沉淀的组成。 ①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设: a.CuI吸附I2;b.________吸附I2。 为证明上述假设是否成立,取棕黑色沉淀进行实验二: 已知:CuI难溶于CCl4;I2+2S2O===2I-+S4O(无色);Cu++2S2O===Cu(S2O3)(无色)。 由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。 ②现象iii为__________________________________________。 ③用化学平衡移动原理解释产生现象ii的原因: ___________________________________________________。 ④由实验二可推知,Cu(NO3)2与KI反应过程中,一定发生反应的离子方程式为______________________________________。 解析:(1)此实验的目的是验证发生氧化还原反应产生了I2,利用淀粉遇碘变蓝进行验证,即试剂a为淀粉溶液,清液变为蓝色,说明生成了I2。 (2)①上述实验中Cu2+有可能氧化I-得到I2,因此需要排除Cu2+的干扰,可向2 mL 1 mol·L-1KI溶液中加入1 mL 2 mol·L-1KNO3溶液(硝酸酸化,pH=1.5),再加入少量淀粉溶液;②溶液中的Cu2+和溶液中溶解的一部分氧气都有可能氧化I-;③根据实验目的,需要检验NO的还原产物。(3)①根据假设a,Cu2+的化合价降低到+1价形成CuI,则也有可能降低到0价形成Cu,因此假设b为Cu吸附I2;②由已知信息知,I2易溶于有机溶剂,而CuI不溶于CCl4,因此实验iii的现象是棕黑色固体颜色变浅,液体变为紫红色;③CuI在溶液中存在沉淀溶解平衡:CuI(s)Cu+(aq)+I-(aq),加入足量Na2S2O3溶液后,S2O与Cu+反应生成Cu(S2O3),使c(Cu+)减小,平衡正向移动,从而使白色沉淀溶解;④因为不考虑Cu2+的水解,根据实验二,Cu2+把I-氧化成I2,自身被还原成+1价的Cu+,Cu+与I-结合形成沉淀,因此反应的离子方程式为2Cu2++4I-===2CuI↓+I2。 答案:(1)淀粉 蓝 (2)①2 mol·L-1NaNO3(或KNO3) ②溶液中的Cu2+,空气中的O2 ③NO的还原产物(或NO、NO2等) (3)①Cu ②棕黑色固体颜色变浅,液体变为紫红色 ③CuI在溶液中存在沉淀溶解平衡:CuI(s)Cu+(aq)+I-(aq),加入足量Na2S2O3溶液后,S2O与Cu+反应生成Cu(S2O3),使c(Cu+)减小,平衡正向移动,从而使白色沉淀溶解 ④2Cu2++4I-2CuI↓+I2查看更多