2020高考化学刷题冲刺(含最新模拟题)专题十八水的电离和溶液的酸碱性讲义
专题十八 水的电离和溶液的酸碱性
考点1 水的电离
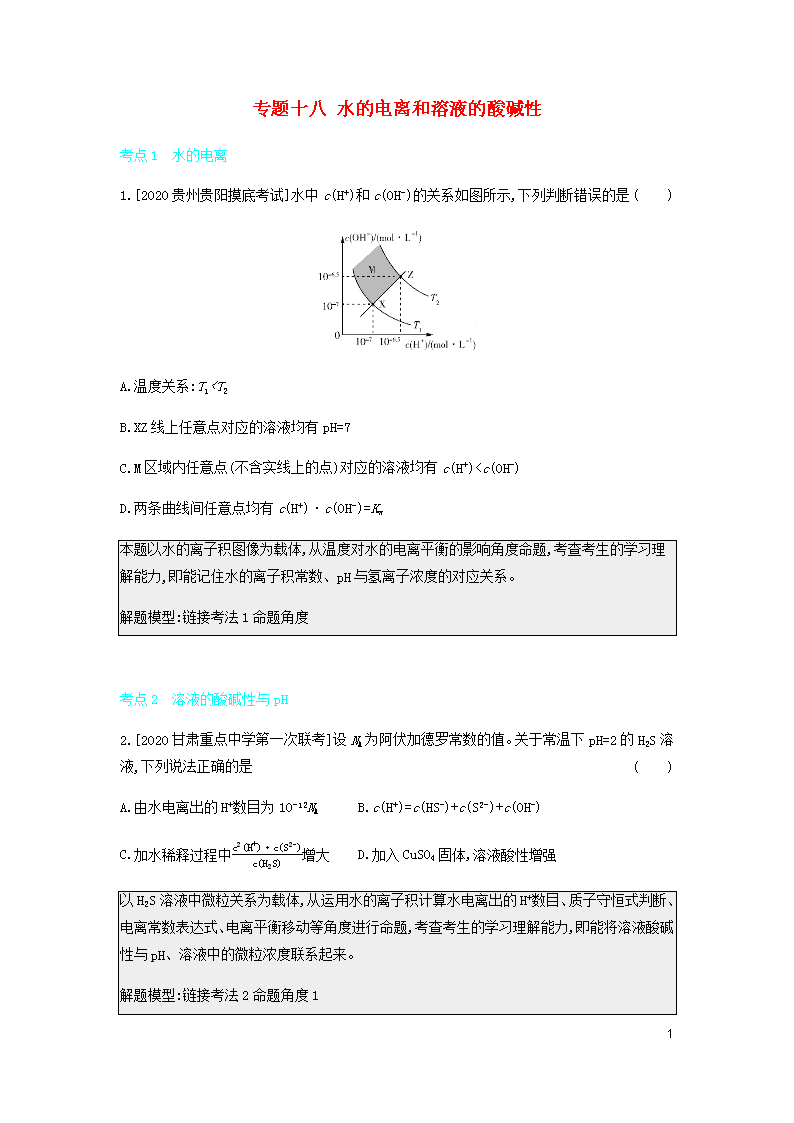
1.[2020贵州贵阳摸底考试]水中c(H+)和c(OH-)的关系如图所示,下列判断错误的是( )
A.温度关系:T1
b>c
C.当V(NaOH溶液)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH溶液)相同时,pH突跃最大的体系中的c(H+)最大
以强酸与强碱中和的图像为载体,从pH与c(H+)或c(OH-)计算、中和反应的突跃与酸碱浓度关系、中和点电荷守恒方向命题,考查考生的应用实践能力。
解题模型:链接疑难7
4.[2019全国卷Ⅰ,11,6分]NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
17
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
本题考查电解质溶液与电离平衡,涉及溶液导电能力的影响因素、混合溶液中离子浓度大小比较、pH判断等知识,考查的核心素养是变化观念与平衡思想。分析图像时,抓住混合溶液的相对导电能力与溶液中离子浓度大小的关系、加入氢氧化钠溶液体积与溶液中离子浓度大小的关系等,结合酸式盐与碱反应的化学方程式分析溶液中溶质的变化。
解题模型:链接考法3命题角度2
5.[2019北京,26,12分]化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L-1 KBrO3标准溶液;
Ⅱ.取v1 mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入v2 mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L-1 Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液v3 mL。
已知:I2+2Na2S2O32NaI+Na2S4O6
Na2S2O3和Na2S4O6溶液颜色均为无色
(1)Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)Ⅱ中发生反应的离子方程式是 。
(3)Ⅲ中发生反应的化学方程式是 。
(4)Ⅳ中加KI前,溶液颜色须为黄色,原因是 。
17
(5)KI与KBrO3物质的量关系为n(KI)≥6n(KBrO3)时,KI一定过量,理由是 。
(6)Ⅴ中滴定至终点的现象是 。
(7)废水中苯酚的含量为 g·L-1(苯酚摩尔质量:94 g·mol-1)。
(8)由于Br2具有 性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
本题以测定废水中的苯酚含量为背景进行命题,在数据处理方面主要依托“氧化还原滴定”的知识,考查考生对信息的收集、处理能力。定量实验是从量的角度考查化学实验,考查考生细心操作、准确计算的能力,在试题中主要体现在物质的称量、物质的分离与提纯、中和滴定、一定物质的量浓度溶液的配制等方面。
解题模型:链接考法3命题角度1
考点1 水的电离
考法1 水的电离平衡的影响因素和水电离出的c(H+)或c(OH-)的计算
命题角度 水的电离图像分析
1 [2015广东,11,4分]一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是
17
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
升温促进水的电离,升温后水溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出Kw=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a变化,C项正确;温度不变,稀释后,c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能到达d点,D项错误。
C
1. [新课标全国卷Ⅰ高考]短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.X+、Y3+ C.Y3+、Z2- D.X+、Z2-
考点2 溶液的酸碱性与pH
考法2 溶液pH的计算及溶液的混合、稀释规律
命题角度1 水的离子积与溶液的pH计算
2 [新课标全国卷Ⅱ高考]室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于
A.12lg (ba) B.12lg (ab)
C.14+12lg (ab) D.14+12lg (ba)
应用Ksp及c(M2+)求c(OH-)应用水的Kw求c(H+)pH
17
本题考查溶度积常数及溶液pH的计算,意在考查考生对溶度积常数的理解能力。根据M(OH)2的Ksp=c(M2+)·c2(OH-),则溶液中c(OH-)=Kspc(M2+)=abmol·L-1,则pH=-lgc(H+)=-lg(10-14÷ab)=-(-14-12lgab)=14+12lgab。
C
2. [2019福建厦门名校质量检测]298 K时,用0.100 mol·L-1盐酸滴定20.00 mL 0.100 mol·L-1 MOH溶液,溶液的pH与所加盐酸体积的关系如图所示(已知:10-1.4≈0.04)。下列说法正确的是( )
A.E点后随着盐酸加入,溶液中水电离的c(H+)·c(OH-)保持不变
B.V=20.00
C.298 K时,向P点对应的溶液中加入少量水稀释,c(OH-)c(M+)保持不变
D.298 K时,Kb(MOH)的数量级为10-2
命题角度2 一元酸和一元碱溶液混合后溶液中的情况判断
3 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b B.混合溶液的pH=7
C.混合溶液中,c(H+)=Kw D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
“一元酸”可能是“一元强酸”或“一元弱酸”,“一元碱”可能是“一元强碱”或“一元弱碱”,只有等物质的量浓度、等体积的“一元强酸”与“一元强碱”混合,才可判定混合溶液呈中性,等物质的量浓度、等体积的其他混合方式(如“一元强酸”与“一元弱碱”等),都不能判定混合溶液呈中性,A项不符合题意;常温时,pH=7的溶液呈中性,温度为T时,pH=7的溶液不一定呈中性,B项不符合题意;若c(H+)=Kw,则c2(H+)=Kw,又Kw=c(OH-)·c(H+),有c2(H+)=c(OH-)·c(H+),c(H+)=c(OH-
17
),故混合溶液呈中性,C项符合题意;无论混合溶液呈酸性、中性、还是碱性,溶液都呈电中性,都存在c(H+)+c(B+)=c(OH-)+c(A-),D项不符合题意。
C
考点3 酸碱中和滴定
考法3 酸碱中和滴定的拓展应用
命题角度1 酸碱中和滴定的拓展应用(热点角度)
4 [2017天津,9,18分]用沉淀滴定法快速测定 NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.025 0 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
17
实验序号
1
2
3
消耗NH4SCN标准溶液体积/mL
10.24
10.02
9.98
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 。
(3)滴定应在pH<0.5的条件下进行,其目的是 。
(4)b和c两步操作是否可以颠倒 ,说明理由 。
(5)所消耗的NH4SCN标准溶液平均体积为 mL,测得c(I-)= mol·L-1。
(6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 。
(7)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 。
(1)配制一定物质的量浓度的标准溶液,除烧杯和玻璃棒外,还需用到的仪器有250mL(棕色)容量瓶、胶头滴管。(2)AgNO3见光易分解,因此需要保存在棕色试剂瓶中。(3)滴定实验中用NH4Fe(SO4)2溶液作指示剂,Fe3+容易发生水解,影响滴定终点判断,因此控制pH<0.5,目的是抑制Fe3+的水解。(4)Fe3+能与I-发生氧化还原反应:2Fe3++2I-2Fe2++I2,因此b、c不能颠倒,否则指示剂耗尽,无法判断滴定终点。(5)第1组数据误差较大,舍去,取第2组、第3组实验数据的平均值,消耗NH4SCN标准溶液的体积为(10.02+9.98)mL×12=10.00mL。根据滴定原理,则n(Ag+)=n(I-)+n(SCN-),故n(I-)=n(Ag+)-n(SCN-)=0.025L×0.1000mol·L-1-0.01L×0.1000mol·L-1=0.0015mol,则c(I-)=0.0015mol0.025L=0.0600mol·L-1。(6)在滴定管中装入NH4SCN标准溶液之前,要先用NH4SCN标准溶液润洗滴定管。(7)①配制AgNO3标准溶液时,若烧杯中溶液有少量溅出,配制的AgNO3标准溶液的浓度偏低,则滴定时消耗的NH4SCN标准溶液的体积偏小,测得的c(I-
17
)偏高。②滴定管0刻度在上,读数时俯视,读取体积偏小,计算所用NH4SCN的物质的量偏低,测得的c(I-)偏高。
(1)250 mL(棕色)容量瓶、胶头滴管 (2)AgNO3见光分解 (3)防止因Fe3+的水解而影响滴定终点的判断(或抑制 Fe3+的水解) (4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点 (5)10.00 0.060 0 (6)用 NH4SCN 标准溶液进行润洗 (7)①偏高 ②偏高
考点扫描
1.[2019全国卷Ⅱ,26(3)改编]立德粉ZnS·BaSO4成品中S2-的含量可以用“碘量法”测得。称取mg样品,置于碘量瓶中,移取25.00mL0.1000mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000mol·L-1Na2S2O3溶液滴定,反应式为I2+2S2O32-2I-+S4O62-。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为 ,样品中S2-的含量为 (写出表达式)。
2.[2018全国卷Ⅲ,26(2)改编]取0.00950mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液 ,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为 %(保留3位有效数字)。
3.[2017全国卷Ⅰ,26(5)改编]凯氏定氮法的原理是用浓硫酸在催化剂存在下将样品中有机氮转化为铵盐,铵盐经处理后,通过滴定测量。已知:NH3+H3BO3NH3·H3BO3;NH3·H3BO3+HClNH4Cl+H3BO3。取某甘氨酸(C2H5NO2)样品m克进行测定,滴定锥形瓶中吸收液(含NH3·H3BO3和指示剂)时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为 %,样品的纯度≤ %。
提示:1.浅蓝色至无色 (25.00-12V)×0.1000×32m×1000×100% 2.蓝色褪去 95.0 3.1.4cVm 7.5cVm
3.[2014重庆,9,15分]中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
17
(1)仪器A的名称是 ,水通入A的进口为 。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) (①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为 g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施 。
命题角度2 导电能力与酸碱中和滴定图像(新角度)
以中和滴定为载体,考查指示剂的选择、滴定过程中溶液酸碱性的变化、导电能力的变化等知识。
5 [2019山西第一次联考试题]电导率越大溶液的导电能力越强。常温下用0.100 0 mol·L-1的盐酸分别滴定10.00 mL浓度均为0.100 0 mol·L-1的NaOH溶液和(CH3)2NH·H2O溶液,已知(CH3)2NH·H2O在水中的电离与NH3·H2O相似,常温下,Kb[(CH3)2NH·H2O]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
A.线①代表滴定NaOH溶液,线②代表滴定(CH3)2NH·H2O溶液
17
B.b、c、e三点对应的溶液中,水的电离程度最大的是e点
C.盐酸滴定(CH3)2NH·H2O溶液的实验中选择甲基橙作指示剂比选酚酞误差更小
D.d点对应的溶液中:c(H+)c[(CH3)2NH·H2O],由质子守恒知c(H+)=c(OH-)+c[(CH3)2NH·H2O],故可得c(H+)Kb(BOH)>Kb(COH)。
(2)盐水解程度强弱:根据“碱越弱,对应的盐越易水解”可得,Kh(ACl)BOH>COH。
6 [2016全国卷Ⅰ,12,6分]298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
17
D.N点处的溶液中pH<12
当恰好完全中和时,生成NH4Cl,而NH4Cl溶液呈酸性,酚酞变色的pH范围为8.2~10.0,甲基橙变色的pH范围为3.1~4.4,故应选甲基橙作指示剂,A项错误;当V(盐酸)=20.0mL时,恰好完全反应,溶液呈酸性,B项错误;M点时由溶液中电荷守恒知c(NH4+)+c(H+)=c(Cl-)+c(OH-),而溶液呈中性,即c(H+)=c(OH-),则c(NH4+)=c(Cl-),但c(NH4+)=c(Cl-)≫c(H+)=c(OH-),C项错误;该温度下,0.10mol·L-1 一元强碱溶液的pH=13,若0.10mol·L-1一元弱碱溶液的电离度为10%,则其pH=12,而0.10mol·L-1氨水的电离度小于10%,故其溶液的pH<12,D项正确。
D
4. [2018浙江4月选考,23,2分]在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中:c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中:2n(CO32-)+n(HCO3-)<0.001 mol
C.在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
突破点2 一元强碱(NaOH)溶液滴定一元弱酸(HA、HB、HC)溶液的图像
若起始溶液c(HA)=c(HB)=c(HC),V(HA溶液)=V(HB溶液)=V(HC溶液)时,基本命题点有:
17
(1)三种弱酸的酸性相对强弱:由V(NaOH溶液)=0时的pH大小可得,Ka(HA)>Ka(HB)>Ka(HC)。
(2)盐水解程度强弱:根据“酸越弱,对应的盐越易水解”可得,Kh(NaA)HB>HC。
7 [2016天津,6,6分]室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是
中和百分数/%
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
本题考查酸碱中和滴定的分析,意在考查考生对滴定过程中粒子变化的分析能力。三种酸的浓度相等,根据图像,在滴定前HA溶液的pH最小,酸性最强,HD溶液的pH最大,酸性最弱,说明HA的电离程度最大,电离常数最大,A项正确。P点溶液中含有等物质的量的NaB与HB,此时溶液显酸性,说明HB的电离程度大于B-的水解程度,所以c(B-)>c(HB),由物料守恒:2c(Na+)=c(HB)+c(B-)知,c(Na+)介于c(B-)、c(HB)之间,B项正确。每种溶液中均存在电荷守恒:c(Na+)+c(H+)=c(X-)+c(OH-),X-代表A-、B-、D-,在pH=7时,c(H+)=c(OH-),c(Na+)=c(X-),而pH=7时,三种酸所消耗的NaOH的物质的量不相等,故三种溶液中c(Na+)不相等,则c(X-)也不相等,C项错误。中和百分数为100%的三种溶液,其溶质分别是NaA、NaB、NaD,混合后溶液中的电荷守恒式为c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-)①,此式中c(Na+)=c(Na+)[NaA]+c(Na+)[NaB]+c(Na+)[NaD],混合前的三种溶液中存在物料守恒:c(Na+)[NaA]=c(A-)+c(HA),c(Na+)[NaB]=c(B-)+c(HB),c(Na+)[NaD]=c(D-)+c(HD),消去①式中的c(Na+)和c(A-)、c(B-)、c(D-),得c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D项正确。
17
C
突破点3 一元强碱(NaOH)溶液滴定二元弱酸(H2A)溶液的图像
基本命题点有
(1)图1:常考Ka1、Ka2的计算或求其数量级。
解题方法:根据曲线交点及对应的pH可求Ka1、Ka2。
(2)图2:常考M、N哪条线表示lg c(HA-)c(H2A)与pH或lg c(A2-)c(HA-)与pH的关系,Ka1、Ka2的计算或数量级。
解题方法:可根据图2中所示的虚线与直线的交点来求,交点处的c(HA-)=c(H2A),c(A2-)=c(HA-),再结合交点对应pH的大小,可知线N表示lgc(HA-)c(H2A),线M表示lgc(A2-)c(HA-)。利用虚线与直线交点对应的pH也可求出Ka1、Ka2或其数量级。
(3)图3:常考哪条线表示-lg c(H+)c(H2A)与-lg c(HA-)或-lg c(H+)c(HA-) 与-lg c(A2-)的关系,Ka1、Ka2的计算或数量级。
解题方法:可根据X、Y点对应的横坐标、纵坐标的值相加之后和的大小来求。Ka1(H2A)≫Ka2(H2A),则X点为一级电离的某一点,设X点横坐标、纵坐标值之和为x,则-lg c(H+)c(H2A)+[-lg c(HA-)]=x,-lg c(H+)·c(HA-)c(H2A)=x,可得Ka1=10-x。同理Y点为二级电离的某一
点,设Y点横、纵坐标值之和为y,则-lg c(H+)c(HA-)+[-lg c(A2-)]=y,-lgc(H+)·c(A2-)c(HA-)=y,可得Ka2=10-y。假设成立。
8 [2017全国卷Ⅰ,13,6分]常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
17
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lgc(HX-)c(H2X)的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
H2X的电离方程式为H2XH++HX-,HX-H++X2-。当c(HX-)c(H2X)=c(X2-)c(HX-)=1时,即横坐标为0.0时,Ka1=c(H+),Ka2=c'(H+),因为Ka1>Ka2,故c(H+)>c'(H+),即pHc(OH-),C项正确;溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),中性溶液中存在c(H+)=c(OH-),故c(Na+)=c(HX-)+2c(X2-),假设c(HX-)
=c(X2-)或c(HX-)>c(X2-)(见C项分析),则溶液一定呈酸性,故中性溶液中c(HX-)
查看更多