- 2021-05-20 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年新教材高中化学课后作业19元素周期表核素新人教版必修第一册
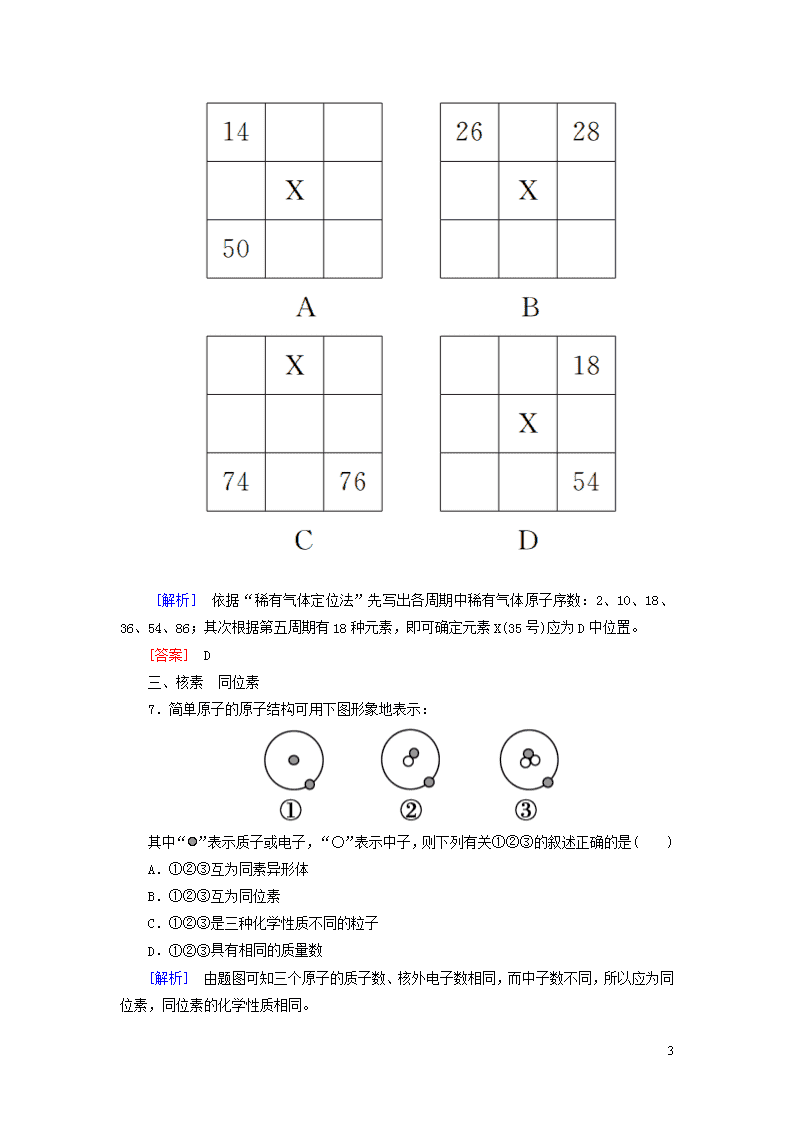
课后作业(十九) [基础巩固] 一、元素周期表的结构 1.下列说法正确的是( ) A.常用元素周期表中元素排序的依据是原子的核电荷数 B.元素周期表有16个纵行,也就是16个族 C.原子的最外层电子数相同的元素,一定属于同一族 D.电子层数相同的粒子,对应元素一定属于同一周期 [解析] 元素周期表中有18个纵行,16个族,第Ⅷ族占3个纵行;Be和He的最外层电子数都是2,但不属于同一族;Ne和Na+的电子层数都是2,但不属于同一周期。 [答案] A 2.主族元素在周期表中的位置取决于该元素的( ) A.相对原子质量和核外电子数 B.电子层数和最外层电子数 C.相对原子质量和最外层电子数 D.电子层数和次外层电子数 [解析] 对主族元素而言,其电子层数就是该元素在元素周期表中的周期序数;其最外层上的电子数就是该元素在周期表中的族序数;由该元素在周期表中的周期和族决定元素的位置。 [答案] B 3.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( ) A.该元素的名称是钠 B.该元素的原子序数为11 C.该元素在地壳中的含量为22.99% D.该元素的元素符号为Na [解析] 8 据图可知,该元素的名称是钠,其元素符号为Na,原子序数为11,相对原子质量为22.99,故选C。 [答案] C 二、元素周期表的应用 4.已知元素的原子序数,可以推断元素原子的( ) ①质子数 ②核电荷数 ③核外电子数 ④离子所带电荷数 A.①③ B.②③ C.①②③ D.②③④ [解析] 原子序数=核电荷数=质子数=核外电子数。 [答案] C 5.几种粒子具有相同的核电荷数,则可说明( ) A.可能属于同一种元素 B.一定是同一种元素 C.一定有相同的原子序数 D.核外电子数一定相等 [解析] 粒子可能是分子、原子、离子,虽然具有相同的核电荷数,但不一定是同一种元素,如CH4与H2O,B错误。核外电子数不一定相等,如Na与Na+、F与F-等,D错误。粒子种类未确定,则不能判定一定是原子,故C不正确。 [答案] A 6.下图各为元素周期表的一部分(数字为原子序数),其中X为35的是( ) 8 [解析] 依据“稀有气体定位法”先写出各周期中稀有气体原子序数:2、10、18、36、54、86;其次根据第五周期有18种元素,即可确定元素X(35号)应为D中位置。 [答案] D 三、核素 同位素 7.简单原子的原子结构可用下图形象地表示: 其中“”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( ) A.①②③互为同素异形体 B.①②③互为同位素 C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数 [解析] 由题图可知三个原子的质子数、核外电子数相同,而中子数不同,所以应为同位素,同位素的化学性质相同。 8 [答案] B 8.下列说法正确的是( ) A.有H、D、T与16O、17O、18O构成的水分子的相对分子质量有18个 B.H2、D2、T2互为同素异形体 C.H2、D2、T2在相同条件下的密度比为1∶2∶3 D.氕、氘发生核聚变反应生成其他元素,属于化学变化 [解析] H、D、T组合H2、D2、T2、HD、HT、DT共6种,分别与16O、17O、18O构成的水分子共有6×3=18种,但其中有相对分子质量相同的分子,故构成的水分子的相对分子质量个数小于18,A错误;H2、D2、T2均为氢气单质,属于一种物质,B错误;H2、D2、T2在相同条件下的密度比等于气体相对分子质量之比,为2∶4∶6=1∶2∶3,C正确;氕、氘发生核聚变反应生成其他元素,属于核反应,不是化学变化,D错误。 [答案] C [能力提升] 9.两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为( ) ①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6 ⑥m-12 ⑦m+14 A.①②④⑤ B.①②③⑤ C.①②③④⑤ D.①②③④⑤⑥⑦ [解析] 两种短周期元素X和Y可组成化合物XY3,则X为ⅢA族元素时,Y为ⅤⅡA族元素;或X、Y均为ⅥA族元素;还有可能为X在ⅤA族,Y为ⅤⅡA族或H;①若Y为Cl,X为Al,则X的原子序数为m-4,故①正确;②若Y为F,X为Al,则X的原子序数为m+4,故②正确;③若Y为S,X为O,则X的原子序数为m+8,故③正确;④若Y为Cl,X为P,则X的原子序数为m-2,故④正确;⑤若Y为H,X为N,则X的原子序数为m+6,故⑤正确;⑥若Y为Cl,X为N,则X的原子序数为m-12,故⑥正确;⑦若Y为H,X为P,则X的原子序数为m+14,故⑦正确;故答案为D。 [答案] D 10.0.05 mol某金属单质与足量的盐酸反应,放出1.12 L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( ) A.第三周期ⅠA族 B.第三周期ⅡA族 C.第四周期ⅠA族 D.第四周期ⅡA族 [解析] 设该金属单质与盐酸反应所表现的化合价为+x价,则0.05x=×2,x=2。根据题意,该金属单质为Ca,位于第四周期ⅡA族。 8 [答案] D 11.据相关报道,在日本生产的婴儿奶粉中检测到铯的人工放射性核素。下列说法正确的是 ( ) A.133Cs的核电荷数为133 B.133Cs+核外有54个电子 C.133Cs质子数比137Cs少4个 D.铯与水的反应比钠与水的反应缓慢 [解析] A项,核电荷数等于原子序数为55,错误;B项正确;C项,质子数决定元素种类,133Cs和137Cs质子数相等,错误;D项,Cs的金属性比Na强,与水反应更剧烈,错误。 [答案] B 12.X、Y、Z均为短周期元素,它们在周期表中的相对位置如图所示。已知X、Y、Z三种元素的质子数之和为40,则X、Y、Z分别是( ) X Y Z A.N、S、Cl B.B、Si、P C.C、P、S D.Be、Al、Si [解析] 设Y的质子数为n,则X、Z的质子数分别为n-8-1,Z为n+1。由题意知,n-8-1+n+n+1=40,n=16,即Y为硫元素,X为氮元素,Z为氯元素。 [答案] A 13.结合元素周期表回答下列问题: (1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。 8 (2)表中所列元素,属于短周期元素的有________,属于主族元素的有________;g元素位于第________周期第________族;i元素位于第________周期第________族。 (3)元素f是第________周期第________族元素,请在下面方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。 [解析] (1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期各有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。(3)第三周期笫ⅥA族元素为硫,原子序数为16,相对原子质量为32。 [答案] (1) (2)a、b、c、d、e、f、g a、b、d、c、e、f 三 0 四 ⅡB (3)三 ⅥA 14.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题: (1)Fe原子的核内中子数为________,该原子的核外电子数为________。 8 (2)以下关于Fe的叙述正确的是________(填字母)。 A.Fe与Fe是两种核素 B.科学家获得了一种新元素 C.Fe的衰变不是化学变化 D.这种铁原子衰变放出两个质子后变成Fe (3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是________________________________________________。 [解析] (1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素;Fe元素不是一种新元素,Fe衰变放出两个质子后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质。 [答案] (1)19 26 (2)AC (3)Fe与Fe的核外电子排布相同,化学性质几乎完全相同 15.下表是元素周期表的一部分,针对表中的①~⑨9种元素,填写下列空白: 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 二 ① ② ③ 三 ④ ⑤ ⑥ ⑦ ⑧ 四 ⑨ (1)写出元素符号和名称: ①________,②________,⑧________,⑨________。 (2)写出下列反应的化学方程式: ⑦的单质跟④的氢氧化物溶液反应:_____________________。 ⑤的氧化物跟④的氢氧化物溶液反应:________________。 ⑥的单质在③的单质中燃烧:__________________。 [解析] 根据元素周期表的位置可推知:①~⑨分别为C、N、O、Na、Al、S、Cl、Ar、K。 [答案] (1)①C碳 ②N氮 ⑧Ar氩 ⑨K钾 (2)Cl2+2NaOH===NaCl+NaClO+H2O Al2O3+2NaOH===2NaAlO2+H2O S+O2SO2 8 8查看更多