- 2021-05-20 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省商丘市第一高级中学2019-2020高二上学期期末考试化学试卷
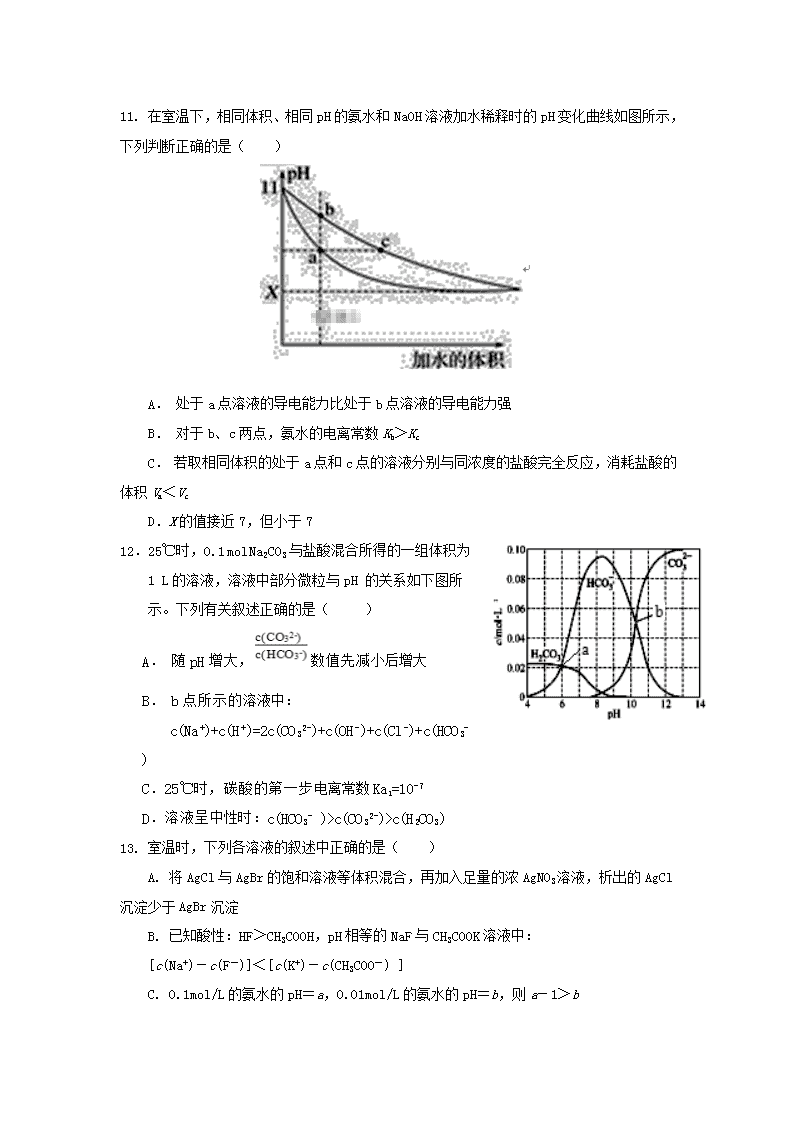
化学试题 注意事项: 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分; 1. 答题前,考生务必将自己的姓名、学号填写在答题卡上。选择题使用2B铅笔填涂在答题卡上,非选择题部分使用0.5毫米的签字笔完成;考试结束后,只交答题卡,试卷考生保存。 用到的相对原子质量:H:1 C:12 O:16 Na: 23 Al:27 S:32 Cl:35.5 Fe:56 第I卷(共48分) 一、选择题(每小题只有一个正确答案,每小题3分) 1. 化学与科学、技术、社会、环境关系密切,下列说法正确的是( ) A. 明矾既能沉降水中的悬浮物,又能杀菌消毒 B. NH4Cl溶液可用作焊接时的除锈剂 C. 轮船船底四周镶嵌铜块以保护船体 D. 电解熔融氯化铝可以得到铝 2.港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是 A. 防腐原理主要是避免发生反应:2Fe+O2+2H2O==2Fe(OH)2 B. 钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池 C. 采用外加电流的阴极保护时需外接镁、锌等作辅助阳极 D. 钢构件可采用不锈钢材料以减缓电化学腐蚀 3.下列说法或表示方法中正确的是() A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B.由C(金刚石)===C(石墨)ΔH= -1.9 kJ·mol-1 可知,金刚石比石墨稳定 C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=285.8 kJ·mol-1 D.稀溶液中:H+(aq)+OH-(aq)===H2O(l)ΔH=-53.7 kJ·mol-1 ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7 kJ 4.现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( ) A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大 B.若混合前三种溶液pH相等,酸碱恰好完全反应,则V3>V1>V2 C.若混合前三种溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3 D.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 5. 下列事实不能用勒夏特列原理解释的是( ) A. 加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多 B. 工业生产硫酸,通入过量的空气,提高二氧化硫的转化率 C. 久置氯水pH变小 D. 温度升高,Kw增大 6. 现有的氨合成气,液体燃料合成气制备工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备氨合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是( ) A.膜I侧相当于原电池的正极 B.O2和H2O均发生还原反应 C.膜Ⅱ侧发生的反应为: CH4+O2―-2e-==2H2+CO D.膜Ⅱ侧消耗CH4与膜I侧生成H2的物质的量之比为1:2 7.25℃时,在pH均为9的NaOH和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为( ) A. A=10-4B B. A>BC. B=10-4 A D.A=B 8.下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是( ) ①改变气体物质的浓度 ②改变气体的压强 ③加入催化剂 ④改变气体的温度 A.只有③④ B.只有①② C.只有①③④ D.①②③④ 9.下列设计的实验方案能达到实验目的的是( ) A. 制取无水AlCl3:将AlCl3溶液加热蒸干并灼烧 B. 除去锅炉水垢中含有的CaSO4:先用Na2CO3溶液处理,然后再加酸去除 C. 证明氨水中存在电离平衡:向滴有酚酞的氨水中加入少量NH4Cl固体,溶液红色变深 D. 配制FeCl3溶液时为防止溶液浑浊常加入少量稀硫酸 10.25℃、101 kPa时,若pH=a的10体积的某强酸溶液与pH=b的1体积的某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系是( ) A.a+b=14 B.a+b=13 C.a+b=15 D.a+b=7 11. 在室温下,相同体积、相同pH的氨水和NaOH溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( ) A. 处于a点溶液的导电能力比处于b点溶液的导电能力强 B. 对于b、c两点,氨水的电离常数Kb>Kc C. 若取相同体积的处于a点和c点的溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积Va<Vc D.X的值接近7,但小于7 12.25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是( ) A. 随pH增大,数值先减小后增大 B. b点所示的溶液中: c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- ) C.25℃时,碳酸的第一步电离常数Ka1=10-7 D.溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3) 13. 室温时,下列各溶液的叙述中正确的是( ) A. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀 B. 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中: [c(Na+)-c(F-)]<[c(K+)-c(CH3COO-) ] C. 0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b D. 0.10mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-) 14.利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g)5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( ) A. b点时,CO的转化率为20% B. 容器内的压强保持恒定,表明反应达到平衡状态 C. b点和d点的化学平衡常数:Kb>Kd D. 0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-1 15.常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知=0.58)。下列分析不正确的是( ) A.a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态 B.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-) C.饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊 D.石灰乳与0.1mol/LNa2WO4溶液混合后发生反应: Ca(OH)2+WO42-=CaWO4 +2OH- 16.具有下列电子层结构的原子或离子,其对应的元素在周期表中的位置说法正确的是() A. 3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族 B. 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族 C. 最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6 的离子,所对应的两元素一定在同一周期 D. 原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期 第II卷(共52分) 二.填空题 17.(18分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。 I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧生成液态水时所放出的热量); N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol H2O(g) =H2O(l) △H=- 44 kJ/mol 催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为 Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g)+3H2(g)CH3OH(l) + H2O(l)。 (1)①该反应自发进行的条件是______(填“低温”“高温”或“任意温度”)。 ②下列叙述能说明此反应达到平衡状态的是______。 a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变 c.CO2和H2的转化率相等 d.混合气体的密度保持不变 e.1 mol CO2生成的同时有3 mol H—H键断裂 ③CO2的浓度随时间(0~t2)的变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6的浓度随时间的变化。 (2)改变温度,使反应CO2(g)+3H2(g)CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表: 反应时间 CO2 (mol) H2(mol) CH3 H2O(mol) OH(mol) 反应I 恒温恒容 0 min 2 6 0 0 10 min 4.5 20min 1 30 min 1 反应II绝热恒容 0 min 0 0 2 2 ①达到平衡时,反应I、II对比:平衡常数K( I ) ______K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。 ②对反应I,前10 min内的平均反应速率v(CH3OH) =________,在其他条件不变下,若30 min时只改变温度为T2℃,达到平衡时H2的物质的量为3.2 mol,则T1_____T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。 18.(10分)(1)在常温下,0.5mol甲醇在氧气中完全燃烧生成CO2和液态水,放出热量363.3kJ.写出该反应的热化学方程式: (2)请设计一个燃料电池:电解质为强碱溶液,Pt作电极,在电极上分别通入甲醇和氧气。通入甲醇的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。 (3)电化学降解NO2-的原理如下图: ①电源的负极是 (填A或B)阴极反应式为 。 ②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差为 g。 19. (14分)已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略) 醋酸 碳酸 氢氰酸 Ka=1.7×10-5 Ka1=4.2×10-7 Ka2=5.6×10-11 Ka=6.2×10-10 (1)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为 (填序号)。 (2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为 。 (3)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是 。 a.c(H+)查看更多