- 2021-05-20 发布 |
- 37.5 KB |
- 16页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习浙江选考化学真题专项训练题组(第27题)
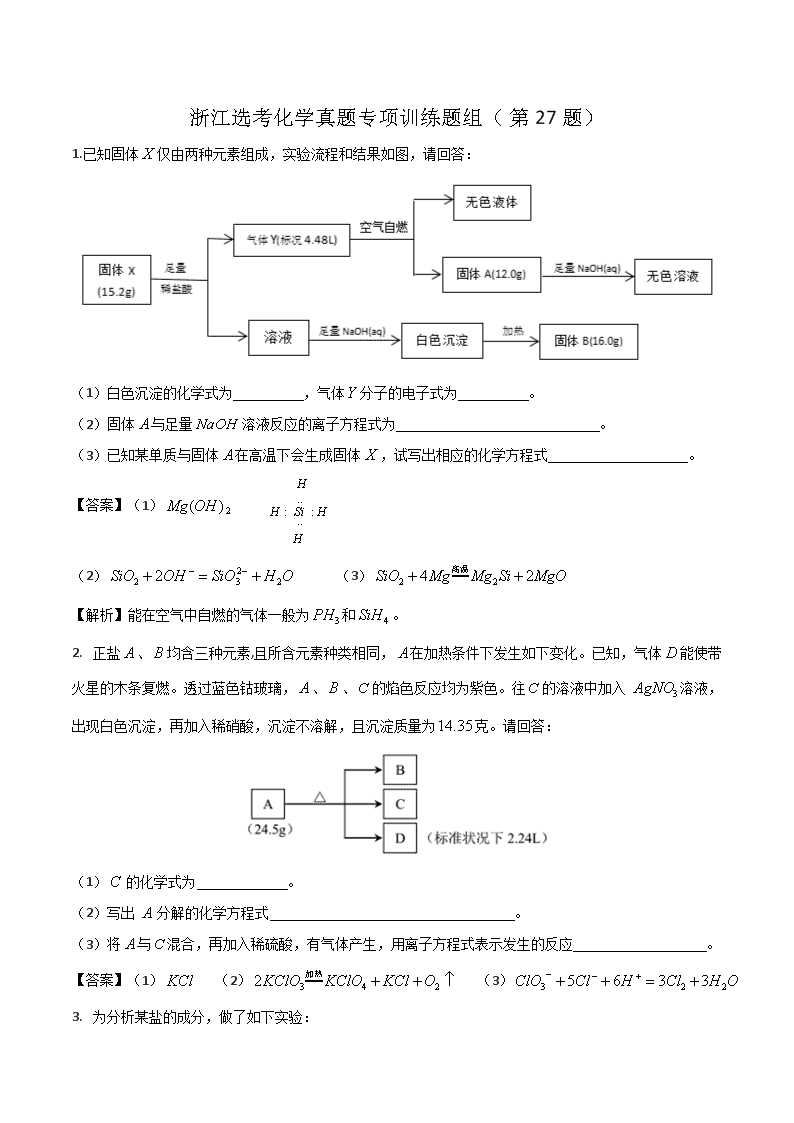
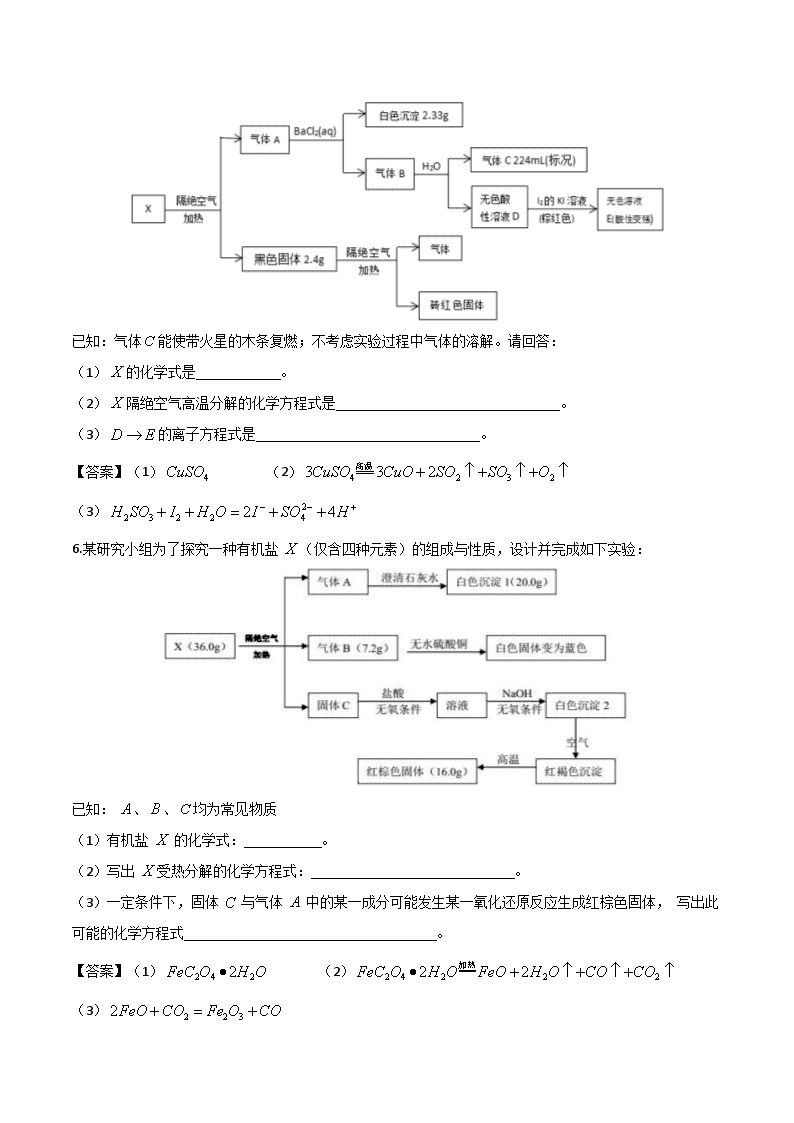
浙江选考化学真题专项训练题组(第27题) 1.已知固体仅由两种元素组成,实验流程和结果如图,请回答: (1)白色沉淀的化学式为 ,气体分子的电子式为 。 (2)固体与足量溶液反应的离子方程式为 。 (3)已知某单质与固体在高温下会生成固体,试写出相应的化学方程式 。 【答案】(1) (2) (3) 【解析】能在空气中自燃的气体一般为和。 2. 正盐、均含三种元素,且所含元素种类相同,在加热条件下发生如下变化。已知,气体能使带火星的木条复燃。透过蓝色钴玻璃,、、的焰色反应均为紫色。往的溶液中加入 溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解,且沉淀质量为克。请回答: (1) 的化学式为 。 (2)写出 分解的化学方程式 。 (3)将与混合,再加入稀硫酸,有气体产生,用离子方程式表示发生的反应 。 【答案】(1) (2) (3) 3. 为分析某盐的成分,做了如下实验: 请回答: (1)盐 的化学式是 ; (2)被 吸收的气体的电子式 ; (3)向溶液中通入气体,有淡黄色沉淀产生,写出反应的离子方程式 (不考虑空气的影响)。 【答案】(1) (2) (3) 2. 为探究矿石样品(仅含两种元素)的组成和性质,设计并完成如下实验: 已知:溶液中只含一种金属阳离子,与铁粉充分反应后固体质量减少。 请回答: (1)样品的化学式为 。 (2)写出气体与溴水反应的离子方程式 。 (3)写出样品与盐酸发生氧化还原反应的化学方程式 。 【答案】(1) (2) (3) 5.某研究小组为探究某无机盐(仅含三种元素)高温分解下的产物,设计并完成如下实验: 已知:气体能使带火星的木条复燃;不考虑实验过程中气体的溶解。请回答: (1)的化学式是 。 (2)隔绝空气高温分解的化学方程式是 。 (3)的离子方程式是 。 【答案】(1) (2) (3) 6.某研究小组为了探究一种有机盐 (仅含四种元素)的组成与性质,设计并完成如下实验: 已知: 、、均为常见物质 (1)有机盐 的化学式: 。 (2)写出 受热分解的化学方程式: 。 (3)一定条件下,固体 与气体 中的某一成分可能发生某一氧化还原反应生成红棕色固体, 写出此可能的化学方程式 。 【答案】(1) (2) (3) 7.某研究小组为了探究一种浅绿色盐(仅含四种元素,不含结晶水,)的组成和性质,设计并完成了如下实验 取一定量的浅绿色盐进行上述实验,充分反应后得到白色沉淀、红色固体和红色固体。 已知:①浅绿色盐在、隔绝空气条件下受热分解为非氧化还原反应. ②常温下呈液态且1个分子含有10个电子。请回答如下问题: (1) 写出分子的电子式 ;的化学式是 。 (2)在隔绝空气、温度下加热至完全分解的化学反应方程式为 。 (3)请写出溶于溶液的离子方程式 。 【答案】(1) (2) (3) 8.为探究不溶盐(仅含四种元素)的组成和性质,设计并完成如下实验: 请回答: (1)的组成元素除、外,还含有 (用元素符号表示),其化学式为 。 (2)写出红棕色固体与溶液反应的离子方程式 。 【答案】(1) (2) 9. 为探究带有结晶水的复盐晶体(共含五种元素)的组成和性质,设计并完成如下实验:: 已知:气体可使湿润的红色石蕊试纸变蓝色。请回答: (1)含有的元素有、、、 (用元素符号表示),则的化学式为 。 (2)若要通过非氧化还原反应来一步合成,请写出化学方程式 。 【答案】(1)、 (2) 10.为了探究不溶性盐(仅含五种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。 请回答: (1)的组成元素为、和 (用元素符号表示),气体的电子式为 。 (2)写出反应①的离子方程式 。 【答案】(1)、、 (2) 11.磁性材料由两种元素组成,为探究其组成和性质,设计并完成了如下实验: 请回答: (1)白色沉淀的物质的量是 。 (2)的化学式为 。 (3)用离子方程式表示气体与氯水反应生成的过程: 。 答案:(1) (2) (3) 本题以磁性材料为载体考查无机推断。无色气体与足量的氯水反应得到溶液,中加入氯化钡溶液和盐酸,有白色沉淀生成,故为,其物质的量为。溶液为硫酸和盐酸的混合液,为二氧化硫。是由两种元素组成的磁性材料,可知为氧化铁。氧化铁的质量为,其物质的量为,含铁元素的物质的量为,铁元素与硫元素的物质的量之比为,则的化学式为。二氧化硫与氯水反应的离子方程式为。 12.某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。为研究其组成,某小组同学进行了如下实验。 已知:;甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定。 (1)甲的化学式为 。 (2)乙能使品红溶液褪色的原因是 。 (3)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学方程式: 。 答案:(1) (2)与品红结合生成不稳定无色化合物 (3) 本题考查无机物的推断。(1)甲的焰色为黄色,说明甲中含有 元素;盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为,生成的淡黄色沉淀为,则丙、丁中的一种为;反应①生成的二氧化硫的物质的量为,硫的物质的量为,而中生成的、的物质的量相等,故丙、丁中的一种为,发生反应:,该反应生成的的物质的量为,结合方程式可知,的物质的量为,的物质的量为;甲分解得到的二氧化硫的物质的量为。根据原子守恒可知,甲中:,,,则甲中含有、、,故甲的化学式为。(2)乙为,具有漂白性,能使品红溶液褪色的原因是:能与品红结合生成不稳定无色化合物。(3)溶液与少量氧气反应产生等物质的量的两种酸式盐,分别为、,化学方程式为。 13.暗紫色化合物具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物进行组成分析,确定中仅含有、、三种元素。取化合物的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐。 (1)化合物的化学式为 。 (2)化合物的制备还可通过氧化法,试写出在存在条件下用次氯酸钾氧化氢氧化铁制备的化学方程式: 。 (3)目前。人们针对化合物的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物水溶液稳定性都是 。 亚硫酸钠 醋酸 答案:(1) (2) (3) 本题考查物质的组成、结构、性质及用途。根据题意可知,该化合物与水发生反应产生的红褐色沉淀为,气体为。(1)沉淀充分灼烧后得到的红棕色粉末是,,。滤液在一定条件下蒸发得到的纯净的不含结晶水的盐是,质量为,则,所以中含有的的物质的量为,,所以,因此在化合物中、、的原子个数比为,故化学式为。(2)在存在条件下用次氯酸钾氧化氢氧化铁制备的化学方程式为。(3)因为在水溶液中发生离子反应:,所以要提高其稳定性,应该使溶液显碱性。亚硫酸钠、溶液呈碱性,但亚硫酸钠有还原性,有强氧化性,二者会发生氧化还原反应,不能共存,因此有可能提高化合物水溶液稳定性的物质可能是。 14.化合物是重要的催化剂。化合物受热完全分解,只得到气体产物和固体产物。经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由、两种元素组成,且摩尔质量:。元素原子的最外层电子数是次外层电子数的2倍,元素的主族序数是其所在周期数的3倍。经分析,固体产物只有、和。某同学再进行以下定量分析: (1)甲的化学式为 。 (2)溶液②与发生氧化还原反应的离子方程式: 。 (3)由以上实验数据的分析可知 。 答案:(1) (2) (3) 本题考查元素化合物的推断。(1)元素原子的最外层电子数是次外层电子数的2倍,元素的主族序数是其所在周期数的3倍,经分析,是碳元素,是氧元素,因为摩尔质量:,所以甲是,乙是。(2)固体②为、,和硫酸反应后溶液中存在,滴入高锰酸钾溶液,反应的离子方程式为。(3)和稀硫酸反应产生的气体(标准状况),即气体的物质的量为,的物质的量为;固体②为、,分为两等份,一份和硫酸铜反应增重,根据: 解得 ,则固体②中;另一份和稀硫酸反应后用高锰酸钾溶液滴定,消耗高锰酸钾,根据,知,其中由生成的占,则为,固体②中。综上所述,。 15.物质是某新型净水剂的中间体,它可以看成由氯化铝(在升华)和一种盐按物质的量之比组成。在密闭容器中加热使之完全分解,冷却后可得到固体氧化物、(标准状况)无色气体和混合晶体。溶于稀盐酸后,滴加溶液,混合液变血红色。气体能使品红溶液褪色。 (1)的化学式为 。 (2)将固体隔绝空气充分灼烧,使其分解,生成等物质的量的、和另一种化合物,则分解的化学方程式为 。 (3)混合晶体中,某种物质在一定条件下能和固体反应,写出该反应的化学方程式: 。 答案:(1) (2) (3) 本题考查无机物的推断。根据题中信息,溶于稀盐酸后,滴加溶液,混合液变血红色,则氧化物为;气体能使品红溶液褪色,则为;可以看成由氯化铝(在升华)和一种盐 按物质的量之比组成,根据元素守恒可知,中含有铁、硫、氧、氯、铝元素,加热分解能生成氧化铁和二氧化硫,则盐为,所以的组成为。加热即,可得到氧化铁和二氧化硫,还有混合晶体,其中含有氯化铝,的质量为,根据原子守恒可知,剩余,所以为和的混合物。(1)根据上述分析,的化学式为。(2)隔绝空气充分燃烧,分解生成等物质的量的、氧化铁和,化学方程式为。(3)混合晶体中的具有氧化性,在一定条件下能和固体反应生成碘单质和亚硫酸钾,该反应的化学方程式为。 16.某研究小组为了探究某白色粉末状固体化合物(仅含四种元素)的组成和性质,称取固体,设计并完成了如下实验: 已知: 请回答下列问题: (1)的化学式是 。 (2)生成砖红色沉淀的原因是 (用化学方程式表示)。 (3)有人提出在加热条件下,用氢气还原砖红色沉淀得到产物中仍可能含有砖红色物质,请设计实验方案验证: 。 答案:(1) (2) (3)取少量反应产物于试管中,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物中含有;若溶液不变蓝色,证明产物中不含。 本题考查定性与定量分析相结合的无机推断。(1)气体甲是氨气(),气体乙是二氧化碳(),该物质能和新制氢氧化铜反应产生砖红色沉淀,说明含有醛基,且生成氧化亚铜的物质的量为,说明中只有醛基,综合分析知, 为。(2)溶液1中含,与新制氢氧化铜反应的化学方程式为。 17.某金黄色针状晶体盐由三种元素组成,在室温下易分解为盐和固体,其相关的转化关系如图所示(所有产物均已标出)。 已知:①固体与溶液反应时,反应物按的物质的量之比进行反应;②固体可由与单质化合制得。 请回答: (1)的化学式为 。 (2)写出化合物与反应的化学方程式: 。 (3)在氯酸钾与碘单质混合物中加入浓盐酸制备盐,写出该反应的离子方程式: 。 答案:(1) (2) (3) 本题考查元素化合物的相关知识。(1)因为固体由氯气和单质化合而来,再结合固体与按的物质的量之比进行反应生成盐与单质,可知为氯与碘的化合物,其分子式为,为,为氯化钾;再根据分解生成和,可确定的化学式为。(3)根据原料与产物的元素组成及元素化合价的变化,推出该制备反应的离子方程式为。 18.为了确定某物质的化学式(含五种元素),某兴趣小组设计了如下实验: 请回答: (1)溶液中溶质的化学式为 ,的电子式为 。 (2)物质受热分解的化学方程式为 。 (3)红褐色沉淀能溶于溶液,并发生氧化还原反应,写出该反应的离子方程式: 。 答案:(1) (1) (3) 本题考查常见无机物的性质和定性推理、定量计算。依据流程图可推知,是,物质的量为,物质中含有;是,说明物质中含有。溶液中含有、,根据电荷守恒及焰色反应呈紫色知还含有,因此溶液中的溶质是、,且两者的物质的量之比为,物质中含有。根据分解产生水的质量和物质中各元素化合价的代数和为零,可推知物质中还含有,故物质的化学式为。 19.是由镁及另外三种元素组成的化合物,某研究小组按如图流程探究其组成: (1)的化学式为 。 (2)由转化为的离子方程式为 。 (3)写出受热分解反应的化学方程式: 。 答案:(1) (2) (3) 本题考查定性与定量结合的无机推断,陌生化学方程式的书写。无色无味气体通过浓硫酸后浓硫酸增重 ,该气体是的水蒸气,无色溶液加足量溶液生成白色沉淀,为的氢氧化镁;残渣为的氧化镁;白色沉淀为;氯元素的质量为,即。由、、、原子的最简整数比为,得的化学式为。 20.化合物是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,以上时分解生成3种氧化物,为固体。 (1)写出的电子式: 。 (2)写出化合物分解的化学方程式: 。 (3)判断化合物是否完全分解所需要的实验操作是 。 答案:(1) (2) (3)加热,冷却、称重,重复操作至恒重或前后两次称重的质量差不超过 本题考查含结晶水的碱式碳酸盐的分解,物质的推断等。(1)由实验现象可知,气体是二氧化碳,二氧化碳的电子式为。(2)由实验数据可得,,,由电荷守恒知,可得,则氢氧根离子转化得到的水的物质的量为,则结晶水物质的量为,所以的化学式为,分解的化学方程式为。 21.某研究性学习小组拟探究的热稳定性,进行如下操作: 上述所列物质都是纯净物,请回答: (1)的结构式为 ,白色固体的化学式为 。 (2)已知的摩尔质量为,完成缓慢加热分解的化学方程式: 。 (3)最简单制取白色固体的化合反应方程式是 。 答案:(1) (2) (3) 本题考查元素及其化合物知识。(1)气流是气流,作保护气,抑制加热过程中水解;是,温度高于,再次分解,白色固体只能是。(3)生成最简单的化合反应是。 22.为探究某固体矿物的组成和性质,现设计并完成如下实验: 已知:①矿物中仅含4种短周期元素;②固体乙可制光导纤维。请回答: (1)除了含有、元素以外还含有 元素。 (2)的化学式是 。 (3)固体甲与稀硫酸反应的离子方程式是 。 答案:(1)、 (2)或或 (3)或 23.某矿物的主要成分 由三种元素组成,其由两种化合物融合而成,为了测定其组成,进行如下实验,其中石英砂的成分为,主要用途是造渣。 请回答下列问题: (1)的组成元素为 ,的化学式为 。 (2)写出由溶液得到溶液的离子方程式: 。 (3)液态遇水会爆炸,是因为与水反应能生成可燃性气体。其中金属的化合物与水反应生成、气体和一种可燃性气体单质,试写出中金属的化合物与水反应的化学方程式: 。 答案:(1)、、 (2) (3) 24.为探究某矿物(仅含三种元素)的组成与性质,设计并完成了如下实验: 请回答: (1)气体的化学式为 ,的化学式为 。 (2)与空气中反应得到和的化学方程式为 。 (3)气体与溶液反应的离子方程式为 。 答案:(1) (2) (3) 25.为探究某无机矿物盐(仅含四种元素)的组成和性质,某研究小组设计并完成了如下实验: 已知:溶液中加入溶液无明显现象。请回答下列问题: (1)白色沉淀的化学式为 。 (2)隔绝空气加热至完全分解的化学方程式为 。 (3)一定条件下,气体甲与固体可发生氧化还原反应,写出一个可能的化学方程式: 。 答案:(1) (2) (3)或 26.为探究深红色固体甲(含三种元素)的组成和性质,设计并完成了如下实验: 请回答: (1)固体甲的化学式是 。 (2)气体乙转化为沉淀丁的离子方程式是 。 (3)固体丙与加热反应的化学方程式是 。 答案:(1)() (2) (3)查看更多