2020届化学高考二轮复习(浙江)金属及其化合物学案
第 1 讲 金属及其化合物
[考试说明]
知识内容 考试要求
(1)化学理论的建立和发展与人类认识世界的关系 a
(2)化学科学的研究内容和发展前景 a
(3)化学在合成新物质、提高人类生活质量方面的重要作用 a
(4)金属活动性与金属冶炼方法的关系 a
(5)钠、镁的物理性质及用途 a
(6)钠、镁的化学性质(跟非金属、酸、某些氧化物的反应) c
(7)钠、镁的生产原理 b
(8)碳酸钠、碳酸氢钠的性质及检验方法 c
(9)碳酸钠、碳酸氢钠的用途 a
(10)有关化学方程式过量问题的计算 b
(11)过氧化钠的主要性质 c
(12)地壳中铝的含量及存在形式,铝合金 a
(13)从铝土矿中获得铝的方法 b
(14)铝的重要性质(跟酸、碱反应,铝热反应,钝化现象) b
(15)两性氧化物、两性氢氧化物的概念,Al2O3、Al(OH)3 的重要性质 c
(16)明矾的组成及净水原理 b
(17)自然界铁、铜的存在形式,铁、铜的物理性质 a
(18)工业炼铁的反应原理 b
(19)铁、铜的化学性质(跟某些非金属、酸、盐的反应) b
(20)Fe2+、Fe3+的性质 c
(21)检验 Fe2+、Fe3+的常用方法 c
(22)不锈钢的主要组成元素及其用途 a
常见金属元素的存在与制备原理[学生用书 P25]
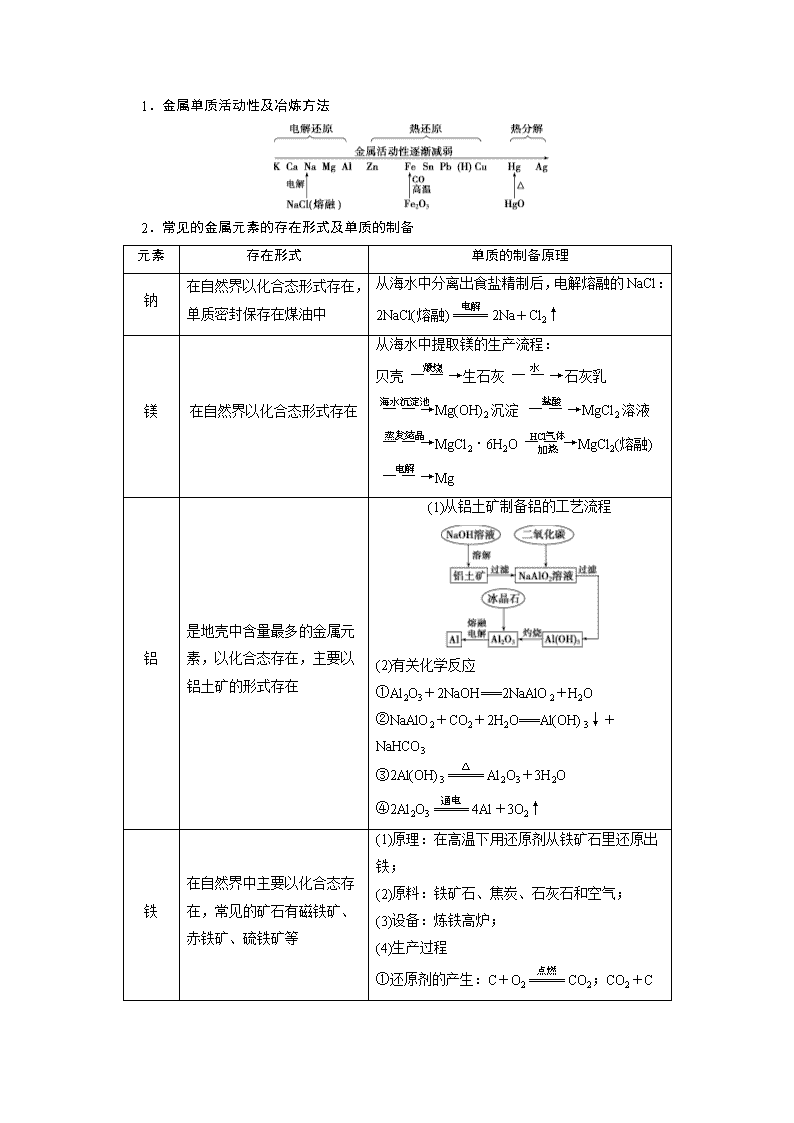
1.金属单质活动性及冶炼方法
2.常见的金属元素的存在形式及单质的制备
元素 存在形式 单质的制备原理
钠
在自然界以化合态形式存
在,单质密封保存在煤油中
从海水中分离出食盐精制后,电解熔融的 NaCl:
2NaCl(熔融)=====
电解
2Na+Cl2↑
镁 在自然界以化合态形式存在
从海水中提取镁的生产流程:
贝壳――→煅烧 生石灰――→水 石灰乳
――→海水沉淀池
Mg(OH)2 沉淀 ――→盐酸
MgCl2 溶液
――→蒸发结晶
MgCl2·6H2O――→HCl 气体
加热 MgCl2(熔融)――→电解
Mg
铝
是地壳中含量最多的金属元
素,以化合态存在,主要以
铝土矿的形式存在
(1)从铝土矿制备铝的工艺流程
(2)有关化学反应
①Al2O3+2NaOH===2NaAlO2+H2O
②NaAlO2+CO2+2H2O===Al(OH)3↓+
NaHCO3
③2Al(OH)3=====
△
Al2O3+3H2O
④2Al2O3=====
通电
4Al+3O2↑
铁
在自然界中主要以化合态存
在,常见的矿石有磁铁矿、
赤铁矿、硫铁矿等
(1)原理:在高温下用还原剂从铁矿石里还原出
铁;
(2)原料:铁矿石、焦炭、石灰石和空气;
(3)设备:炼铁高炉;
(4)生产过程
①还原剂的产生:C+O2=====
点燃
CO2;CO2+
C=====
高温
2CO
②铁矿石还原成铁:Fe2O3+3CO=====
高温
2Fe+
3CO2
③炉渣的形成:CaCO3=====
高温
CaO+CO2↑;SiO2
+CaO=====
高温
CaSiO3
铜
在自然界中以游离态和化合
态存在,常见的矿石有黄铜
矿(CuFeS2)、孔雀石(碱式碳
酸铜)等
(1)高温冶炼黄铜矿(CuFeS2),得粗铜(99.5%~
99.7%);
(2)电解精炼,得纯度较高的铜(99.95%~
99.98%);
(3)生物炼铜,污染小、成本低,流程为硫化铜
矿石 ――→细菌+氧气硫酸铜――→置换 铜
1.下列关于金属冶炼的说法中正确的是( )
A.金属银、汞可用热分解法冶炼
B.可用热分解法冶炼金、铂
C.金属 Mg、Al 都可以用电解熔融氯化物的方法制得
D.电解法是冶炼活泼金属(如钾、钠、镁、铝等)的唯一方法
解析:选 A。银、汞为不活泼金属,工业上可用热分解其氧化物的形式制得,A 项正确;
金、铂极不活泼,应用富集法(物理方法)冶炼,B 项错误;AlCl3 为共价化合物,工业上制备
金属 Al 是用电解熔融 Al2O3 的方法,C 项错误;工业上冶炼钾可以用钠还原法:Na+
KCl=====850 ℃
NaCl+K↑,反应制得的钾蒸气遇冷即得到金属钾,D 项错误。
2.(2019·慈溪高一期中)下列有关金属的工业制法中,正确的是 ( )
A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的 CO 在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的 NaCl 溶液
D.炼铜:用黄铜矿(主要成分为 CuFeS2)直接电解精炼得到纯度为 99.9%的铜
解析:选 B。将金属钠投入到氯化钛溶液中,钠先与水反应,应用金属钠与熔融的氯化钛
反应来制取金属钛,故 A 错误;工业炼铁是 CO 还原铁矿石:3CO+Fe2O3=====
高温
2Fe+3CO2,
故 B 正确;工业制钠是电解熔融 NaCl:2NaCl(熔融)=====
通电
2Na+Cl2↑,而电解纯净的 NaCl
溶液:2NaCl+2H2O=====
通电
2NaOH+H2↑+Cl2↑,得不到钠,故 C 错误;黄铜矿(主要成分为
CuFeS2)经过冶炼后得到粗铜,粗铜进行电解精炼得到 99.9%的铜,故 D 错误。
3.铝热反应的化学方程式为 2Al+Fe2O3=====
高温
Al2O3+2Fe。某同学对“铝热反应”的现
象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔
融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3 的熔、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2 054 1 535 1 462
沸点/℃ 2 467 2 980 2 750 —
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由
是________________________________________________________________________
________________________________________________________________________。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试
剂是________,当观察到________________的现象时,说明熔融物中含有金属铝。
(3)实验室溶解该熔融物,最好选用下列试剂中的________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
答案:(1)该反应温度下铝已熔化,未反应的铝可与生成的铁熔合在一起,形成合金
(2)NaOH 溶液 有气泡生成 (3)B
钠、镁及其化合物[学生用书 P26]
一、钠及其重要化合物的主干知识
1.树立物质转化思想
(1)理清知识主线
Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3
(2)形成网络构建
2.扫除易忘知识盲点
(1)钠和盐溶液反应,不能置换出盐中的金属,与熔融的盐反应才能置换出盐中的金属。
(2)无论 Na 与 O2 反应生成 Na2O 还是 Na2O2,只要参与反应的 Na 的质量相等,则转移电
子的物质的量一定相等,但得到 Na2O2 的质量大于 Na2O 的。
(3)Na 分别与 H2O 和乙醇发生的反应均属于置换反应,二者现象明显不同,前者剧烈,后
者缓慢。
(4)1 mol Na2O2 参与反应转移电子的物质的量不一定为 1 mol,如 1 mol Na2O2 与 SO2 的反
应转移电子应为 2 mol。
(5)不能用 Ca(OH)2 鉴别 Na2CO3 和 NaHCO3 溶液,应选用 CaCl2 或 BaCl2 溶液。
(6)除去 CO2 中的 HCl 气体,应选用饱和的 NaHCO3 溶液。
(7)向饱和的 Na2CO3 溶液中通入过量 CO2,有 NaHCO3 晶体析出。
(8)焰色反应是元素的性质,无论游离态还是化合态,均具有相同的焰色反应,它不是化
学变化,在观察钾元素的焰色反应时,应透过蓝色的钴玻璃片。
(9)NaK 合金常温下呈液态,是原子反应堆的导热剂。
(10)碱金属的密度呈现增大的趋势,但 K 反常。
(11)Li 和 O2 反应只生成 Li2O;NaH 是离子化合物,是一种强还原剂。Na2O、Na2O2 中阴、
阳离子个数比均为 1∶2。
二、镁及其重要化合物的主干知识
1.树立物质转化思想
(1)理清知识主线
(2)形成网络构建
2.扫除易忘知识盲点
(1)Mg 是较活泼的金属,常温下能被空气中的 O2 氧化,表面生成一层致密的氧化膜。
(2)镁在纯氧中剧烈燃烧,发出耀眼的白光。
(3)镁不易和冷水反应,但能与沸水反应。
(4)MgO 是很轻的白色粉末,属碱性氧化物,它能与水缓慢反应生成 Mg(OH)2;它具有很
高的熔点,可做耐高温材料。
(5)MgCl2 是一种无色、味苦、易溶于水的固体,易潮解,可作干燥剂。
(6)工业上用电解熔融 MgCl2 的方法制取金属镁。
题组一 钠、镁的性质及应用
1.下列有关钠及其化合物的说法不正确的是( )
A.电解饱和食盐水可制取金属钠
B.钠与氧气反应的产物与反应条件有关
C.氧化钠与水反应生成氢氧化钠
D.钠可以从四氯化钛中置换出钛
答案:A
2.镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某冷却
剂中冷却,下列可作为冷却剂的是( )
①CO2 ②O2 ③Ar ④H2 ⑤N2 ⑥Cl2
A.①② B.③④
C.③⑥ D.③⑤
解析:选 B。镁蒸气可与 CO2、O2、Cl2、N2 等发生反应,故不能作为冷却剂使用。
题组二 钠的重要化合物的性质及应用
3.(2018·浙江 11 月选考,T5)可用于治疗胃酸过多的物质是( )
A.碳酸氢钠 B.氯化钠
C.氯化钾 D.氢氧化钠
解析:选 A。胃酸的主要成分是盐酸,治疗胃酸过多就是用盐或碱去反应掉胃中过多的盐
酸。碳酸氢钠可以和盐酸反应,生成对人体无害的氯化钠、水和二氧化碳。氢氧化钠的碱性
太强,与盐酸反应剧烈,且具有强腐蚀性,会对人体造成伤害。所以一般选用碳酸氢钠治疗
胃酸过多。
4.化学知识在生产和生活中有着重要的应用。下列说法中正确的是( )
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②KNa 合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2 既可作呼吸面具中 O2 的来源,又可漂白织物、麦秆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
⑥明矾常作为消毒剂
A.①②③④ B.①②③④⑤
C.①②③④⑥ D.①②③④⑤⑥
解析:选 A。①金属钠的还原性强于金属钛等,可以将金属钛、钽、铌、锆等从其熔融态
的盐中置换出来,所以可以
用来冶炼金属钛、钽、铌、锆等,故正确;②KNa 合金熔点低,可作原子反应堆的导热
剂,故正确;③碳酸氢钠和酸反应生成二氧化碳,所以发酵粉中主要含有碳酸氢钠,能使焙
制出的糕点疏松多孔,故正确;④Na2O2 和二氧化碳反应生成碳酸钠和氧气,且又有强氧化性,
有漂白性,所以 Na2O2 既可作呼吸面具中 O2 的来源,又可漂白织物、麦秆、羽毛等,故正确;
⑤碳酸钠碱性较强,所以不能用来治疗胃酸过多,碳酸氢钠在医疗上是治疗胃酸过多的一种
药剂,故错误;⑥明矾是强酸弱碱盐,能水解生成氢氧化铝胶体,胶体具有吸附性,所以可
作净水剂,不能作消毒剂,故错误。
5.下列有关 Na2CO3 和 NaHCO3 的叙述中正确的是( )
A.NaHCO3 比 Na2CO3 的热稳定性强
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.Na2CO3 和 NaHCO3 均可与 NaOH 溶液反应
D.向饱和 Na2CO3 溶液中通入 CO2,有 NaHCO3 晶体析出
解析:选 D。Na2CO3 受热不分解,而 NaHCO3 受热分解,A 错;与同浓度盐酸反应的剧
烈程度:Na2CO3
4 时,铝元素存在形式为 AlO-
2 ,D 正确。
题组二 铝及其化合物性质的定量计算
3.
将一定质量的 Mg 和 Al 的混合物投入 500 mL 稀硫酸中,固体全部溶解并产生气体。待
反应完全后,向所得溶液中加入 NaOH 溶液,生成沉淀的物质的量与加入 NaOH 溶液的体积
关系如图所示。则下列说法正确的是( )
A.Mg 和 Al 的总质量为 8 g
B.硫酸的物质的量浓度为 5 mol/L
C.NaOH 溶液的物质的量浓度为 5 mol/L
D.生成的 H2 在标准状况下的体积为 11.2 L
解析:选 C。由图像可知,加入 NaOH 溶液 0~20 mL 时发生酸碱中和反应,20~200 mL
时发生 Mg2+、Al3+与碱生成沉淀的反应,200~240 mL 时发生 Al(OH)3+NaOH===NaAlO2+
2H2O。200 mL 时生成沉淀最多,溶液中的溶质为硫酸钠。由图像可知,n(Mg)=0.15 mol,n(Al)
=0.2 mol,则 Mg 和 Al 的总质量为 0.15 mol×24 g/mol+0.2 mol×27 g/mol=9 g,A 错误;由
200~240 mL 时发生 Al(OH)3+NaOH===NaAlO2+2H2O 可知,c(NaOH)=0.2 mol
0.04 L
=5 mol/L,
200 mL 时生成沉淀最多,溶液中的溶质为硫酸钠,则 c(H2SO4)=0.2 L×5 mol/L
0.5 L×2
=1 mol/L,B
错误、C 正确;与硫酸反应生成的氢气的体积应为(0.15 mol+0.3 mol)×22.4 L·mol-1=10.08 L,
D 错误。
4.
向一定量的 NaOH 溶液中逐滴加入 AlCl3 溶液,生成沉淀 Al(OH)3 的量随 AlCl3 加入量的
变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
A.a 点对应溶液中:K+、Fe3+、SO2-
4 、Cl-
B.b 点对应溶液中:Na+、S2-、NO-
3 、Cl-
C.c 点对应溶液中:K+、Ag+、NO-
3 、SO2-
4
D.d 点对应溶液中:K+、Mg2+、I-、CO2-
3
解析:选B。向NaOH 溶液中逐渐加入AlCl3溶液时发生反应:Al3++4OH-===AlO-
2 +2H2O,
3AlO-
2 +6H2O+Al3+===4Al(OH)3↓。a 点时溶液中有大量 OH-,故 Fe3+不能大量存在;c 点
时溶质为 NaCl,故 Ag+不能大量存在;d 点对应溶液中溶质为 NaCl 和 AlCl3,CO 2-
3 与 Mg2+、
Al3+不能大量共存。
铁、铜的获取及应用[学生用书 P28]
一、铁及其重要化合物的主干知识
1.树立物质转化思想
(1)理清知识主线
Fe→
FeO
Fe2O3
Fe3O4
→ Fe(OH)2
Fe(OH)3
→ FeSO4·7H2O
FeCl3
(2)形成网络构建
2.扫除易忘知识盲点
(1)Fe 与 O2、H2O(g)反应的产物都是 Fe3O4 而不是 Fe2O3。Fe 与 Cl2 反应时生成 FeCl3,与
S 反应时生成 FeS,说明 Cl2 的氧化性大于 S 的。常温下,Fe、Al 在冷的浓硫酸和浓硝酸中发
生钝化,但加热后继续反应。Fe 在 Cl2 中燃烧,无论 Cl2 过量还是不足均生成 FeCl3。
(2)向含 Fe2+的溶液中加入硝酸、KMnO4 溶液、氯水等具有氧化性的物质时,溶液会出现
浅绿色―→棕黄色的颜色变化,该现象可用于 Fe2+的检验。
(3)Fe3+的检验方法较多,如观察溶液颜色法(棕黄色)、NaOH 溶液法(生成红褐色沉淀)、
KSCN 溶液法(生成红色溶液),前面两种方法需溶液中 Fe3+浓度较大时才适用,最灵敏的方法
是 KSCN 溶液法。Fe2+的检验可采用先加入 KSCN 溶液后再加入氧化剂的方法;也可用铁氰
化钾检验 Fe2+,现象是生成蓝色沉淀。
(4)生成 FeCl2 除了用 Fe 和 HCl 的置换反应外,还可用化合反应:2FeCl3+Fe===3FeCl2;
生 成 Fe(OH)3 除 了 用 Fe3 + 与 碱 的 复 分 解 反 应 外 , 还 可 用 化 合 反 应 : 4Fe(OH)2 + O2 +
2H2O===4Fe(OH)3。
(5)配制 FeCl2 溶液既要防氧化(加入 Fe 粉),又要防水解(加入盐酸);配制 FeCl3 溶液要加
入浓盐酸防止水解。
(6)Fe3+必须在酸性条件下才能大量存在,当 pH=7 时,Fe3+几乎完全水解生成 Fe(OH)3
沉淀。
(7)除去酸性溶液 ZnCl2 中的 FeCl2,应先通入 Cl2 或加入 H2O2,再加入 ZnO,使 Fe3+水解
生成沉淀过滤除去。
(8)制备 Fe(OH)2 的方法很多,原则有两点:一是溶液中的溶解氧必须提前除去;二是反
应过程中必须与 O2 隔绝。同时要牢记 Fe(OH)2 转化为 Fe(OH)3 时沉淀颜色的变化(白色沉淀迅
速变成灰绿色,最后变成红褐色)。
(9)Fe(OH)3 胶体的制备方法是将饱和 FeCl3 溶液滴加到沸水中,加热至呈红褐色后立即停
止加热。胶体不带电,带电的是胶粒。
(10)自然界中有少量游离态的铁(陨石中),纯净的铁块是银白色的,而铁粉是黑色的。
二、铜及其重要化合物的主干知识
1.树立物质转化思想
(1)理清知识主线
Cu→ Cu2O
CuO
←Cu(OH)2→
CuCl2
CuSO4
Cu2(OH)2CO3
(2)形成网络构建
2.扫除易忘知识盲点
(1)铜在潮湿的空气中最终不是生成 CuO,而是生成铜绿[Cu2(OH)2CO3]。
(2)常用灼热的铜粉除去 N2 中的 O2,灼热的 CuO 除去 CO2 中的 CO。
(3)新制 Cu(OH)2 悬浊液常用来检验醛基。
(4)Cu 和一定量的浓 HNO3 反应,产生的是 NO2 和 NO 的混合气体,当 Cu 有剩余,再加
入稀 H2SO4,Cu 继续溶解。
(5)Cu:紫红色;CuO:黑色;Cu2S:黑色;CuS:黑色;Cu2O:砖红色。
(6)铜的焰色反应为绿色。
(7)冶炼铜的方法有①热还原法;②湿法炼铜;③电解精炼铜。
(8)铜合金有①青铜(Cu、Sn、Pb 等);②黄铜(Zn、Sn、Pb、Al 等);③白铜(Ni、Zn、Mn)。
题组一 铁、铜及其化合物的性质
1.(2017·浙江 4 月选考,T24)由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3 和 FeO)得到绿矾
(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣――→酸溶
① ――→FeS2
② 溶液――→③ 绿矾 ――→氨水/空气
④ 铁黄
已知:FeS2 和铁黄均难溶于水
下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子方程式为 FeS2+14Fe3++8H2O===15Fe2++2SO2-
4 +16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有 Fe(OH)3
答案:C
2.(2017·浙江 11 月选考,T28)为了探究铁、铜及其化合物的性质,某同学设计并进行了
下列实验。
已知:3Fe(s)+4H2O(g)=====
高温
Fe3O4(s)+4H2(g)
请回答:
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加
热 , 变 黑 后 再 趁 热 迅 速 伸 入 所 制 得 的 纯 净 氢 气 中 , 观 察 到 的 实 验 现 象 是
______________________________________________。
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加 KSCN 溶液,没
有 出 现 血 红 色 , 说 明 该 固 体 中 没 有 + 3 价 的 铁 。 判 断 结 论 是 否 正 确 并 说 明 理 由 :
________________________________________________________________________。
解析:(1)高温下铁与水蒸气反应生成 Fe3O4 和 H2,H2 密度比空气小,故虚线框处宜选择
装置乙收集 H2;铜丝加热生成黑色的 CuO,H2 将 CuO 还原生成红色的 Cu。(2)固体中的 Fe3O4
溶于盐酸得到 Fe3+、Fe2+,铁过量时发生反应:Fe+2Fe3+===3Fe2+,则溶液中不含 Fe3+,故
滴入 KSCN 溶液后不变血红色,所以结论不正确。
答案:(1)乙 铜丝由黑变红
(2)不正确,因为铁过量时:Fe+2Fe3+===3Fe2+
3.(2019·浙江 4 月选考,T28)某同学设计如图装置(气密性已检查)制备 Fe(OH)2 白色沉淀。
请回答:
(1)仪器 1 的名称为______。装置 5 的作用是________。
(2)实验开始时,关闭 K2,打开 K1,反应一段时间后,再打开 K2,关闭 K1,发现 3 中溶
液 不 能 进 入 4 中 。 请 为 装 置 做 一 处 改 进 , 使 溶 液 能 进 入 4 中 :
________________________________________________________________________。
(3)装置改进后,将 3 中反应后溶液压入 4 中,在 4 中析出了灰绿色沉淀。从实验操作过
程分析没有产生白色沉淀的原因:________________________________________。
答案:(1)滴液漏斗(或分液漏斗) 液封,防止空气进入装置 4
(2)在装置 2、3 之间添加控制开关
(3)装置 4 内的空气没有排尽
题组二 铁、铜及其重要化合物的综合应用
4.(2018·浙江 11 月选考,T29)某红色固体粉末可能是 Fe2O3、Cu2O 或二者混合物,为探
究其组成,称取 m g 该固体粉末样品,用足量的稀 H2SO4 充分反应后,称得固体质量为 a g。
已知:Cu2O+2H+===Cu2++Cu+H2O
(1)若 a=________(用含 m 的最简式表示),则红色固体粉末为纯净物。
(2)若 a=1
9m,则红色固体粉末中 Fe2O3 的物质的量为________mol(用含 m 的最简式表示)。
解析:固体粉末样品加入足量的稀 H2SO4 充分反应后,有固体剩余,所以该固体粉末中
一定有 Cu2O,不一定有 Fe2O3。
(1)若红色固体粉末为纯净物,则该固体粉末中只有 Cu2O。m g Cu2O 的物质的量为 m
144
mol,根据离子方程式:Cu2O+2H+===Cu+Cu2++H2O,产生 Cu 的物质的量是 m
144 mol,则
其质量为 4m
9 g。
(2)固体粉末样品加入足量的稀 H2SO4 充分反应后,称得固体质量为 a g。设原样品中 Fe2O3
为 x mol,Cu2O 为 y mol,则
Cu2O+2H+===Cu+Cu2++H2O
y mol y mol
Fe2O3+6H+===2Fe3++3H2O
x mol 2x mol
2Fe3++Cu===2Fe2++Cu2+
2x mol x mol
反应后剩余的 a g 固体是 Cu,则 160x+144y=m①
64(y-x)=1
9m②
联立①②解得 x= 3m
1 216
,y= 23m
5 472
。
答案:(1)4m
9 (2) 3m
1 216
5.(2017·浙江 4 月选考,T27)为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完
成如下实验:
请回答:
(1)X 的化学式是________。
(2)固体甲与稀硫酸反应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
(3)加热条件下氨气被固体 X 氧化成一种气体单质,写出该反应的化学方程式:
________________________________________________________________________。
解析:由 X 隔绝空气高温加热产生的气体能使带火星的木条复燃可知 X 中一定含有氧元
素,再由固体甲(28.8 g)+稀硫酸溶液(蓝色)+固体乙(12.8 g,紫红色)可知 X 中一定含有铜元
素,甲中也含有铜和氧两种元素,最后通过给出的质量关系可推出 X 为 CuO,甲为 Cu2O。
答案:(1)CuO (2)Cu2O+2H+===Cu2++Cu+H2O
(3)3CuO+2NH3=====
△
3Cu+N2+3H2O
6.(2018·浙江 4 月选考,T29)称取 4.00 g 氧化铜和氧化铁固体混合物,加入 50.0 mL 2.00
mol·L-1 的硫酸充分溶解,往所得溶液中加入 5.60 g 铁粉,充分反应后,得固体的质量为 3.04 g。
请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量:________。
(2)固体混合物中氧化铜的质量:________。
答案:(1)0.100 mol (2)2.40 g