- 2021-05-20 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一化学上学期第二次考试试题1
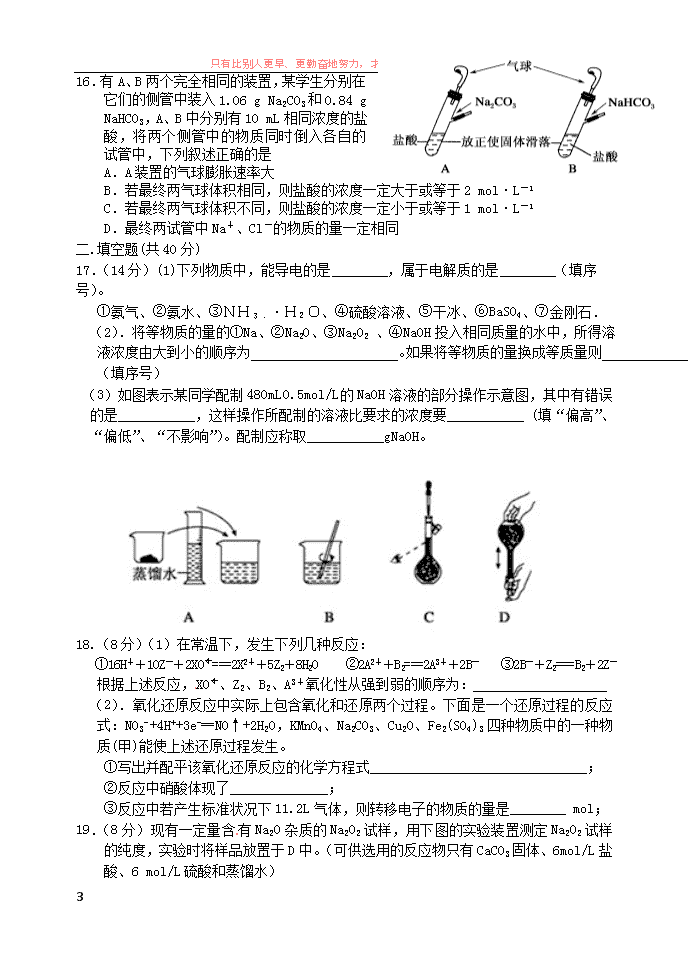
只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 1 南昌二中 2016—2017 学年度上学期第二次考试 高一化学试卷 可能用到的相对原子质量:H:1 C:12 O:16 Cl:35.5 S:32 Si:28 Na:23 Al:27 Mg:24 Fe:56 Cu:64 一:选择题(每小题只有一个正确答案,每小题 3 分,共 48 分) 1.下列事实与胶体性质有关的是 ① 豆浆加入盐卤做豆腐 ②在河流入海口易形成沙洲 ③油水混合会分层 ④ 工厂采用静电除尘 ⑤CuSO4 与 NaOH 溶液混合产生沉淀 ⑥血液透析 A.①②④⑥ B.①②③⑤ C.③④⑤⑥ D.全部 2.下列实验操作中正确的是 A.萃取操作时,可以选用 CCl4 或酒精作为萃取剂从溴水中萃取溴 B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 D.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 3.在下列各溶液中,离子可能大量共存的是 A.加入铝粉能产生H2的溶液中:K+、Mg2+、Cl-、SO4 2- B.加入 Na2O2 的溶液中:K+、Al3+、Cl-、NO3 - C.含有 0.1mol·L-1Ca2+的溶液中:Na+、K+、CO3 2-、Cl- D.无色透明的酸性溶液中:MnO4 -、K+、SO4 2-、Na+ 4.已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO-+OH-→FeO4 n-+Cl-+ H2O(未配平)。则有 关叙述不正确的是 A.已知 FeO4 n-中 Fe 的化合价是+6 价,则 n=2 B.每产生 1molCl-,转移 2mol 电子 C.若 n=2,该反应中氧化剂与还原剂的物质的量之比为 2:3 D.FeO4 n-具有强氧化性,一般其还原产物为 Fe3+,可用作新型自来水消毒剂和净水剂 5.能正确表示下列反应的离子方程式是 A.Fe3O4 溶于足量稀 HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O B.NH4HCO3 溶液与足量 Ba(OH)2 溶液混合:HCO3 -+Ba2++OH-=BaCO3↓+H2O C.实验室制取 Fe(OH)3 胶体的反应:Fe3++3H2O 3H++Fe(OH)3 D.将 0.2 mol·L-1 的 NH4Al(SO4)2 溶液与 0.3 mol·L-1 的 Ba(OH)2 溶液等体积混合: 2Al3++3SO4 2-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ 6.向等物质的量浓度的 NaOH 和 Na2CO3 的混合溶液中加入稀盐酸。下列离子方程式与事 实不相符的是 A.OH-+CO3 2-+2H+ ===HCO3 -+H2O B.2OH-+CO3 2-+3H+ ===HCO3 -+2H2O C.2OH-+CO3 2-+4H+ ===CO2↑+3H2O D.OH-+CO3 2-+3H+ ===CO2↑+2H2O 7.同温同压下,质量相同的 CO2、H2、O2、CH4、SO2 五种气体,下列说法错误的是 A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 2 B.所含分子数由多到少的顺序是: H2>CH4>O2>CO2>SO2 C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2 D.所含的电子数由多到少是:CO2>SO2>CH4>O2>H2 8.下列说法中,正确的是 ①食盐灼烧时火焰呈黄色与钠燃烧得黄色固体原理不相同 ②固体氢氧化钠存放在带塑料塞的广口瓶中 ③溶解度:NaHCO3 > Na2CO3 ④向紫色石蕊试液中加入过量的 Na2O2 粉末,振荡后溶液呈蓝色 ⑤向含有 Na+、SO4 2-、HCO3 -、CO3 2-的溶液中加入过量的 Na2O2 固体,Na+和 CO3 2-的物质的 量不变 ⑥1 mol Na2O2 与足量的水反应,转移的电子数为 2mol ⑦取用金属钠时,应将剩下的钠放回原瓶 A.①②⑦ B .①②③⑥ C .①②⑥⑦ D .①②④⑤ 9.将金属钠投入下列物质的溶液中,有气体放出,且溶液质量减轻的是 ①稀盐酸 ②K2SO4 溶液 ③CuSO4 溶液 ④饱和 NaOH 溶液. A.④ B.③ C.③④ D.①② 10.关于 Na2CO3 和 NaHCO3 的比较中,下列说法不正确的是( ) A.NaHCO3 固体受热容易分解,而 Na2CO3 固体受热不容易分解 B.等质量的 Na2CO3 和 NaHCO3 分别与足量同浓度的盐酸反应,前者消耗盐酸的量比后 者多 C.等物质的量浓度的 Na2CO3 和 NaHCO3 溶液中分别滴加 2 滴酚酞溶液,前者颜色比后 者深 D.Na2CO3 溶液和 NaHCO3 溶液分别与 Ba(OH)2 溶液反应的离子方程式相同 11.把 CO2 通入下列饱和溶液中,最终会有沉淀的是 A.CaCl2 B.Na2CO3 C.Ca(OH)2 D.NaHCO3 12.将 5.4g Al 投入 200.0mL 2.0mol·L-1 的某溶液中有氢气产生,充分反应后有金属剩 余。该溶液可能为( ) A.HNO3 溶液 B.HCl 溶液 C.H2SO4 溶液 D.Ba(OH)2 溶液 13. 1mol 过氧化钠与 2mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气 体物质后冷却,残留的固体物质是 A.Na2CO3 B.Na2O2 Na2CO3 C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3 14.浓 H2SO4 密度 1.84g/mL,物质的量浓度为 18.4mol/L,质量分数为 98%,取 10mL 浓 H2SO4 和 a mL 水混合得物质的量浓度为 C mol/L,质量分数为 b%.下列组合正确的是 (1)若 C=9.2 则 a>10 b>49% (2)若 C=9.2 则 a>10 b<49% (3)若 b=49 则 a=18.4 C<9.2 (4)若 b=49 则 a=18.4 C>9.2. A.(1)(3) B.(1)(4) C.(2)(3) D.(2)(4) 15.在密闭容器中充入 C02、CO、CH4 的混合气体共 mg,若加入足量的 Na2O2,充分振荡并不 断用电火花引燃至反应完全,测得固体质量增加 mg;则 C02 与 CH4 的体积比为 A.3:1 B.2:l C.1:1 D.缺少条件,无法计算 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 3 16.有 A、B 两个完全相同的装置,某学生分别 在它们的侧管中装入 1.06 g Na2CO3 和 0.84 g NaHCO3,A、B 中分别有 10 mL 相同浓度的盐 酸,将两个侧管中的物质同时倒入各自的试 管中,下列叙述正确的是 A.A 装置的气球膨胀速率大 B.若最终两气球体积相同,则盐酸的浓度一定大于或等于 2 mol·L-1 C.若最终两气球体积不同,则盐酸的浓度一定小于或等于 1 mol·L-1 D.最终两试管中 Na+、Cl-的物质的量一定相同 二.填空题(共 40 分) 17.(14 分)(1)下列物质中,能导电的是 ,属于电解质的是 (填序号)。 ①氨气、②氨水、③NH3﹒·H2O、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石. (2).将等物质的量的①Na、②Na2O、③Na2O2 、④NaOH 投入相同质量的水中,所得溶 液浓度由大到小的顺序为 。如果将等物质的量换成等质量 则 。(填序号) (3)如图表示某同学配制 480mL 0.5mol/L 的 NaOH 溶液的部分操作示意图,其中有错 误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏 高”、“偏低”、“不影响”)。配制应称取___________gNaOH。 18.(8 分)(1)在常温下,发生下列几种反应: ①16H++10Z-+2XO- 4 ===2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z- 根据上述反应,XO- 4 、Z2、B2、A3+氧化性从强到弱的顺序为: (2).氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应 式:NO3 -+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种物质(甲) 能使上述还原过程发生。 ①写出并配平该氧化还原反应的化学方程式_______________________________; ②反应中硝酸体现了______________; ③反应中若产生标准状况下 11.2L 气体,则转移电子的物质的量是________ mol; 19.(8 分)现有一定量含有 Na2O 杂质的 Na2O2 试样,用下图的实验装置测定 Na2O2 试样的 纯度,实验时将样品放置于.........D.中.。(可供选用的反应物只有 CaCO3 固体、6 mol/L 盐 酸、6 mol/L 硫酸和蒸馏水) 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 4 回答下列问题: (1)装置 A 中液体试剂选用 。 (2)装置 B 的作用是 。装置 C 的作用是 。 装置 E 中碱石灰的作用是 。 ( 3 ) 装 置 D 中 发 生 反 应 的 化 学 方 程 式 是 、 。 (4)若开始时测得样品的质量为 2.0 g,反应结束后测得气体体积为 224 mL(标准状 况),则 Na2O2 试样的纯度为 20.(14 分)在 Na+浓度为 0.5mol/L 的某澄清溶液中,还可能含有下表中的若干种离子: 阳离子 K+、Ag+、Mg2+、Ba2+ 阴离子 NO3 -、CO3 2-、SiO3 2-、SO4 2- 取该溶液 100mL 进行如下实验(气体体积在标准状况下测定): 序号 实验内容 实验结果 Ⅰ 向该溶液中加入足量稀 HCl 产生白色沉淀并放出 0.56L 气体 Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、 灼烧至恒重,称量所得固体质量 固体质量为 2.4g Ⅲ 在Ⅱ的滤液中滴加 BaC12 溶液 无明显现象 试回答下列问题: (1)实验 I 能确定一定不存在的阳离子是 。 (2)实验 I 中生成沉淀的离子方程式为 。 (3)通过实验 I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计 算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”) 阴离子 NO3 - CO3 2- SiO3 2- SO4 2- c/mol·L-1 (4)判断 K+是否存在,若存在求其最小浓度(若不存在说明理由) 。 三.计算题(共 8 分) 21.取等物质的量浓度的 NaOH 溶液两份 A 和 B,每份 10 mL,分别 向 A、B 中通入不等量的 CO2,再继续向两溶液中逐滴加入 0.1 mol/L 的盐酸,标准状况下产生的 CO2 的体积与所加盐酸体积之 间的关系如下图所示,试回答下列问题: (1)原 NaOH 溶液的物质的量浓度为____________mol/L。 (2)曲线 A 表明,原 NaOH 溶液中通入 CO2 后,所得溶液中的溶质成 只有比别人更早、更勤奋地努力,才能尝到成功的滋味。 5 分是____________,其物质的量之比为__________。 (3)曲线 B 表明,所得溶液加盐酸后产生 CO2 气体体积(标况)的最大值为_ mL。 南昌二中 2016—2017 学年度上学期第二次考试 高一化学试卷参考答案 一 : 选 择 题 (共 48 分) 二.填空题(共 44 分) 17.(14 分) (1) ②④ ,③⑥ (2)②Na2O=③Na2O2 >①Na>④NaOH ③①Na>②Na2O>③ Na2O2>④NaOH (3)C; 偏低; 10.0 18.(8 分) (1)XO- 4 >Z2>B2 >A3+ (2)① 14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O ② 酸性 氧化性 ③1.5 19.(8 分) (1)6 mol/L 盐酸(1 分) (2)除去气体中的 HCl;干燥气体;吸收装置 D 中反应剩余的 CO2。(每空 1 分共 3 分) (3)2Na2O2+2CO2=2Na2CO3+O2↑ Na2O+CO2=Na2CO3 (2 分) (4)78%(2 分) 20.(14 分) (1)Ag+、Mg2+、Ba2+ (2)SiO3 2-+2H+=H2SiO3↓ (3) 阴离子 NO3 - CO3 2- SiO3 2- SO4 2- c/mol·L-1 不能确定 0.25 0.4 0 (4)存在,其最小浓度为 0.8mol/L 三.计算题(共 8 分) 21. (共 8 分) (1)0.75mol/L; (2)NaOH、Na2CO3; 3:1 (3)112mL 1 2 3 4 5 6 7 8 A D A C D C D A 9 10 11 12 13 14 15 16 C D B B A A C B查看更多