- 2021-05-20 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版江苏新高考选考化学(苏教版)一轮复习同步练习:专题6 4 第三单元 电解原理 金属的腐蚀与防护
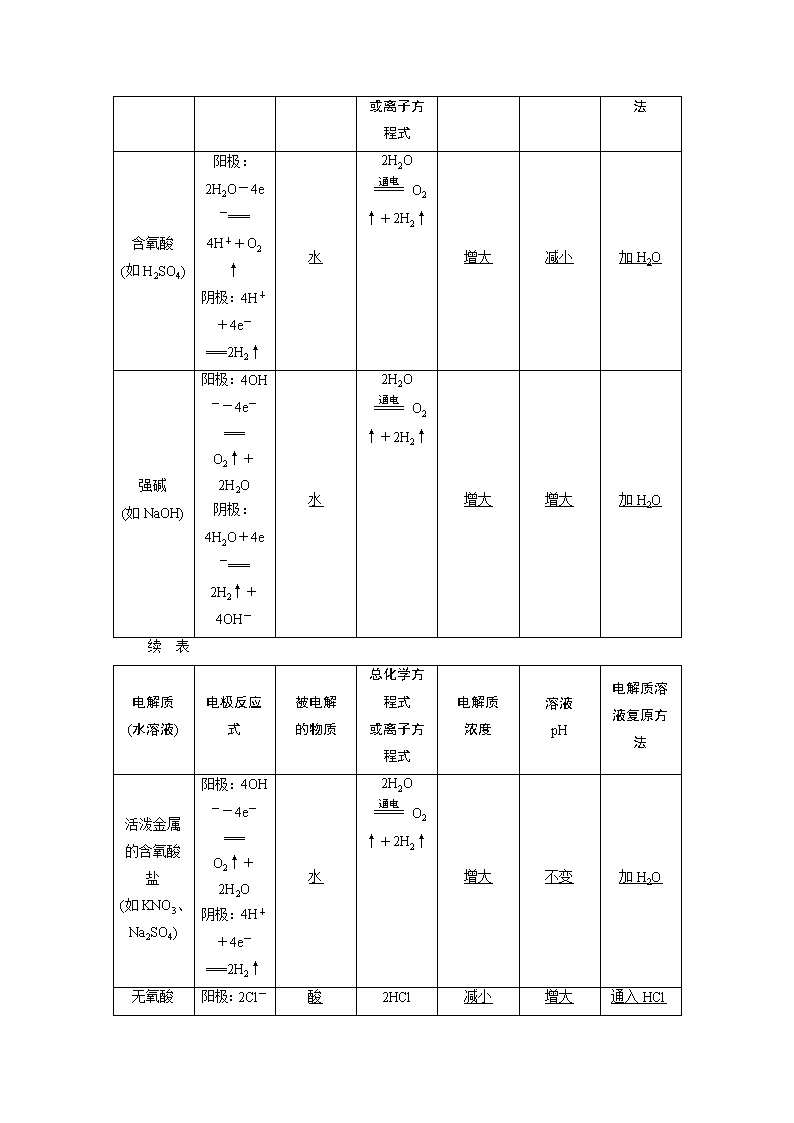
第三单元 电解原理 金属的腐蚀与防护 学习任务1 电解原理 1.电解 使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。 2.电解池(也叫电解槽) 电解池是把电能转化为化学能的装置。 3.电解池的组成和工作原理(以电解CuCl2溶液为例) 总反应式:CuCl2Cu+Cl2↑。 4.电子和离子移动方向 (1)电子:从电源的负极流向电解池的阴极;从电解池的阳极流向电源的正极。 (2)离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。 5.分析电解过程的思维程序 (1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。 (2)其次分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。排出阴、阳两极的放电顺序。 阴极:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。 阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。 (3)然后分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。 (4)最后写出电解反应的总化学方程式或离子方程式。 6.电解规律(用惰性电极电解) 电解质 (水溶液) 电极反应式 被电解 的物质 总化学方程式 电解质 浓度 溶液 pH 电解质溶 或离子方程式 液复原方法 含氧酸 (如H2SO4) 阳极:2H2O-4e-=== 4H++O2↑ 阴极:4H++4e-===2H2↑ 水 2H2OO2↑+2H2↑ 增大 减小 加H2O 强碱 (如NaOH) 阳极:4OH--4e-=== O2↑+2H2O 阴极:4H2O+4e-=== 2H2↑+4OH- 水 2H2OO2↑+2H2↑ 增大 增大 加H2O 续 表 电解质 (水溶液) 电极反应式 被电解 的物质 总化学方程式 或离子方程式 电解质 浓度 溶液 pH 电解质溶 液复原方法 活泼金属 的含氧酸盐 (如KNO3、 Na2SO4) 阳极:4OH--4e-=== O2↑+2H2O 阴极:4H++4e-===2H2↑ 水 2H2OO2↑+2H2↑ 增大 不变 加H2O 无氧酸 阳极:2Cl- 酸 2HCl 减小 增大 (如HCl, 除HF外) -2e-===Cl2↑ 阴极:2H++2e-===H2↑ Cl2↑+H2↑ 通入HCl气体 不活泼金属 的无氧酸盐 (如CuCl2, 除氟化物外) 阳极:2Cl--2e-===Cl2↑ 阴极:Cu2++2e-===Cu 盐 CuCl2Cu+Cl2↑ 减小 — 加CuCl2固体 活泼金属的 无氧酸盐 (如NaCl) 阳极:2Cl--2e-===Cl2↑ 阴极:2H++2e-===H2↑ 水和盐 2Cl-+2H2O Cl2↑+H2↑+2OH- 生成新 电解质 增大 通入HCl气体 不活泼金属 的含氧酸盐 (如CuSO4) 阳极:2H2O-4e-===4H+ +O2↑ 阴极:2Cu2++4e-===2Cu 水和盐 2Cu2++2H2O 2Cu+O2↑+4H+ 生成 新电 解质 减小 加CuO或 CuCO3 1.按要求书写有关的电极反应式及总反应式。 (1)用惰性电极电解AgNO3溶液 阳极反应式:______________________________________________; 阴极反应式:______________________________________________; 总反应离子方程式:_______________________________________。 (2)用惰性电极电解MgCl2溶液 阳极反应式:____________________________________________; 阴极反应式:_____________________________________________; 总反应离子方程式:_____________________________________。 (3)用铜做电极电解NaCl溶液 阳极反应式:___________________________________________; 阴极反应式:___________________________________________; 总反应化学方程式:____________________________________。 (4)用铜做电极电解盐酸 阳极反应式:___________________________________________; 阴极反应式:____________________________________________; 总反应离子方程式:______________________________________。 答案:(1)2H2O-4e-===4H++O2↑ 4Ag++4e-===4Ag 4Ag++2H2O4Ag+O2↑+4H+ (2)2Cl--2e-===Cl2↑ 2H++2e-===H2↑ Mg2++2Cl-+2H2OMg(OH)2↓+Cl2↑+H2↑ (3)Cu-2e-===Cu2+ 2H++2e-===H2↑ Cu+2H2OCu(OH)2+H2↑ (4)Cu-2e-===Cu2+ 2H++2e-===H2↑ Cu+2H+Cu2++H2↑ 2.(教材改编题)下列关于铜电极的叙述正确的是( ) A.铜锌原电池中铜一般做负极 B.电解熔融氯化钠制钠时用铜做阳极 C.在镀件上电镀铜时用金属铜做阳极 D.电解稀硫酸制H2、O2时铜做阳极 解析:选C。A项,锌比铜活泼,故铜一般做正极,错误;B项,电解熔融氯化钠时用铜做阳极,阳极上Cl-不能失电子生成Cl2,错误;C项,电镀时,待镀金属做阴极,镀层金属为阳极,正确;D项,电解H2SO4制H2、O2时,阳极必为惰性电极,错误。 3.(2020·淮安高三检测)用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是( ) A.a端是直流电源的负极 B.通电使CuCl2发生电离 C.阳极上发生的反应:Cu2++2e-===Cu D.通电一段时间后,在阴极附近观察到黄绿色气体 解析:选A。A项铜离子移向阴极,则a为负极。B项,CuCl2发生电离是在水分子的作用下完成的,并非通电才能发生。C项,反应Cu2++2e-===Cu应在阴极上发生,阳极上发生的反应应为2Cl--2e-===Cl2↑。D项,通电一段时间后,应在阳极附近观察到黄绿色气体。 (1)阴极不管是什么材料,电极本身都不反应,一定是电解质溶液(或熔融电解质)中的阳离子放电。 (2)最常用、最重要的放电顺序是阳极:Cl->OH-;阴极:Ag+>Cu2+>H+。 (3)电解水溶液时,K+、Ca2+、Na+、Mg2+、Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。 提升一 电解原理和电解规律的考查 1.以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉)。下列说法错误的是( ) A.阴极附近溶液呈红色 B.阴极逸出气体 C.阳极附近溶液呈蓝色 D.溶液的pH变小 解析:选D。以石墨为电极,电解KI溶液,阴离子在阳极的放电能力:I->OH-。阳离子在阴极的放电能力:H+>K+。所以该电解反应的方程式是2KI+2H2OI2+H2↑+2KOH。由于在溶液中含有少量酚酞和淀粉,所以在阳极附近淀粉遇碘单质变为蓝色;在阴极逸出H2,由于产生OH-,溶液显碱性,使酚酞溶液变为红色。因为产生了碱,溶液碱性增强,所以溶液的pH变大。 2.(双选)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( ) A.通电后中间隔室的SO离子向正极迁移,正极区溶液pH增大 B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低 D.当电路中通过1 mol电子的电量时,会有0.25 mol的O2生成 解析:选BD。该装置为电解池。H2O在正(阳)极区放电,生成O2和H+,正(阳)极区溶液pH减小,中间隔室中的阴离子SO通过cd离子交换膜移向正(阳)极,故正(阳)极区可得到H2SO4;当电路中通过1 mol电子时生成 0.25 mol O2;H2O在负(阴)极区放电,生成OH-和H2,负(阴)极区溶液pH增大,中间隔室中的阳离子Na+通过ab离子交换膜移向负(阴)极,故负(阴)极区可得到NaOH,A、C项错误,B、D项正确。 提升二 电极反应式的书写 3.用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( ) A.用石墨做阳极,铁做阴极 B.阳极的电极反应式:Cl-+2OH- -2e-===ClO-+H2O C.阴极的电极反应式:2H2O+2e-===H2↑+2OH- D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O 解析:选D。A.由题干信息可知,Cl-在阳极放电生成ClO-,则阳极应为惰性电极,A项正确;B.Cl-在阳极放电生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液呈碱性,B项正确;C.阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+),C项正确;D.由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO- +H2O===N2↑+2CO2↑+5Cl-+2OH-,D项错误。 4.(1)PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________________,阴极上观察到的现象是________________________________________________________________________; 若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为___________________________, 这样做的主要缺点是_________________________________________________。 (2)(2017·高考江苏卷)电解Na2CO3溶液,原理如图所示。 阳极的电极反应式为_______________________________, 阴极产生的物质A的化学式为________。 解析:(1)阳极发生氧化反应,即Pb2+失去电子被氧化生成PbO2,同时考虑盐溶液水解得到的强酸性环境;阴极发生还原反应,即氧化性强的Cu2+得到电子生成铜;若电解液中不加入Cu(NO3)2,阴极Pb2+得电子变为Pb,这样就不能有效利用Pb2+。(2)阳极上H2O失去电子生成O2和H+,H+可以与CO反应生成HCO。阴极上H2O得到电子生成H2和OH-。 答案:(1)Pb2++2H2O-2e-===PbO2+4H+ 石墨上包上铜镀层 Pb2++2e-===Pb 不能有效利用Pb2+ (2)4CO+2H2O-4e-===4HCO+O2↑ H2 电解池电极反应式的书写——“二判二析一写” 提升三 有关电解的计算 5.(2020·开封高三模拟)用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3 mol的OH-放电时,溶液显浅蓝色,则下列叙述正确的是( ) A.阳极上析出3.6 mL O2(标准状况) B.阴极上析出32 mg Cu C.阴极上析出11.2 mL H2(标准状况) D.阳极和阴极质量都无变化 解析:选B。用惰性电极电解CuSO4溶液时,电极反应为阴极:2Cu2++4e-===2Cu,阳极:4OH--4e-===O2↑+2H2O。当有1×10-3 mol的OH-放电时,生成标准状况下的O2为5.6 mL,在阴极上析出32 mg Cu,阴极质量增加。 6.在如图所示的装置中,若通直流电5 min时,铜电极质量增加2.16 g。试回答下列问题: (1)电源中X为直流电源的________极。 (2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”) (3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。 (4)若A中的KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为________(设电解前后溶液体积无变化)。 解析:(1)三个装置是串联的电解池。电解AgNO3溶液时,Ag+在阴极发生还原反应生成Ag,所以质量增加的铜电极是阴极,则银电极是阳极,Y是正极,X是负极。 (2)电解KCl溶液生成KOH,溶液pH增大;电解CuSO4溶液生成H2SO4,溶液pH减小;电解AgNO3溶液,银为阳极,不断溶解,Ag+浓度基本不变,pH不变。 (3)通电5 min时,C中析出0.02 mol Ag,电路中通过0.02 mol电子。B中共收集0.01 mol气体,若该气体全为氧气,则电路中需通过0.04 mol电子,电子转移不守恒。因此,B中电解分为两个阶段,首先电解CuSO4溶液,生成O2和Cu,然后电解水,生成O2和H2,B中收集到的气体是O2和H2的混合物。设电解CuSO4溶液时生成O2的物质的量为x,电解H2O时生成O2的物质的量为y,生成H2的物质的量为2y,则4x+4y=0.02 mol(电子转移守恒),x+3y=0.01 mol(气体物质的量之和),解得x=y=0.002 5 mol,所以n(CuSO4)=2×0.002 5 mol=0.005 mol,c(CuSO4)=0.005 mol÷0.2 L=0.025 mol·L-1。 (4)通电5 min时,A中放出0.01 mol H2,溶液中生成0.02 mol KOH,c(OH-)=0.02 mol÷0.2 L=0.1 mol·L-1,pH=13。 答案:(1)负 (2)增大 减小 不变 (3)0.025 mol·L-1 (4)13 解电解计算题的常用方法 学习任务2 电解原理的应用 1.电解饱和食盐水 (1)电极反应 阳极:2Cl--2e-===Cl2↑(反应类型:氧化反应); 阴极:2H++2e-===H2↑(反应类型:还原反应)。 (2)总反应化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑; 总反应离子方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑。 (3)应用:氯碱工业制烧碱、氯气和氢气。 2.电镀和电解精炼铜 电镀(以Fe上镀Cu为例) 电解精炼铜 阳极 电极 材料 镀层金属铜 粗铜(含Zn、Fe、 Ni、Ag、Au等杂质) 电极 反应 Cu-2e-===Cu2+ Zn-2e-===Zn2+、 Fe-2e-===Fe2+、 Ni-2e-===Ni2+、 Cu-2e-===Cu2+ 阴极 电极 材料 待镀金属铁 纯铜 电极 反应 Cu2++2e-===Cu 电解质溶液 含Cu2+的盐溶液 注:(1)电镀时,溶液中离子浓度保持不变; (2)电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥 3.电冶金 利用电解熔融盐的方法来冶炼活泼金属Ca、Na、Mg、Al等。 (1)冶炼钠:2NaCl2Na+Cl2↑ 阳极:2Cl--2e-===Cl2↑; 阴极:2Na++2e-===2Na。 (2)冶炼镁:MgCl2Mg+Cl2↑ 阳极:2Cl--2e-===Cl2↑; 阴极:Mg2++2e-===Mg。 (3)冶炼铝:2Al2O34Al+3O2↑ 阳极:6O2--12e-===3O2↑; 阴极:4Al3++12e-===4Al。 1.判断正误,正确的打“√”,错误的打“×”。 (1)反应Cu+H2SO4===CuSO4+H2↑可以设计成电解池,但不能设计成原电池。( ) (2)电解饱和食盐水时,两个电极均不能用金属材料。( ) (3)根据得失电子守恒可知,电解精炼铜时,阳极减少的质量和阴极增加的质量相等。( ) (4)电解是把电能转变成化学能。( ) (5)电解质溶液导电是化学变化,金属导电是物理变化。( ) (6)任何水溶液电解时,必发生氧化还原反应。( ) 答案:(1)√ (2)× (3)× (4)√ (5)√ (6)√ 2.下列描述中,符合生产实际的是________(填序号)。 ①电解熔融的氧化铝制取金属铝,用铁做阳极 ②电解法精炼粗铜,用纯铜做阴极 ③电解饱和食盐水制烧碱,用涂镍碳钢网做阴极 ④在镀件上电镀锌,用锌做阳极 解析:①中电解熔融的氧化铝制取金属铝,应用石墨做阳极,若用铁做阳极,铁会被氧化。 答案:②③④ 3.(教材改编题)完成下列各小题: (1)电解饱和食盐水过程中,阳离子交换膜的作用为_____________________。 (2)电解过程中A中CuSO4溶液浓度__________,而B中CuSO4溶液浓度____________。 (3)如图电解的目的是在铝表面形成一层致密的氧化膜。 阳极反应式:_____________________________________; 阴极反应式:____________________________________。 答案:(1)只允许阳离子通过,阻碍Cl2分子、阴离子通过,防止Cl2和NaOH反应 (2)逐渐减小 基本不变 (3)2Al-6e-+6HCO===Al2O3+6CO2↑+3H2O 6H2O+6e-===3H2↑+6OH- 提升一 电解原理的“常规”应用 1.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( ) A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑ B.电解精炼铜时,Z溶液中的Cu2+浓度不变 C.在铁片上镀铜时,Y是纯铜 D.制取金属镁时,Z是熔融的氯化镁 解析:选D。氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,由于粗铜中含有锌、铁、镍等杂质,溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。 2.(双选)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( ) A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni B.电解过程中,阳极质量的减少与阴极质量的增加不等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中有Cu和Pt 解析:选BD。阳极应发生氧化反应:Ni-2e-===Ni2+,A错;由于Fe、Zn的还原性大于Ni,所以阳极同时还发生:Zn-2e-===Zn2+、Fe-2e-===Fe2+,比较两电极反应,因Fe、Zn、Ni的相对原子质量不等,当两极通过的电量相等时,阳极减少的质量与阴极增加的质量不相等,B正确;纯镍做阴极,电解质溶液中需含有Ni2+,因Ni2+的氧化性大于Fe2+和Zn2+,所以溶液中阳离子有Fe2+、Zn2+和Ni2+,C错;Cu、Pt还原性小于Ni,所以不反应,D正确。 提升二 电解原理的“不寻常”应用 3.(2017·高考海南卷)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( ) A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-===2NH3 C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2 解析:选A。此装置为电解池,总反应是N2+3H22NH3,Pd电极b上是氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;根据A选项分析,Pd电极a为阴极,反应式为N2+6H++6e-===2NH3,故B说法正确;H+在阴极上与N2反应,则H+由阳极移向阴极,故C说法正确;根据装置图,陶瓷可以隔离N2和H2,故D说法正确。 4.工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO-2e-===S2O+2H+。下列说法正确的是( ) A.阴极电极反应式为Pb+HSO-2e-===PbSO4+H+ B.阳极反应中S的化合价升高 C.S2O中既存在非极性键又存在极性键 D.可以用铜电极做阳极 解析:选C。Na2S2O8的结构为,由此结构可以判断出以下信息:S2O中含硫氧极性键和氧氧非极性键;S的化合价为+6价,中间的两个O均为-1价,其他的O均为-2价;电解时阳极的HSO中O失去电子,S未变价;阴极电极反应式为2H++2e-===H2↑;若用铜电极做阳极,则阳极反应为Cu-2e-===Cu2+。综上所述,C项正确。 5.(1)根据2CrO+2H+Cr2O+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________。 (2)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下: 电解池中隔膜仅阻止气体通过,阴、阳两极均为惰性电极。 ①A极为________,电极反应式为___________________________________。 ②B极为________,电极反应式为___________________________________。 解析:(1)根据NaOH溶液浓度的变化及Na+交换膜,左侧为阴极区域,右侧为阳极区域,电极反应式为 阴极:4H2O+4e-===2H2↑+4OH-; 阳极:4OH--4e-===O2↑+2H2O。 (2)H2产生是因为H2O在阴极上得电子,即6H2O+6e-===3H2↑+6OH-,所以B极为阴极,A极为阳极,电极反应式为CO(NH2)2-6e-+8OH-===N2↑+CO+6H2O,阳极反应式容易错写成4OH--4e-===2H2O+O2↑。 答案:(1)正 4OH--4e-===O2↑+2H2O (2)①阳极 CO(NH2)2+8OH--6e-===N2↑+CO+6H2O ②阴极 6H2O+6e-===3H2↑+6OH- 电解原理应用中的注意要点 (1)阳离子交换膜(以电解NaCl溶液为例)只允许阳离子(Na+、H+)通过,而阻止阴离子(Cl-、OH-)和分子(Cl2)通过,这样既能防止H2和Cl2混合爆炸,又能避免Cl2和NaOH溶液作用生成NaClO影响烧碱质量。 (2)电解或电镀时,电极质量减少的电极必为金属电极——阳极;电极质量增加的电极必为阴极,即溶液中的金属阳离子得电子生成金属附着在阴极上。 (3)电解精炼铜,粗铜中含有的Zn、Fe、Ni等活泼金属失去电子,变成金属阳离子进入溶液,其活泼性小于铜的杂质以阳极泥的形式沉积。电解过程中电解质溶液中的Cu2+浓度会逐渐减小。 学习任务3 金属的腐蚀与防护 1.化学腐蚀和电化学腐蚀的比较 类型 化学腐蚀 电化学腐蚀 条件 金属与接触到的物质直接反应 不纯金属接触到电解质溶液发生原电池反应 本质 M-ne-===Mn+ 现象 金属被腐蚀 较活泼金属被腐蚀 区别 无电流产生 有电流产生 联系 两者往往同时发生,电化学腐蚀更普遍 2.钢铁的析氢腐蚀和吸氧腐蚀 类型 析氢腐蚀 吸氧腐蚀 水膜性质 酸性 弱酸性或中性 负极反应 Fe-2e-===Fe2+ 正极反应 2H++2e-===H2↑ 2H2O+O2+4e-===4OH- 总反应 Fe+2H+===Fe2++H2↑ 2Fe+O2+2H2O===2Fe(OH)2 其他反应 铁锈的形成:4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O 3.金属的防护 (1)电化学防护 ①牺牲阳极的阴极保护法——利用原电池原理 负极(阳极)是做保护材料的金属,正极(阴极)是被保护的金属设备。 ②外加电流的阴极保护法——利用电解原理 阴极是被保护的金属设备;阳极是惰性电极。 (2)其他方法 ①改变金属内部结构,如制成合金; ②使金属与空气、水等物质隔离,如电镀、喷油漆等。 1.判断正误,正确的打“√”,错误的打“×”。 (1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。( ) (2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。( ) (3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。( ) (4)(2018·高考天津卷)铁管镀锌层局部破损后,铁管仍不易生锈。( ) (5)外加电流的阴极保护法构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀。( ) 解析:(1)银器表面变黑,主要是生成Ag2S,钢铁表面生锈是生成Fe2O3·nH2O,原理不同,错误;(2)铜是生成“铜绿”[Cu2(OH)2CO3],错误;(3)钢铁腐蚀时,负极铁失电子生成Fe2+,错误。 答案:(1)× (2)× (3)× (4)√ (5)√ 2.如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为________________。 解析:①是Fe为负极、杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢。②③④均为原电池,③中Fe为正极,被保护;②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活泼性差别大于Fe和Sn的活泼性差别,故FeCu原电池中Fe被腐蚀的较快。⑤是Fe接电源正极做阳极,Cu接电源负极做阴极的电解腐蚀,加快了Fe的腐蚀。⑥是Fe接电源负极做阴极,Cu接电源正极做阳极的电解腐蚀,防止了Fe的腐蚀。故铁在海水中被腐蚀的速率由快到慢的顺序为⑤④②①③⑥。 答案:⑤④②①③⑥ 提升一 金属的腐蚀 1.一定条件下,碳钢腐蚀与溶液pH的关系如下表。 pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 FeO 下列说法错误的是( ) A.当pH<4时,碳钢主要发生析氢腐蚀 B.当pH>6时,碳钢主要发生吸氧腐蚀 C.当pH>14时,正极反应为O2 + 4H+ + 4e-===2H2O D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓 解析:选C。当pH>14时,正极反应为O2+4e-+2H2O===4OH-。 2.(2019·高考江苏卷)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( ) A.铁被氧化的电极反应式为Fe-3e-===Fe3+ B.铁腐蚀过程中化学能全部转化为电能 C.活性炭的存在会加速铁的腐蚀 D.以水代替NaCl溶液,铁不能发生吸氧腐蚀 解析:选C。A项,铁和炭的混合物用NaCl溶液湿润后构成原电池,铁做负极,铁失去电子生成Fe2+,电极反应式为Fe-2e-===Fe2+,错误;B项,铁腐蚀过程中化学能除了转化为电能外,还有少部分转化为热能等,错误;C项,构成原电池后,铁腐蚀的速率变快, 正确;D项,用水代替NaCl溶液,Fe和炭也可以构成原电池,Fe失去电子,空气中的O2得到电子,铁发生吸氧腐蚀,错误。 提升二 金属的防护 3.(2017·高考全国卷Ⅰ)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 解析:选C。依题意,钢管桩为阴极,电子流向阴极,阴极被保护,钢管桩表面腐蚀电流是指铁失去电子形成的电流,接近于0,铁不容易失去电子,A项正确;阳极上发生氧化反应,失去电子,电子经外电路流向阴极,B项正确;高硅铸铁做阳极,阳极上发生氧化反应,阳极上主要是海水中的水被氧化生成氧气,惰性辅助阳极不被损耗,C项错误;根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D项正确。 4.对金属制品进行抗腐蚀处理,可延长其使用寿命。 (1)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________________。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是________________________________________________________________________。 在此过程中,两个电极上质量的变化值:阴极________阳极(填“>”“<”或“=”)。 (3)利用如图所示装置,可以模拟铁的电化学防护。 若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该电化学防护法称为________________________。 解析:(3)铁被保护,可以做原电池的正极或电解池的阴极。故若X为碳棒,开关K应置于N处,Fe做阴极受到保护;若X为锌,开关K置于M处,铁做正极,称为牺牲阳极的阴极保护法。 答案:(1)2Al+3H2O-6e-===Al2O3+6H+ (2)能向电镀液中不断补充Cu2+,使电镀液中的Cu2+浓度保持恒定 = (3)N 牺牲阳极的阴极保护法 (1)金属腐蚀的本质是金属失去电子,发生氧化反应。 (2)酸性条件下铁易发生析氢腐蚀,弱酸性和中性条件下铁易发生吸氧腐蚀,后者更普遍。 (3)金属防护的方法有覆盖保护层法、牺牲阳极的阴极保护法、外加电流的阴极保护法、改变金属内部结构法等。 1.(2019·高考江苏卷)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如图。 (1)写出阴极CO2还原为HCOO-的电极反应式:_________________________。 (2)电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_________________________。 解析:(1)CO2中的C为+4价,HCOO-中的C为+2价,1 mol CO2转化为HCOO-时,得2 mol e-。(2)阳极上水放电,生成O2和H+,H+会与HCO反应使HCO减少,由电荷平衡可知,K+会移向阴极区,所以KHCO3溶液浓度降低。 答案:(1)CO2+H++2e-===HCOO-或CO2+HCO+2e-===HCOO-+CO (2)阳极产生O2,pH减小,HCO浓度降低;K+部分迁移至阴极区 2.(2018·高考江苏卷)用稀硝酸吸收NOx(主要指NO和NO2),得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________________________________________________________。 解析:电解时阳极HNO2失去电子生成HNO3,同时消耗水,得到较浓的硝酸,电极反应式为HNO2-2e-+H2O===3H++NO。 答案:HNO2-2e-+H2O===3H++NO 3.(2018·高考北京卷)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。 ① ② ③ 在Fe表面生成蓝色沉淀 试管内无明显变化 试管内生成蓝色沉淀 下列说法不正确的是( ) A.对比②③,可以判定Zn保护了Fe B.对比①②,K3[Fe(CN)6]可能将Fe氧化 C.验证Zn保护Fe时不能用①的方法 D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼 解析:选D。②中Zn做负极,发生氧化反应生成Zn2+,Fe做正极被保护,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,试管内无明显变化。但③中没有Zn保护Fe,Fe在酸性环境中发生析氢腐蚀,Fe做负极被氧化生成Fe2+,所以取出的少量Fe附近的溶液中滴入铁氰化钾溶液,生成蓝色沉淀,对比②③可知Zn保护了Fe,A项正确;①与②的区别在于:前者是将铁氰化钾溶液直接滴入烧杯中,而后者是在取出的少量Fe附近的溶液中滴加铁氰化钾溶液,①中出现了蓝色沉淀,说明有Fe2+生成。对比分析可知,可能是铁氰化钾氧化Fe生成了Fe2+,B项正确;通过上述分析可知,验证Zn保护Fe时不能用①的方法,C项正确;若将Zn换成Cu,铁氰化钾仍会将Fe氧化为Fe2+,在铁的表面同样会生成蓝色沉淀,所以无法判断Fe2+是不是负极产物,即无法判断Fe与Cu的活动性,D项错误。 4.(2017·高考全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 解析:选C。利用电解氧化法在铝制品表面形成致密的Al2O3薄膜,即待加工铝质工件做阳极,A项正确;阴极与电源负极相连,对阴极电极材料没有特殊要求,可选用不锈钢网等,B项正确;电解质溶液呈酸性,阴极上应是H+放电,C项错误;在电解过程中,电解池中的阴离子向阳极移动,D项正确。 一、单项选择题 1.下列说法正确的是( ) A.氯碱工业中,烧碱在阳极区生成 B.电解熔融氯化铝冶炼金属铝 C.电镀时,用镀层金属做阳极 D.将钢闸门与外接电源正极相连,可防止其腐蚀 解析:选C。A项,水中的H+在阴极放电,溶液中c(OH-)增大,烧碱在阴极区生成,错误;B项,氯化铝是共价化合物,熔融状态不导电,错误;C项,电镀时,镀层金属做阳极,镀件做阴极,正确;D项,将钢闸门与外接电源负极相连,做阴极(外加电流阴极保护法),可防止其腐蚀,错误。 2.电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。下列叙述中正确的是( ) A.是原电池装置,把化学能转化为电能 B.是电解装置,只发生物理变化 C.左右池中得到淡水 D.A膜是阴离子交换膜,B膜是阳离子交换膜 解析:选D。A项,该装置有外接电源,是电解池,错误;B项,电解过程发生化学反应,错误;a为阳极,海水中的Cl-、OH-放电,海水中的阴离子透过阴离子交换膜进入左池,b为阴极,海水中的H+放电,海水中的阳离子透过阳离子交换膜进入右池,所以左右两池得不到淡水,中间得到的是淡水,C错误,D正确。 3.探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( ) A.精炼铜时,电解质为硫酸铜溶液,X电极反应为Cu2++2e-===Cu B.精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 C.X电极为石墨,Y电极为Cu,则铜受到保护 D.X电极为Fe,Y电极为Cu,则铁受到保护 解析:选C。A项,精炼铜时,X为阳极,铜及比铜活泼的金属失电子,错误;B项,Ag的金属性弱于铜,不会在阳极放电,以沉淀形式形成阳极泥,错误;C项,Y为阴极,受到保护,正确;D项,X为阳极,铁作阳极,优先失电子,错误。 4.(2020·镇江高三检测)如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是下表中的( ) 选项 a极板 b极板 X Z A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2 解析:选A。由题意知,通电后a极板质量增加,说明有金属析出,由此可知,a极为电解池的阴极,则X为电源负极,B、C均不符合;又b处放出的是无色、无味的气体,D不符合。 5.(2020·山西四校联考)500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO)=0.3 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( ) A.原混合溶液中c(Na+)=0.2 mol·L-1 B.电解后溶液中c(H+)=0.2 mol·L-1 C.上述电解过程中共转移0.4 mol电子 D.电解后得到的Cu的物质的量为0.1 mol 解析:选B。阳极是阴离子放电,放电能力:OH->NO,根据题给信息,阳极一定是OH-放电,生成0.05 mol氧气,转移0.2 mol电子;阴极离子放电能力:Cu2+>H+>Na+,所以Cu2+先放电,然后是H+放电,阴极生成0.05 mol氢气时,转移0.1 mol电子,根据得失电子守恒知,Cu2+转移0.1 mol电子,n(Cu2+)=0.05 mol。所以原溶液中n[Cu(NO3)2]=0.05 mol,又n(NO)=0.3 mol·L-1×0.5 L=0.15 mol,则n(NaNO3)=0.05 mol。原混合溶液中c(Na+)=0.1 mol·L-1,A项错误;结合以上分析及电解总方程式Cu2++2H2OCu+H2↑+O2↑+2H+可知,生成0.05 mol Cu、0.05 mol O2、0.05 mol H2和0.1 mol H+,电解后溶液中c(H+)==0.2 mol·L-1,B项正确,D项错误;上述电解过程中共转移0.2 mol电子,C项错误。 6.用石墨电极完成下列电解实验。 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产生;…… 下列对实验现象的解释或推测不合理的是( ) A.a、d处:2H2O+2e-===H2↑+2OH- B.b处: 2Cl--2e-===Cl2↑ C.c处发生了反应:Fe-2e-===Fe2+ D.根据实验一的原理,实验二中m处能析出铜 解析:选B。由于有外接电源,所以实验一和实验二均为电解池装置。实验一中,a为阴极,c为阳极,d为阴极,b为阳极。a、d处发生反应2H2O+2e-===H2↑+2OH-,A项正确;若b处发生反应2Cl--2e-===Cl2↑,不足以解释b处“变红”和“褪色”现象,B项错误;c处铁做阳极,发生反应Fe-2e-===Fe2+,由于生成的Fe2+浓度较小,且pH试纸本身有颜色,故颜色上无明显变化,C项正确;实验二中,两个铜珠的左端均为阳极,右端均为阴极,初始时两个铜珠的左端(阳极)均发生反应Cu-2e-===Cu2+,右端(阴极)均发生反应2H++2e-===H2↑,一段时间后,Cu2+移动到m处,m处附近Cu2+浓度增大,发生反应Cu2++2e-===Cu,m处能生成铜,D项正确。 二、不定项选择题 7.SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是( ) A.a极为直流电源的正极,与其相连的电极发生氧化反应 B.阴极得到2 mol电子时,通过阳离子交换膜的H+为2 mol C.吸收池中发生反应的离子方程式为2NO+2S2O+2H2O===N2+4HSO D.阳极的电极反应式为SO2+2e-+2H2O===SO+4H+ 解析:选AD。A项,阴极发生还原反应,HSO得电子生成S2O,a极为直流电源的负极,错误;B项,阴极发生还原反应,电极反应式为2HSO+2e-+2H+===S2O+2H2O,阴极得到2 mol电子时,通过阳离子交换膜的H+为2 mol,正确;C项,吸收池中S2O与NO发生氧化还原反应生成N2和HSO,离子方程式为2NO+2S2O+2H2O===N2+4HSO,正确;D项,阳极发生失去电子的氧化反应,电极反应式为SO2-2e-+2H2O===SO+4H+,错误。 8.(2020·连云港高三一诊)一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( ) A.外电路电子的移动方向:A→电源→B B.气体X在反应中通常体现还原性 C.电极D为惰性电极,E为活泼电极 D.电极D的电极反应式为C6H6+6H++6e-===C6H12 解析:选D。苯→环己烷,相当于加氢,为还原反应,所以电极D为阴极,电极E为阳极,A为负极,B为正极。A项,电子由A极→电极D,电极E→B极,错误;B项,阳极OH-放电生成氧气,气体X为氧气,通常表现氧化性,错误;C项,E为阳极,若活泼电极为阳极,优先失电子,无气体X生成,错误。 9.(2020·扬州模拟)H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图。下列叙述错误的是( ) A.M室发生的电极反应式为2H2O-4e-===O2↑+4H+ B.N室中:a%>b% C.Ⅱ膜为阴膜,产品室发生反应的化学原理为强酸制弱酸 D.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体 解析:选BD。A项,M室为阳极室,发生氧化反应,电极反应式为2H2O-4e-===O2↑+4H+,正确;B项,N室为阴极室,H2O得电子发生还原反应,生成H2和OH-,溶液中OH-浓度增大,即a%查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档