- 2021-05-06 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习化学反应原理的综合应用课件(27张)(全国通用)
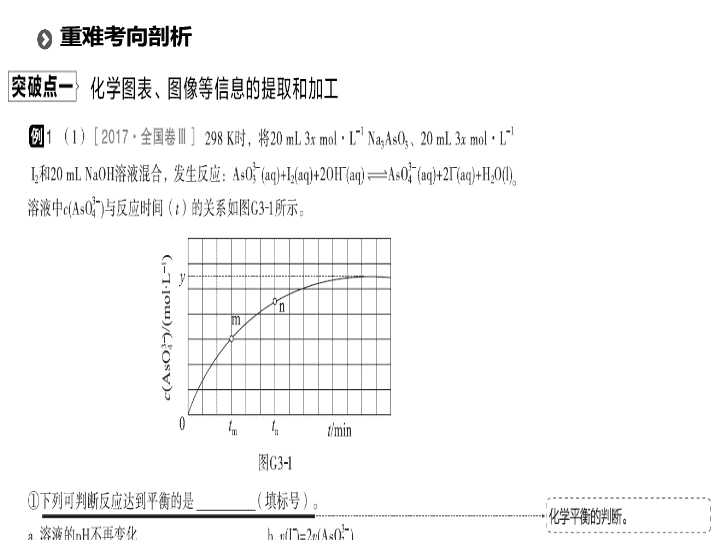
题型三 化学反应原理的综合应用 高考 题型突破 重难考向剖析 题型强化训练 · · 题型特点 本题型一般取材于能源、环境问题、化工生产等情景,题目围绕一个主题,以 “ 拼盘 ” 的形式呈现,将热化学、化学反应速率、电化学及三大平衡知识融合在一起进行考查,每个小题相对独立;题目中结合图像、表格、数据、装置等信息,考查考生的阅读、读图、分析归纳能力,试题的难度增加。考点主要涉及盖斯定律与热化学方程式、化学反应速率的计算及其影响因素的分析、平衡常数计算及其影响因素的分析、化学平衡移动及其影响因素的分析、电极反应方程式书写等。 重难考向剖析 解题策略 1 .图表类分析 ①明义:明确图表所呈现的化学含义 ( 图表的含义 ) ,如物质的量浓度变化 [ 质量分数变化 ] 与时间二维关系。 ②辨数:通过图表明确相应数学规律,即变化趋势等,如:正向或反向变化、极值点等。 ③析理:结合题意及图表规律分析确定其对应的化学原理,并提炼出相应变化规律及原因。 2 .图像类分析 ①明标:明晰横、纵坐标所表示的化学含义,这是理解题意和进行正确思维的前提。明晰坐标含义,也就是用变量的观点分析坐标,找出横、纵坐标的关系,再结合教材,联系相应的知识点。 ②找点:找出曲线中的特殊点 ( 起点、顶点、拐点、终点、交叉点、平衡点等 ) ,分析这些点所表示 的化学意义以及影响这些点的主要因素及限制因素等,大多考题就落在这些点的含义分析上,因为这些点往往隐含着某些限制条件或某些特殊的化学含义。 ③析线:正确分析曲线的走向、变化趋势 ( 上升、下降、平缓、转折等 ) ,同时对走势有转折变化的曲线,要分区段进行分析,研究找出各段曲线的变化趋势及其含义。 在绘制图像时通常题目会有参考的曲线,在分析新的条件与原曲线的关系的基础上进行绘制。 【 答案 】 (1)ⅰ. 氢气是产物之一,随着 n ( 氢气 )/ n ( 丁烷 ) 增大,逆反应速率增大 ⅱ . 升高温度有利于反应向吸热方向进行 温度升高反应速率加快 丁烯高温裂解生成短链烃类 (2)ⅰ. 两个反应均为放热量大的反应 降低温度降低压强 催化剂 ⅱ . 不是 该反应为放热反应,平衡产率应随温度升高而降低 AC ⅲ .1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1 ∶ 7.5 ∶ 1 【 解析 】 (1)ⅰ. 由题意可知 H 2 的作用是活化催化剂,同时是反应的产物,因此会促使平衡逆向移动,随着 n ( 氢气 )/ n ( 丁烷 ) 增大,逆反应速率增大,丁烯产率下降。 ⅱ. 温度升高则反应速率加快,相同时间内生成的丁烯会更多,同时由于反应是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯;当温度高于 590 ℃ 时,因丁烯高温会裂解生成短链烃类,导致丁烯的产率降低。 (2)ⅰ. 由题意可知,反应 ① 、 ② 都是放热反应,反应 ① 、 ② 中 1 mol 丙烯完全反应,分别放出 515 kJ 和 353 kJ 热量,两反应均符合化学反应自发进行的焓判据;反应 ① 的正反应是气体体积增大的放热反应,由勒夏特列原理可知,降温、减压均能使反应 ① 的化学平衡向正反应方向移动,提高丙烯腈平衡产率;催化剂具有高度的专一性,因此提高丙烯腈反应选择性的关键因素是催化剂,而非温度、 压强。 ⅱ. 反应 ① 的正反应是放热反应,如果已经达到化学平衡状态,当投料、压强、浓度等变量不变时,升温能使平衡左移,丙烯腈的产率逐渐减小,读图可知,低于 460 ℃ 时,丙烯腈的产率不是对应温度下的平衡产率。温度高于 460 ℃ 时,催化剂活性可能降低,导致丙烯腈产率降低, A 项正确;反应 ① 的正反应是放热反应,升温使平衡逆向移动,平衡常数逐渐变小, B 项错误;温度高于 460 ℃时,副反应进行程度可能增大,反应 ① 进行程度减小,导致丙烯腈产率降低, C 项正确;反应活化能与催化剂有关,与温度、压强、浓度等无关,升高温度,不能使反应活化能改变, D 项错误。 ⅲ. 读图可知,最佳 n ( 氨 )/ n ( 丙烯 ) 约为 1 ,因为该比例下丙烯腈产率最高,而副产物丙烯醛产率最低。由反应 ① 的热化学方程式可知,进料气中氨、氧气、丙烯气体的理论体积之比为 1∶1.5∶1 ,空气中氧气的体积分数约为 1/5( 氮气约占 4/5) ,则进料气中氨、空气、丙烯的理论体积比约为 1∶ ( 1.5 ÷ 1/5 )∶ 1 = 1 ∶ 7.5 ∶ 1 。 解题策略 (1) 通读全题:明确题中有哪些考点,并弄清相关考点的上下文联系,如:盖斯定律与平衡移动间的关系等。 (2) 准确定位:即准确判断该题中针对文字表达的知识点。通过题中所给信息确定文字表达知识点所涉及的化学原理、化学规律,如针对:速率变化、平衡移动、主副反应间关系等。该点是解决此类题目的重中之重,若能准确判断所考查的原理,则文字表述便是水到渠成。 (3) 文字表述:先讲普遍原理,再结合本题论述。如:某反应正向吸热,因此升温有利于该反应正向进行。 1 .碳及其化合物在有机合成、能源开发等方面具有十分广泛的应用。 Ⅰ . 工业生产精细化工产品乙二醛 (OHC—CHO) (1) 乙醛 (CH 3 CHO) 液相硝酸氧化法 在 Cu(NO 3 ) 2 催化下,用稀硝酸氧化乙醛制取乙二醛,此反应的化学方程式为 __________ ,该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点: ___________ 。 (2) 乙二醇 (HOCH 2 CH 2 OH) 气相氧化法 ①已知: 2H 2 (g) + O 2 (g) ⇌ 2H 2 O(g) Δ H =- 484 kJ·mol - 1 ,化学平衡常数为 K 1 。 OHC — CHO(g) + 2H 2 (g) ⇌ HOCH 2 CH 2 OH(g) Δ H =- 78 kJ·mol - 1 ,化学平衡常数为 K 2 。 则乙二醇气相氧化反应 HOCH 2 CH 2 OH(g) + O 2 (g) ⇌ OHC — CHO(g) + 2H 2 O(g) 的 Δ H = ______ 。相同温度下,该反应的化学平衡常数 K = ________( 用含 K 1 、 K 2 的代数式表示 ) 。 专题强化训练 ②当原料气中氧醇比为 4∶3 时,乙二醛和副产物 CO 2 的产率与反应温度的关系如图 G36 所示。反应温度在 450 ~ 495 ℃ 之间和超过 495 ℃ 时,乙二醛产率降低的主要原因分别是 ____________ 、 ___________ 。 Ⅱ . 副产物 CO 2 的再利用 (3) 一定量的 CO 2 与足量的碳在体积可变的恒压密闭容器中发生反应 C(s) + CO 2 (g) ⇌ 2CO(g) ,平衡时,体系中气体体积分数与温度的关系如图 G37 所示,则下列说法正确的是 ______( 填字母 ) 。 A . 550 ℃时,若充入氢气,则 v 正 、 v 逆 均减小,平衡不移动 B . 650 ℃时,反应达平衡后 CO 2 的转化率为 25% C . T ℃时,若再充入等物质的量的 CO 2 和 CO ,平衡向逆反应方向移动 D . 925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 K p = 24.0 p 总 已知:计算用平衡分压代替平衡浓度,气体分压 ( p 分 ) =气体总压 ( p 总 )× 体积分数。 图 G36 图 G37 2 .工农业废水以及生活污水的大量排放造成水体污染。工业上处理水体中 NO 3 - 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下: (1) 先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。 ①除锈反应的离子方程式是 ______________________ 。 ②判断铁屑洗净的方法是 ___________________________ 。 (2) 将 KNO 3 溶液的 pH 调至 2.5 。 ①从氧化还原的角度分析调节溶液 pH 的原因是 ______________ 。 ②研究发现,若 pH 偏低将会导致 NO 3 - 的去除率下降,其原因是 ___________________ 。 (3) 将上述处理过的足量铁屑投入 (2) 的溶液中。图 G38 表示该反应过程中,体系内相关离子浓度、 pH 随时间变化关系。 t 1 时刻前该反应的离子方程式是 ____________________ 。 图 G38 (4) 工业上可用纳米铁粉处理地下水中的污染物。一定条件下,向 FeSO 4 溶液中滴加碱性 NaBH 4 溶液,溶液中 BH 4 - (B 元素的化合价为+ 3) 与 Fe 2 + 反应生成纳米铁粉、 H 2 和 B(OH) 4 - ,其离子方程式为 _______________ 。 (5) 铁炭混合物 ( 铁屑和活性炭的混合物 ) 也可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中 Cu 2 + 和 Pb 2 + 的去除率,结果 如图 G39 所示: ①当铁炭混合物中铁的质量分数为 0 时,也能去除少量的 Cu 2 + 和 Pb 2 + ,其原因是 ______ 。 ②当铁炭混合物中铁的质量分数大于 50% 时,随着铁的质量分数 的增加, Cu 2 + 和 Pb 2 + 的去除率不升反降,其主要原因是 ________ ___________ 。 图 G39查看更多