- 2021-05-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高一下学期化学人教版必修2教案 第一章第3节1
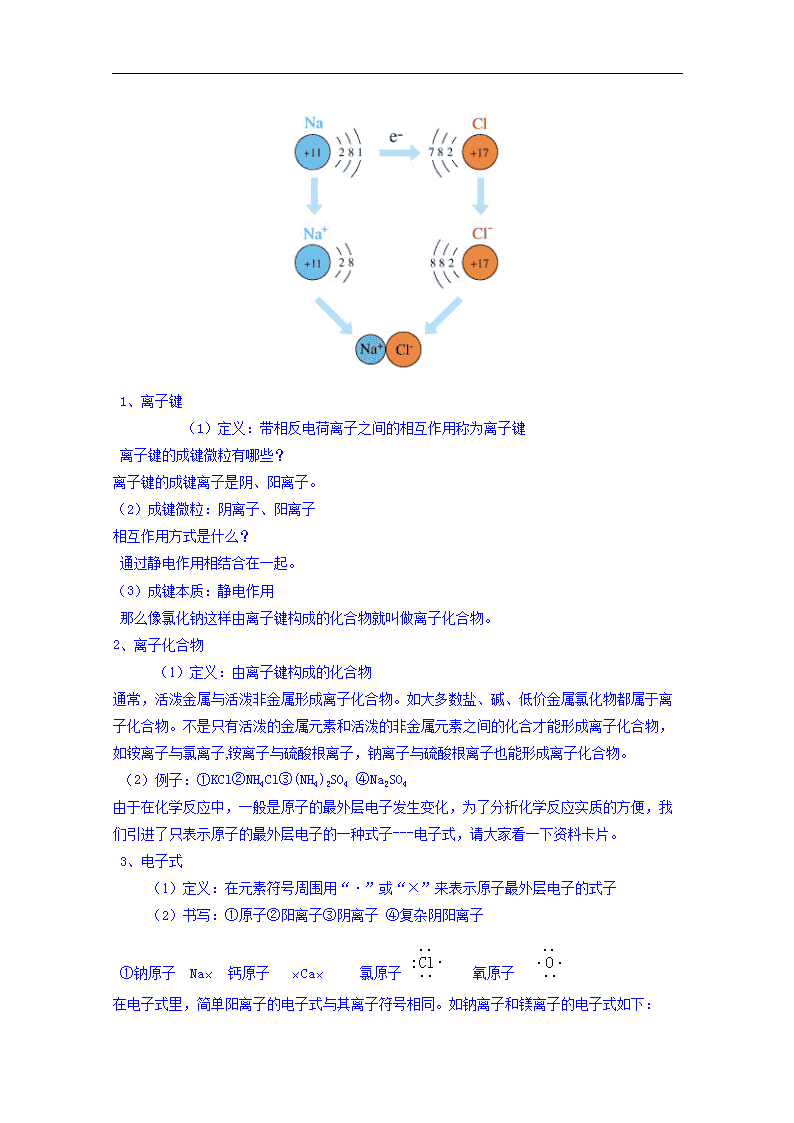
www.ks5u.com 第一章 物质结构 元素周期律 第三节 化学键 教学流程 引入→实验→提出问题“白烟”,宏观上观察到生成NaCl →从微观角度来解释,(利用图象化静为动,变抽象为形象,增强学生的感性认识,降低难点),得出离子键的概念→ 离子化合物的概念→电子式的定义→电子式书写原子阳离子阴离子→电子式书写离子化合物→电子式书写离子化合物的形成过程→总结(强化对概念的理解,应用以及化学用语书写的规范性)→作业 教学过程 从元素周期表我们可以看出,到目前为止,已经发现的元素只有一百多种。然而,这一百多种元素的原子组成的物质却数以千万计。那么,元素的原子通过什么作用形成如此丰富多彩的物质呢?下面我们一起来学习。 第三节 化学键 化学键可分为离子键、共价键、金属键等不同的类型。首先我们来学习离子键 一、离子键 讲解实验1-2 点燃 现象:剧烈燃烧,黄色火焰,产生白烟,黄绿色逐渐消失 反应方程式:2Na + Cl2 = 2NaCl 为什么有白烟? 是生成的NaCl的固体小颗粒。 金属钠与氯气反应,生成了离子化合物氯化钠,试用已经学过的原子结构的知识来分析氯化钠的形成过程。 原子在参加化学反应时,都有使自己的结构变成什么样的结构的倾向? 8电子稳定结构的倾向,当K层为最外层时为2电子稳定结构。 图解NaCl的形成过程(边画图边讲解)。 看图描述形成过程。 1、离子键 (1)定义:带相反电荷离子之间的相互作用称为离子键 离子键的成键微粒有哪些? 离子键的成键离子是阴、阳离子。 (2)成键微粒:阴离子、阳离子 相互作用方式是什么? 通过静电作用相结合在一起。 (3)成键本质:静电作用 那么像氯化钠这样由离子键构成的化合物就叫做离子化合物。 2、离子化合物 (1)定义:由离子键构成的化合物 通常,活泼金属与活泼非金属形成离子化合物。如大多数盐、碱、低价金属氯化物都属于离子化合物。不是只有活泼的金属元素和活泼的非金属元素之间的化合才能形成离子化合物,如铵离子与氯离子,铵离子与硫酸根离子,钠离子与硫酸根离子也能形成离子化合物。 (2)例子:①KCl②NH4Cl③(NH4)2SO4 ④Na2SO4 由于在化学反应中,一般是原子的最外层电子发生变化,为了分析化学反应实质的方便,我们引进了只表示原子的最外层电子的一种式子---电子式,请大家看一下资料卡片。 3、电子式 (1)定义:在元素符号周围用“·”或“×”来表示原子最外层电子的式子 (2)书写:①原子②阳离子③阴离子 ④复杂阴阳离子 ①钠原子 Na× 钙原子 ×Ca× 氯原子 氧原子 在电子式里,简单阳离子的电子式与其离子符号相同。如钠离子和镁离子的电子式如下: ② Na+、 Mg2+ 阴离子的电子式要在元素符号周围标出其最外层的8个电子,并用方括号括起来,同时在方括号的右上角标明离子所带的负电荷数。如;Cl-、O2-的电子式分别为 ③ 、 复杂的阴阳离子:我们先不讲了,学习完共价键再详细讲解。如NH4+ 、OH- 那么如何用电子式来表示离子化合物呢? 请同学们结合上面所讲的几点来思考一下NaCl应该如何表示? 4、用电子式表示离子化合物 (1)阳离子电子式和阴离子电子式组合 Na+[] 请同学们结合上面所讲的几点再来思考一下CaBr2应该如何表示? []Ca2+[] (2)相同离子要单个写,一般对称排列 那么最后如何用电子式来表示离子化合物的形成过程呢? 5、用电子式表示离子化合物的形成过程 氯化钠的形成过程可如下表示 Na×+→Na+[] 讲解式子中各种符号所表达的化学意义。 请大家用电子式表示离子化合物溴化钙的形成过程。 ×Ca×+2→[]Ca2+[] 请大家总结用电子式表示粒子及用电子式表示化合物形成过程时应注意的问题 (1)离子须标明电荷数 (2)相同的原子可以合并写,相同的离子要单个写 (3)阴离子要用方括号括起 (4)不能把“→”写成“=” (5)电子转移箭头可以不标 用电子式表示离子化合物和用电子式表示离子化合物的形成过程不是同一回事,不能混淆。如:氯化钠的电子式应写为 Na+[]而不是Na×+→Na+[] 本节课我们主要学习了化学键中的离子键及电子式的有关知识。知道离子键是带相反电荷离子之间的相互作用。电子式是在元素符号周围用“·”或“×”来表示原子最外层电子的式子,不仅可以用来表示原子、离子,还可以用来表示物质及物质的形成过程。重点要掌握用电子式表示离子化合物的形成过程。 习题7(1) 板书设计 一、 离子键 1、离子键 (1)定义:带相反电荷离子之间的相互作用称为离子键 (2)成键微粒:阴离子、阳离子 (3)成键本质:静电作用 2、离子化合物 (1)定义:由离子键构成的化合物 (2)例子:①KCl②NH4Cl③(NH4)2SO4 ④Na2SO4 3、电子式 (1)定义:在元素符号周围用“·”或“×”来表示原子最外层电子的式子 (2)书写:①原子②阳离子③阴离子 ④复杂阴阳离子 4、用电子式表示离子化合物 (1) 阳离子电子式和阴离子电子式组合 (2) 相同离子要单个写,一般对称排列 5、用电子式表示离子化合物的形成过程 (1)离子须标明电荷数 (2)相同的原子可以合并写,相同的离子要单个写 (3)阴离子要用方括号括起 (4)不能把“→”写成“=” (5)电子转移箭头可以不标 副板书设计(位于黑板最右边) 现象:剧烈燃烧,黄色火焰,产生白烟,黄绿色逐渐消失 反应方程式:2Na + Cl2 = 2NaCl 注意:到这里上面整版副板书可以考虑适时擦除 ①钠原子 Na× 钙原子 ×Ca× 氯原子 氧原子 ② Na+、 Mg2+ ③ 、 4、Na+[] []Ca2+[] 5、Na×+→Na+[] ×Ca×+2→[]Ca2+[] 注意:到这里上面整版副板书擦除,留足够的位置给两位学生上台来书写 作业:习题7(1) 查看更多