2019届一轮复习人教版素周期表与元素周期律学案
第2讲 元素周期表与元素周期律
考纲要求
1.掌握元素周期律的实质。
2.了解元素周期表(长式)的结构(周期、族)及其应用。
3.了解金属、非金属在元素周期表中的位置及其性质递变规律。
4.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
5.以第ⅠA族和第ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
考点一 元素周期表及其应用
1.原子序数
按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=质子数=核外电子数
2.编排原则
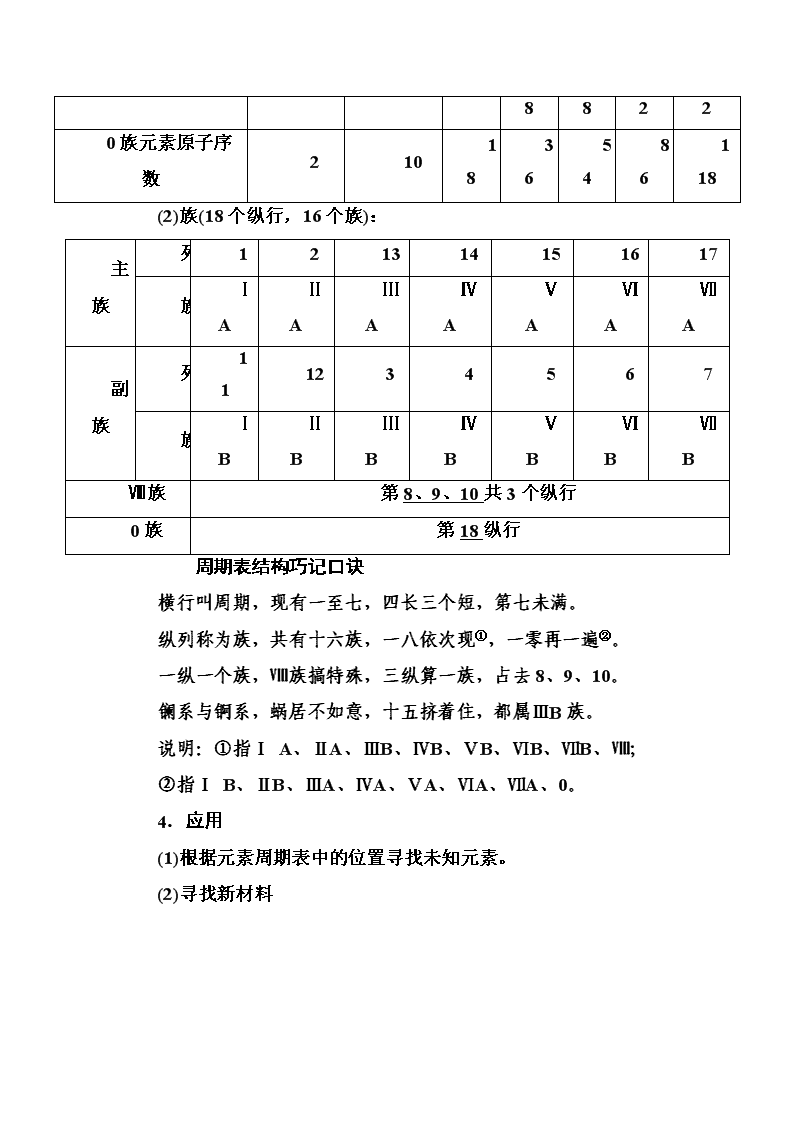
3.元素周期表的结构
(1)周期(7个横行,7个周期):
短周期
长周期
序号
1
2
3
4
5
6
7
元素种数
2
8
8
18
18
32
32
0族元素原子序数
2
10
18
36
54
86
118
(2)族(18个纵行,16个族):
主族
列
1
2
13
14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列
11
12
3
4
5
6
7
族
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ族
第8、9、10共3个纵行
0族
第18纵行
周期表结构巧记口诀
横行叫周期,现有一至七,四长三个短,第七未满。
纵列称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指Ⅰ A、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;
②指Ⅰ B、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
4.应用
(1)根据元素周期表中的位置寻找未知元素。
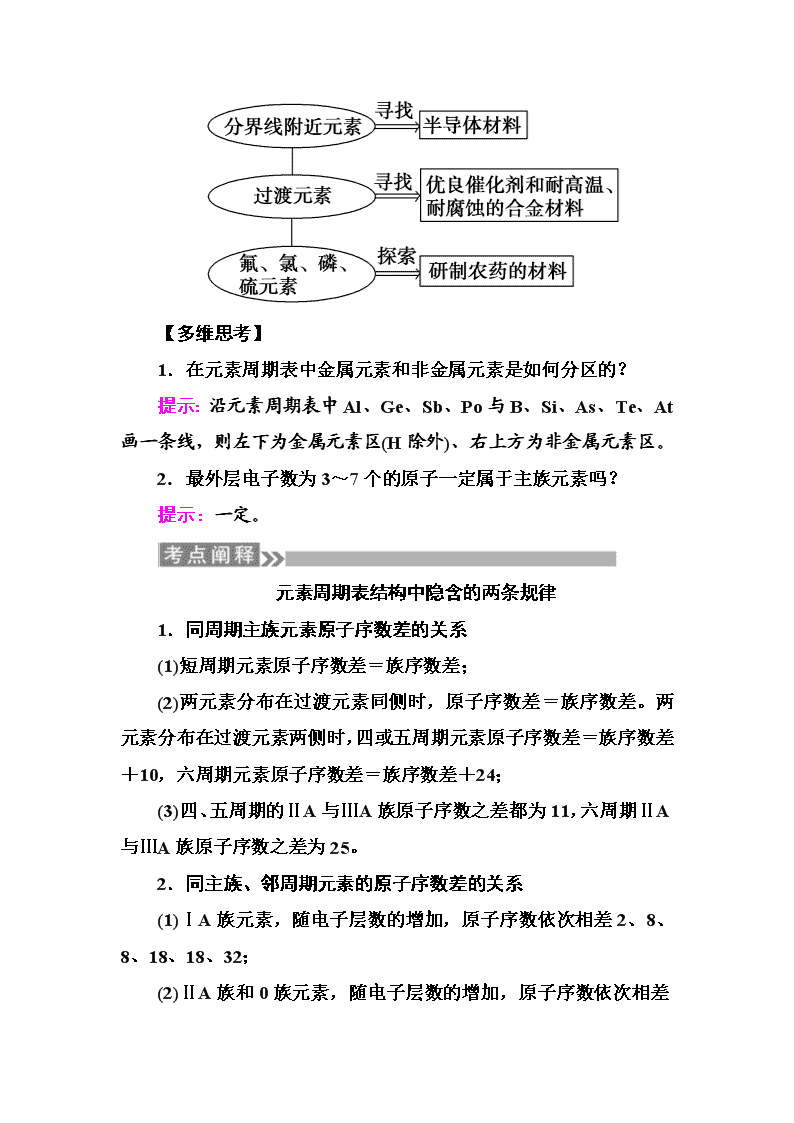
(2)寻找新材料
【多维思考】
1.在元素周期表中金属元素和非金属元素是如何分区的?
提示:沿元素周期表中Al、Ge、Sb、Po与B、Si、As、Te、At画一条线,则左下为金属元素区(H除外)、右上方为非金属元素区。
2.最外层电子数为3~7个的原子一定属于主族元素吗?
提示:一定。
元素周期表结构中隐含的两条规律
1.同周期主族元素原子序数差的关系
(1)短周期元素原子序数差=族序数差;
(2)两元素分布在过渡元素同侧时,原子序数差=族序数差。两元素分布在过渡元素两侧时,四或五周期元素原子序数差=族序数差+10,六周期元素原子序数差=族序数差+24;
(3)四、五周期的ⅡA与ⅢA族原子序数之差都为11,六周期ⅡA与ⅢA族原子序数之差为25。
2.同主族、邻周期元素的原子序数差的关系
(1)ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32;
(2)ⅡA族和0族元素,随电子层数的增加,原子序数依次相差
8、8、18、18、32;
(3)ⅢA~ⅦA族元素,随电子层数的增加,原子序数依次相差8、18、18、32。
考向 元素周期表的结构
1.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
解析:本题常因对元素周期表的结构掌握不牢固易造成错误。根据元素周期表中每周期所含有的元素的种类分别为2、8、8、18、18、32,分析比较得出C符合题意。
答案:C
2.如图为元素周
期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为 ( )
A.5x+10 B.5x
C.5x+14 D.5x+16
解析:
答案:A
3.若A、B是相邻周期同主族元素(A在B上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y),则x、y的关系为________。
解析:当A、B在ⅠA族和ⅡA族时,y=x+m,当A、B在ⅢA~ⅦA族时,y=x+n。
答案:y=x+m或y=x+n
考点二 元素周期律及应用
1.元素周期律
2.同周期、同主族元素性质的递变规律
同周期(从左到右)
同主族(从上到下)
原
电子层数
电子层数相同
电子层数逐渐增多
子
结
构
最外层电子数
最外层电子
数逐渐增多
最外层电子数相同
原子半径
逐渐减小
逐渐增大
元素性质
得电子能力
逐渐增强
逐渐减弱
失电子能力
逐渐减弱
逐渐增强
金属性
逐渐减弱
逐渐增强
非金属性
逐渐增强
逐渐减弱
主要化合价
最高正价:
由+1→+7
(O、F除外)
最低负价:
主族序数-8
最高正价数=主族
序数(O、F除外)
化合物的性质
最高价氧化
物对应水化
物的酸碱性
酸性逐渐增强
碱性逐渐减弱
酸性逐渐减弱
碱性逐渐增强
非金属元素
气态氢化物
的形成难易
及稳定性
气态氢化物的形成越来越容易,其稳定性逐渐增强
气态氢化物形成越来越困难,其稳定性逐渐减弱
气态氢化物的还原性
依次减弱
依次增强
3.元素周期律的应用
(1)预测元素及化合物的性质(根据递变规律)
①已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶。
②已知卤族元素的性质递变规律,可推知元素砹(At)应为黑色固体,与氢难化合,HAt不稳定,AgAt不溶于水等。
(2)科学预测
为新元素的发现及预测它们的原子结构和性质提供线索。
【感悟测评】
判断正误(正确的打“√”,错误的打“×”)
(1)元素的性质随相对原子质量的递增呈现周期性的变化。( )
(2)第三周期主族元素最高正化合价等于它所处的主族序数。( )
(3)同周期元素非金属性P
Cl>Br>I,则酸性:HF>HCl>HBr>HI。( )
(5)第ⅦA族最高正价都为+7价。( )
答案:(1)× (2)√ (3)√ (4)× (5)×
一、元素金属性和非金属性强弱的判断
1.根据元素在周期表中的位置
2.根据金属活动性顺序表
金属的位置越靠前,其金属性越强。
3.实验依据
(1)元素金属性强弱的比较
①根据金属单质与水(或酸)反应置换氢的难易程度:
Na、Mg、AlNa>Mg>Al
②根据金属单质与盐溶液的置换反应:
Fe置换出Cu⇒Fe>Cu
③根据最高价氧化物对应水化物的碱性强弱:
碱性:NaOH>Mg(OH)2>Al(OH)3⇒金属性:Na>Mg>Al
(2)元素非金属性强弱的比较
①根据非金属单质与H2化合的难易程度:
Cl2、Br2、I2Cl2>Br2>I2
②根据形成的氢化物的稳定性或还原性:
稳定性:H2O>H2S⇒非金属性:O>S
③根据非金属之间的相互置换:
Cl2置换出Br2⇒Cl>Br
④根据最高价氧化物对应水化物的酸性强弱:
酸性:H2SO4>H2CO3>H2SiO3⇒非金属性:S>C>Si
二、“位、构、性”之间的关系及应用
同一元素的“位、构、性”关系可表示如下:
1.由原子序数确定元素位置的规律
根据稀有气体元素的原子序数(He-2、Ne-10、Ar-18、Kr-36、Xe-54、Rn-86),就可由主族元素的原子序数推出主族元素的位置。若预测新元素,可与未发现的稀有气体元素(118号)比较,按上述方法推测知:114号元素应为第七周期第ⅣA族。
2.性质与位置互推问题是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
(1)元素的金属性、非金属性。
(2)气态氢化物的稳定性。
(3)最高价氧化物对应水化物的酸碱性。
(4)金属与H2O或酸反应的难易程度。
3.结构和性质的互推问题是解题的要素
(1)最外层电子数是决定元素原子的氧化性和还原性的主要原因。
(2)原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
(3)同主族元素最外层电子数相同,性质相似。
(4)判断元素金属性和非金属性的方法。
考向一 粒子半径大小比较
1.比较下列微粒半径大小,用“>”或“<”填空。
(1)Na________Mg________Cl
(2)Li________Na________K
(3)Na+________Mg2+________Al3+
(4)F-________Cl-________Br-
(5)Cl________O2-________Na+________Mg2+
(6)Fe2+________Fe3+
答案:(1)> > (2)< < (3)> > (4)< <
(5)> > > (6)>
2.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同的电子层结构的离子,关于A、B、C、D四种元素的叙述正确的是 ( )
A.离子半径:A>B>C>D
B.原子序数:b>a>c>d
C.原子半径:D>C>B>A
D.四种元素一定属于短周期元素
解析:由于四种离子具有相同的电子层结构,可以推知四种元素在周期表中的位置关系如图:
……
D
C
A
B
……
原子序数b>a>c>d;具有相同电子层结构的离子,核电荷数越大,离子半径越小;原子半径A>B>D>C;A和B可以为第四周期元素。
答案:B
【速记卡片】 微粒半径大小的比较依据
(1)同种元素的微粒
①r(阴离子)>r(原子)>r(阳离子)
②r(低价离子)>r(高价离子)
(2)同周期
①原子序数越大,元素原子半径越小。
②r(阴离子)>r(阳离子)。
(3)同主族
从上到下,原子半径、离子半径逐渐增大。
(4)电子层结构相同的微粒
原子序数越大,微粒半径越小。
考向二 元素的金属性、非金属性强弱比较
3.(2018·山东青岛统考)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是 ( )
①HCl的溶解度比H2S的大
②HCl的酸性比H2S的强
③HCl的稳定性比H2S的强
④还原性:Cl-O,A错误;B.W的最高价的氧化物的水化物是氢氧化钠,是强碱,B错误;C.氮气的氧化性比氧气弱,C错误;D.H、N、O可以组成HNO3等共价化合物,也可以组成NH4NO3等离子化合物,D正确。答案选D。
答案:D
3.(2017·高考全国卷Ⅱ)a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
解析:a、b、c、d分别为O、Na或Mg、Al、S。A.原子半径b>c>d>a,A错误;B正确;C.c的氧化物的水化物为氢氧化铝,为两性氢氧化物,是弱碱,C错误;D.S的氧化性比氧气弱,D错误。
答案:B
4.(2017·高考全国卷Ⅲ)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W
X
Y
Z
A.氢化物沸点:W<Z
B.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3<YZ3
D.简单离子的半径:Y<X
解析:由图表可知,W为N元素、X为O元素、Y为Al元素、Z为Cl元素;A.NH3分子间有氢键,其沸点比HCl高,故A错误;B.Al(OH)3显两性,N元素的氧化物对应的水化物HNO3、HNO2均显酸性,故B错误;C.Al2O3是离子晶体,高熔点,而AlCl3是分子晶体,熔点低,故C错误;D.Al3+和O2-离子结构相同,核电荷数大,离子半径小,故D正确。
答案:D
5.(2016·高考全国卷Ⅰ)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH为2,s
通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小WX>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
解析:短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,则Z是氯元素;0.01 mol·L–1 r溶液的pH为2,说明r是强酸,因此W是H;q的水溶液具有漂白性,s通常是难溶于水的混合物,根据转化关系图可知m是水,r是氯化氢,q是次氯酸,p是甲烷,因此X是碳元素,Y是氧元素。A.同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径的大小WZ>X,错误;C.Y的氢化物是H2O或H2O2,水或双氧水在常温常压下都为液态,正确;D.X的最高价氧化物的水化物碳酸为弱酸,错误。
答案:C
6.(2017·高考海南卷)X、Y、L、M为核电荷数依次增大的前20
号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为________________
_________________。
(2)X与M组成的物质为________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为_______________________________________________________。
(3)Y在周期表中的位置是________,其含氧酸的化学式为____________________________________________。
(4)L与M形成的化合物中L的化合价是________。
解析:X2为最轻的气体,即X为H,Y、L、M三种元素的质子数为5的倍数,质子数等于原子序数,质子数可能为5、10、15、20中的三个,四种元素为主族元素,因此质子数为10舍去,即三种元素分别为B、P、Ca,(1)形成简单化合物是PH3,其电子式为;(2)形成的化合物是CaH2,属于离子化合物,与水发生的反应是CaH2+2H2O===Ca(OH)2+H2↑;(3)Y为B,属于第二周期ⅢA族元素,其含氧酸为H3BO3;(4)形成的化合物是Ca3P2,其中P显-3价。
答案:(1)
(2)离子 CaH2+2H2O===Ca(OH)2+H2↑
(3)第二周期ⅢA族 H3BO3
(4)-3