高中化学选修3知识点总结复习过程
高 中 化 学 选 修 3 知 识
点 总 结
高中化学选修 3 知识点总结
二、复习要点
1、原子结构
2、元素周期表和元素周期律
3、共价键
4、分子的空间构型
5、分子的性质
6、晶体的结构和性质
(一)原子结构
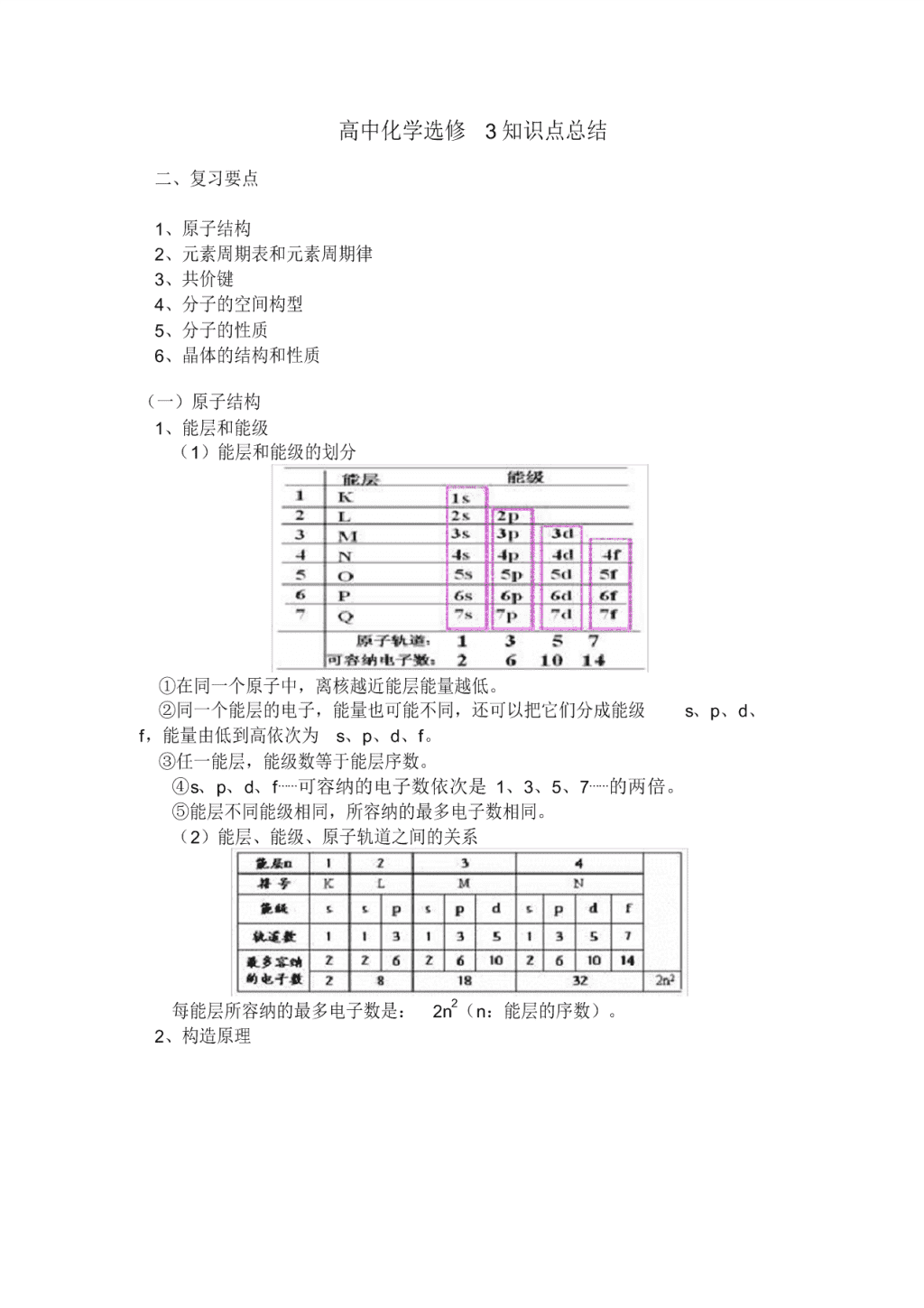
1、能层和能级
(1)能层和能级的划分
①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级 s、p、d、
f,能量由低到高依次为 s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f⋯⋯可容纳的电子数依次是 1、3、5、7⋯⋯的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系
每能层所容纳的最多电子数是: 2n2(n:能层的序数)。
2、构造原理
(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能
级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道
表示式的主要依据之一。
(3)不同能层的能级有交错现象,如 E(3d)> E(4s)、 E(4d)> E
(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、 E
(4f)>E(6s)等。原子轨道的能量关系是: ns<( n-2)f < (n-1)d <np
(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电
子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为
2n2 ;最外层不超过 8 个电子;次外层不超过 18 个电子;倒数第三层不超过 32
个电子。
(5)基态和激发态
①基态:最低能量状态。处于 最低能量状态 的原子称为 基态原子 。
②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量
后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子 。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和
放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的
光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或
利用特征谱线鉴定元素。
3、电子云与原子轨道
(1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们
用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的
概率密度分布,是核外电子运动状态的形象化描述。
(2)原子轨道:不同能级上的电子出现 概率 约为 90%的电子云空间轮廓
图 称为原子轨道。 s 电子的原子轨道呈 球形对称, ns 能级各有 1 个原子轨道;
p 电子的原子轨道呈纺锤形, np 能级各有 3 个原子轨道,相互垂直(用 px、
py、pz 表示); nd 能级各有 5 个原子轨道; nf 能级各有 7 个原子轨道。
4、核外电子排布规律
(1)能量最低原理:在基态原子里,电子优先排布在能量最低的能级里,
然后排布在能量逐渐升高的能级里。
(2)泡利原理: 1 个原子轨道里最多只能容纳 2 个电子,且自旋方向相
反。
(3)洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨
道,且自旋方向相同。
(4)洪特规则的特例:电子排布在 p、d、f 等能级时,当其处于全空 、半
充满或全充满时,即 p0、d0、f 0、p3、d5、f 7、p6、d10、f14,整个原子的能量最
低,最稳定。
能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到
能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状
态”。
电子数
(5)(n-1)d 能级上电子数等于 10 时,副族元素的族序数 =ns能级电子数
(二)元素周期表和元素周期律
1、元素周期表的结构
元素在周期表中的位置由原子结构决定:原子核外的能层数决定元素所在
的周期,原子的价电子总数决定元素所在的族。
(1)原子的电子层构型和周期的划分
周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排
列的一行元素。即元素周期表中的一个横行为一个周期,周期表共有七个周
期。同周期元素从左到右(除稀有气体外),元素的金属性逐渐减弱, 非金属
性逐渐增强。
(2)原子的电子构型和族的划分
族是指价电子数相同(外围电子排布相同),按照电子层数依次增加的顺
序排列的一列元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有
十八个列,十六个族。同主族周期元素从上到下,元素的金属性逐渐增强,非
金属性逐渐减弱。
(3)原子的电子构型和元素的分区
按电子排布可把周期表里的元素划分成 5 个区,分别为 s区、 p 区、 d 区、 f
区和 ds 区,除 ds区外,区的名称来自按构造原理最后填入电子的能级的符
号。
2、元素周期律
元素的性质随着核电荷数的递增发生周期性的递变,叫做元素周期律。元
素周期律主要体现在核外电子排布、原子半径、主要化合价、金属性、非金属
性、第一电离能、电负性等的周期性变化。元素性质的周期性来源于原子外电
子层构型的周期性。
(1)同周期、同主族元素性质的递变规律
同周期(左 右) 同主族(上 下)
原
子
结
构
核电荷数 逐渐增大 增大
能层(电子层)数 相同 增多
原子半径 逐渐减小 逐渐增大
元
素
性
化合价 最高正价由 +1 +7 负价
数 =( 8—族序数)
最高正价和负价数均相同,最
高正价数 =族序数
元素的金属性和非
金属性
金属性逐渐减弱,非金属
性逐渐增强
金属性逐渐增强,非金属性逐
渐减弱
质 第一电离能 呈增大趋势(注意反常
点:Ⅱ A 族和Ⅲ A 族、Ⅴ A
族和Ⅵ A 族)
逐渐减小
电负性 逐渐增大 逐渐减小
(2)微粒半径的比较方法
①同一元素:一般情况下元素阴离子的离子半径大于相应原子的原子半
径,阳离子的离子半径小于相应原子的原子半径。
②同周期元素(只能比较原子半径):随原子序数的增大,原子的原子半
径依次减小。如: Na>Mg>Al>Si>P>S>Cl
③同主族元素(比较原子和离子半径):随原子序数的增大,原子的原子
半径依次增大。如: Li
Na+>Mg2+>Al 3+
(3)元素金属性强弱的判断方法
金
属
性
比
较
本质 原子越易失电子,金属性越强。
判
断
依
据
1. 在金属活动顺序表中越靠前,金属性越强
2. 单质与水或非氧化性酸反应越剧烈,金属性越强
3. 单质还原性越强或离子氧化性越弱,金属性越强(电解中在阴极上得
电子的先后 )
4. 最高价氧化物对应水化物的碱性越强,金属性越强
5. 若 xn++y x+y m+ 则 y 比 x 金属性强
6. 原电池反应中负极的金属性强
7. 与同种氧化剂反应,先反应的金属性强
8. 失去相同数目的电子,吸收能量少的金属性强
(4)非金属性强弱的判断方法
非
金
属
性
比
较
本质 原子越易得电子,非金属性越强
判
断
方
法
1. 与 H2 化合越易,气态氢化物越稳定,非金属性越强
2. 单质氧化性越强,阴离子还原性越弱,非金属性越强(电解中在阳极
上得电子的先后 )
3. 最高价氧化物的水化物酸性越强,非金属性越强
4. A n-+B Bm-+A 则 B 比 A 非金属性强
5. 与同种还原剂反应,先反应的非金属性强
6. 得到相同数目的电子,放出能量多的非金属性强
(三)共价键
1、共价键的成键本质:成键原子相互接近时,原子轨道发生重叠,自旋方向
相反的未成对电子形成共用电子对,两原子核间电子云密度增加,体系能量降
低。
2、共价键类型:
(1)σ键和π键
σ键 π键
成键方向 沿键轴方向“头碰头” 平行或“肩并肩”
电子云形状 轴对称 镜像对称
牢固程度 强度大,不易断裂 强度小,易断裂
成键判断规律 单键是σ键;双键有一个是σ键,另一个是π键;三键中一个是σ键,另
两个为π键。
(2)极性键和非极性键
非 极 性 键 极 性 键
定义 由同种元素的原子形成的共
价键,共用电子对不发生偏
移
由不同种元素的原子形成的共价
键,共用电子对发生偏移
原子吸引电子能力 相同 不同
共用电子对位置 不偏向任何一方 偏向吸引电子能力强的原子一方
成键原子的电性判
断依据
不显电性 显电性
举例 单质分子(如 H 2、Cl 2)和某
些化合物(如 Na2O2、
H2O2)中含有非极性键
气态氢化物,非金属氧化物、酸
根和氢氧根中都含有极性键
(3)配位键:一类特殊的共价键,一个原子提供空轨道,另一个原子提供
一对电子所形成的共价键。
①配位化合物:金属离子与配位体之间通过配位键形成的化合物。如: Cu
(H2O)4SO4、Cu(NH 3) 4(OH) 2、Ag(NH 3)2OH 、Fe(SCN) 3 等。
②配位化合物的组成:
3、共价键的三个键参数
概念 对分子的影响
键长 分子中两个成键原子核间距离
(米)
键长越短,化学键越强,形成的分子越
稳定
键能 对于气态双原子分子 AB,拆开
1molA-B 键所需的能量
键能越大,化学键越强,越牢固,形成
的分子越稳定
键角 键与键之间的夹角 键角决定分子空间构型
(1)键长、键能决定共价键的强弱和分子的稳定性,键角决定分子空间构
型和分子的极性。
(2)键能与反应热:反应热=生成物键能总和-反应物键能总和
(四)分子的空间构型
1、等电子原理
原子总数相同、价电子总数相同的分子具有相似的化学键特征,许多性质
是相似的,此原理称为等电子原理。
(1)等电子体的判断方法:在微粒的组成上,微粒所含原子数目相同;在
微粒的构成上,微粒所含价电子数目相同;在微粒的结构上,微粒中原子的空
间排列方式相同。(等电子的推断常用转换法,如 CO 2=CO+O=N 2+O= N 2O=
N2+ N — = N 3
—
或 SO2=O+O 2=O3=N — +O2= NO 2
—
)
(2)等电子原理的应用:利用等电子体的性质相似,空间构型相同,可运
用来预测分子空间的构型和性质。
2、价电子互斥理论:
(1)价电子互斥理论的基本要点: ABn型分子(离子)中中心原子 A 周围
的价电子对的几何构型,主要取决于价电子对数( n),价电子对尽量远离,使
它们之间斥力最小。
(2)AB n型分子价层电子对的计算方法:
①对于主族元素,中心原子价电子数 =最外层电子数,配位原子按提供的价
电子数计算,如: PCl5中
②O、S 作为配位原子时按不提供价电子计算,作中心原子时价电子数为
6;
③离子的价电子对数计算
如: NH4+: ;SO42- :
3、杂化轨道理论
(1)杂化轨道理论的基本要点:
①能量相近的原子轨道才能参与杂化。
②杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子
轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键
比原有原子轨道形成的共价键稳定。
③杂化轨道能量相同,成分相同,如:每个 sp3 杂化轨道占有 1 个 s轨道、
3 个 p 轨道。
④杂化轨道总数等于参与杂化的原子轨道数目之和。
(2)s、p 杂化轨道和简单分子几何构型的关系
杂化类型 sp sp 2 sp 3 sp 3 不等性杂化
轨道夹角 180 o 120 o 109o28′
中心原子位置 Ⅱ A,Ⅱ B Ⅲ A Ⅳ A Ⅴ A ⅥA Ⅶ A
中心原子孤对电子数 0 0 0 1 2 3
分子几何构型 直线形 平面三角形 正四面
体形
三角锥形 V 字形 直线形
实例 BeCl 2、 Hg BF3 CH 4、 NH 3、 PH3 H2O、 HCl
Cl 2 SiCl 4 H2S
(3)杂化轨道的应用范围:杂化轨道只应用于形成σ键或者用来容纳未参
加成键的孤对电子。
(4)中心原子杂化方式的判断方法:看中心原子有没有形成双键或叁键,
如果有 1 个叁键,则其中有 2 个π键,用去了 2 个 p 轨道,形成的是 sp杂化;如
果有 1 个双键则其中有 1 个π键,形成的是 sp 2 杂化;如果全部是单键,则形成
的是 sp
3 杂化。
4、分子空间构型、中心原子杂化类型和分子极性的关系
分子(离
子)
中心原子价
电子对
杂化类型 VSEPR 模型 分子空间构型 键角 分子的极性
CO2 2 sp 直线 直线形 180 o 非
SO2 3 sp 2 平面三角 V 字形 极
H 2O、 OF2、 3 sp 3 平面三角 V 字形 —— 极
HCN 2 sp 直线 直线形 180 o 极
NH 3 4 sp 3 正四面体 三角锥形 107 o18′ 极
BF 3、 SO3 3 sp 2 平面三角 平面三角形 120 o 非
H 3O+ 4 sp 3 正四面体 三角锥形 107 o18′ ——
CH4、 CCl4 4 sp 3 正四面体 正四面体形 109o28′ 非
NH 4+ 4 sp 3 正四面体 正四面体形 109o28′ 非
HCHO、COCl 2 3 sp 2 平面三角 平面三角形 —— 极
(五)分子的性质
1、分子间作用力(范德华力和氢键)
(1)分子间作用力和化学键的比较
化学键 分子间作用力
概念 相邻原子间强烈的相互作用 分子间微弱的相互作用
范围 分子内或某些晶体内 分子间
能量 键能一般为 120~ 800kJ ·mol - 1 约几到几十 kJ ·mol - 1
性质影响 主要影响物质的化学性质(稳定性) 主要影响物质的物理性质(熔沸
点)
(2)范德华力与氢键的比较
范德华力 氢键
概念 物质分子间存在的微弱相互
作用
分子间(内)电负性较大的成键原子通过
H 原子而形成的静电作用
存在范围 分子间 分子中含有与 H 原子相结合的原子半径
小、电负性大、有孤对电子的 F、 O、N 原
子
强度比较 比化学键弱得多 比化学键弱得多,比范德华力稍强
影响因素 随分子极性和相对分子质量
的增大而增大
性质影响 随范德华力的增大,物质的
熔沸点升高、溶解度增大
分子间氢键使物质熔沸点升高硬度增大、
水中溶解度增大;分子内氢键使物质熔沸
点降低、硬度减小
2、极性分子和非极性分子
(1)极性分子和非极性分子
<1>非极性分子:从整个分子看,分子里电荷的分布是对称的。如:①只由
非极性键构成的同种元素的双原子分子: H2、Cl2、N2等;②只由极性键构成,
空间构型对称的多原子分子: CO2、CS2、BF3、CH4、CCl4 等;③极性键非极
性键都有的: CH2=CH2、CH≡CH、 。
<2>极性分子:整个分子电荷分布不对称。如:①不同元素的双原子分子
如: HCl,HF 等。②折线型分子,如 H2O、H2S等。③三角锥形分子如 NH 3
等。
(2)共价键的极性和分子极性的关系:
两者研究对象不同,键的极性研究的是原子,而分子的极性研究的是分子本
身;两者研究的方向不同,键的极性研究的是共用电子对的偏离与偏向,而分
子的极性研究的是分子中电荷分布是否均匀。非极性分子中,可能含有极性
键,也可能含有非极性键,如二氧化碳、甲烷、四氯化碳、三氟化硼等只含有
极性键,非金属单质 F2、N2、P4、S8 等只含有非极性键, C2H6、C2H4、C2H2 等
既含有极性键又含有非极性键;极性分子中,一定含有极性键,可能含有非极
性键,如 HCl、H2S、H2O2 等。
(3)分子极性的判断方法
①单原子分子:分子中不存在化学键,故没有极性分子或非极性分子之
说,如 He、Ne 等。
②双原子分子:若含极性键,就是极性分子,如 HCl 、HBr 等;若含非极性
键,就是非极性分子,如 O2、I2 等。
③以极性键结合的多原子分子,主要由分子中各键在空间的排列位置决定
分子的极性。若分子中的电荷分布均匀,即排列位置对称,则为非极性分子,
如 BF3、CH4 等。若分子中的电荷分布不均匀,即排列位置不对称,则为极性
分子,如 NH 3、SO2 等。
④根据 AB n 的中心原子 A 的最外层价电子是否全部参与形成了同样的共价
键。(或 A 是否达最高价)
(4)相似相溶原理
①相似相溶原理:极性分子易溶于极性溶剂,非极性分子易溶于非极性溶
剂。
②相似相溶原理的适用范围:“相似相溶”中“相似”指的是分子的极性相似。
③如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。相
反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。
3、有机物分子的手性和无机含氧酸的酸性
(1)手性分子
①手性分子:具有完全相同的组成和原子排列的一对分子,如同左手与右
手一样互为镜像,却在三维空间里不能重叠,互称手性异构体(又称对映异构
体、光学异构体)。含有手性异构体的分子叫做手性分子。
②手性分子的判断方法:判断一种有机物是否具有手性异构体,可以看其
含有的碳原子是否连有四个不同的原子或原子团,符合上述条件的碳原子叫做
手性碳原子。手性碳原子必须是饱和碳原子,饱和碳原子所连有的原子和原子
团必须不同。
(2)无机含氧酸分子的酸性
①酸的元数 =酸中羟基上的氢原子数,不一定等于酸中的氢原子数(有的酸
中有些氢原子不是连在氧原子上)
②含氧酸可表示为:( HO)mROn,酸的强度与酸中的非羟基氧原子数 n 有
关, n 越大,酸性越强。
n=0 弱酸 n=1 中强酸 n=2强酸 n=3 超强酸
(六)晶体的结构和性质
1、四大晶体的比较
2、典型晶体的结构特征
(1)NaCl
属于离子晶体。晶胞中每个 Na+周围吸引着 6 个 Cl -
,这些 Cl -
构成的几何图
形是正八面体,每个 Cl -
周围吸引着 6 个 Na+,Na+、Cl -
个数比为 1:1,每个
Na+与 12个 Na+等距离相邻,每个氯化钠晶胞含有 4 个 Na+和 4 个 Cl-
。
(2)CsCl
属于离子晶体。晶胞中每个 Cl—(或 Cs+)周围与之最接近且距离相等的
Cs+(或 Cl—
)共有 8 个,这几个 Cs+(或 Cl—
)在空间构成的几何构型为立方
体,在每个 Cs+周围距离相等且最近的 Cs+共有 6 个,这几个 Cs+在空间构成的
几何构型为正八面体,一个氯化铯晶胞含有 1 个 Cs+和 1 个 Cl— 。
(3)金刚石(空间网状结构)
属于原子晶体。晶体中每个 C 原子和 4 个 C 原子形成 4 个共价键 ,成为正四
面体结构, C 原子与碳碳键个数比为 1:2,最小环由 6 个 C 原子组成,每个 C
原子被 12 个最小环所共用;每个最小环含有 1/2 个 C 原子。
(4)SiO2
类型
比较 离子晶体 原子晶体 分子晶体 金属晶体
构成晶体微粒 阴、阳离子 原子 分子 金属阳离子、自由电子
形成晶体作用力 离子键 共价键 范德华力 微粒间的静电作用
物
理
性
质
熔沸点 较高 很高 低 有高、有低
硬度 硬而脆 大 小 有高、有低
导电性 不良(熔融或水溶
液中导电)
绝缘、半
导体
不良 良导体
传热性 不良 不良 不良 良
延展性 不良 不良 不良 良
溶解性 易溶于极性溶剂,
难溶于有机溶剂
不溶于任
何溶剂
极性分子易溶于
极性溶剂;非极
性分子易溶于非
极性溶剂中
一般不溶于溶剂,钠等
可
与水、醇类、酸类反应
典型实例 NaOH、NaCl 金刚石 P4、干冰、硫 钠、铝、铁
属于原子晶体。晶体中每个 Si 原子周围吸引着 4个 O 原子,每个 O 原子周
围吸引着 2 个 Si 原子, Si、O 原子个数比为 1:2,Si 原子与 Si—O 键个数比为
1:4,O 原子与 Si—O 键个数比为 1:2,最小环由 12 个原子组成。
(5)干冰
属于分子晶体。晶胞中每个 CO2 分子周围最近且等距离的 CO2有 12个。 1
个晶胞中含有 4 个 CO2。
(6)石墨
属于过渡性晶体。是分层的平面网状结构,层内 C 原子以共价键与周围的
3 个 C 原子结合,层间为范德华力。晶体中每个 C 原子被 3 个六边形共用 ,平均
每个环占有 2 个碳原子。晶体中碳原子数、碳环数和碳碳单键数之比为 2:3。
(7)金属晶体
金属 Po(钋)中金属原子堆积方式是简单立方堆积,原子的配位数为 6,
一个晶胞中含有 1 个原子。金属 Na、K、Cr、Mo(钼)、 W 等中金属原子堆
积方式是体心立方堆积,原子的配位数为 8,一个晶胞中含有 2 个原子。金属
Mg、Zn、Ti 等中金属原子堆积方式是六方堆积,原子的配位数为 12,一个晶
胞中含有 2 个原子。金属 Au 、Ag、Cu、Al 等中金属原子堆积方式是面心立方
堆积,原子的配位数为 12,一个晶胞中含有 4 个原子。
3、物质熔沸点高低的判断
(1)不同类晶体:一般情况下,原子晶体 >离子晶体 >分子晶体
(2)同种类型晶体:构成晶体质点间的作用力大,则熔沸点高,反之则
小。
①离子晶体:结构相似且化学式中各离子个数比相同的离子晶体中离子半
径小(或阴、阳离子半径之和越小的),键能越强的,熔、沸点就越高。如
NaCl、NaBr、Nal;NaCl、KCl 、RbCl 等的熔、沸点依次降低。离子所带电荷
大的熔点较高。如: MgO 熔点高于 NaCl。
②分子晶体:在组成结构均相似的分子晶体中,式量大的,分子间作用力
就大,熔点也高。如: F2、Cl2、Br2、I2 和 HCl 、HBr、HI 等均随式量增大。
熔、沸点升高。但结构相似的分子晶体,有氢键存在熔、沸点较高。
③原子晶体:在原子晶体中,只要成键原子半径小,键能大的,熔点就
高。如金刚石、金刚砂(碳化硅)、晶体硅的熔、沸点逐渐降低。
④金属晶体:在元素周期表中,主族数越大,金属原子半径越小,其熔、
沸点也就越高。如Ⅲ A 的 Al ,Ⅱ A 的 Mg,IA 的 Na,熔、沸点就依次降低。而
在同一主族中,金属原子半径越小的,其熔沸点越高。