- 2021-05-06 发布 |
- 37.5 KB |
- 31页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版氮及其重要的化合物学案
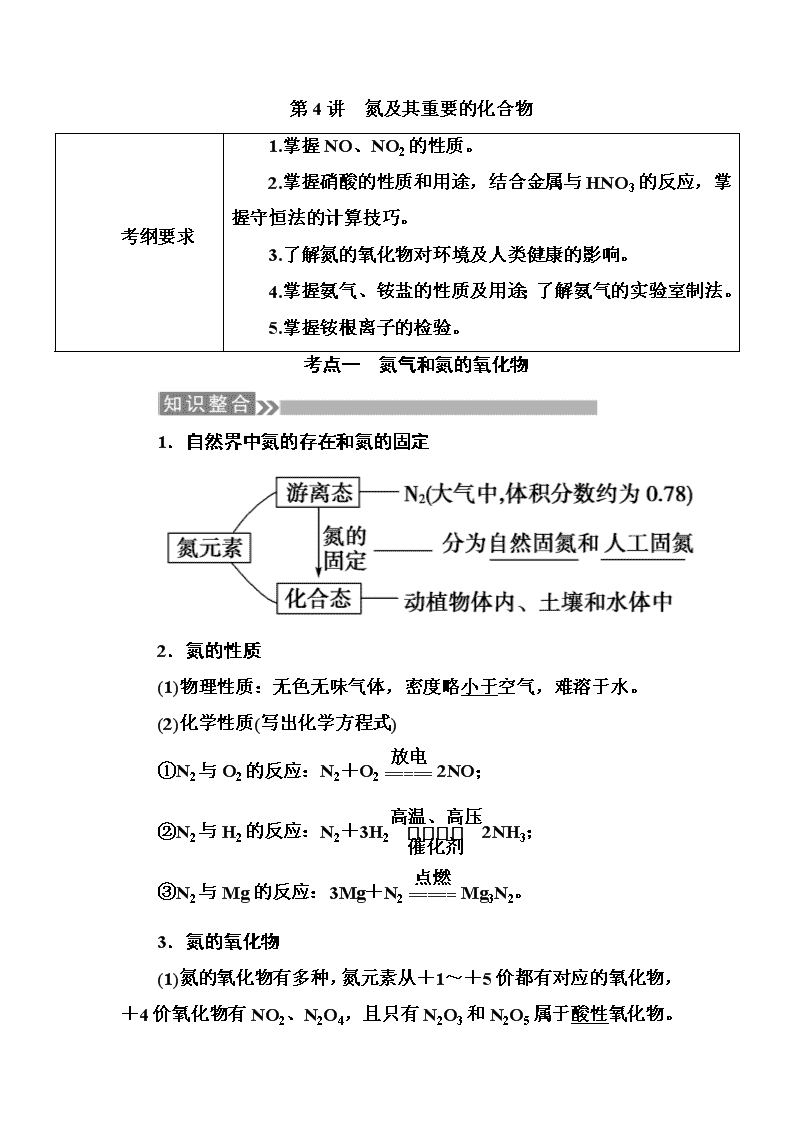
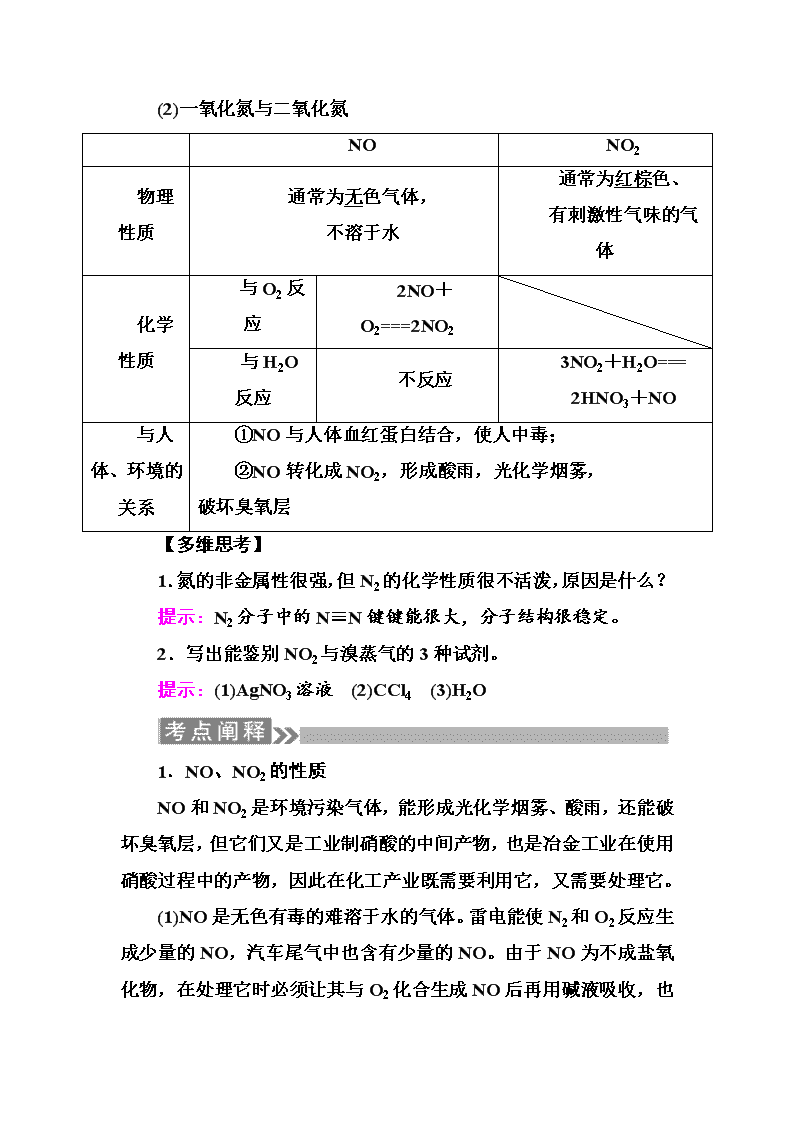
第4讲 氮及其重要的化合物 考纲要求 1.掌握NO、NO2的性质。 2.掌握硝酸的性质和用途,结合金属与HNO3的反应,掌握守恒法的计算技巧。 3.了解氮的氧化物对环境及人类健康的影响。 4.掌握氨气、铵盐的性质及用途;了解氨气的实验室制法。 5.掌握铵根离子的检验。 考点一 氮气和氮的氧化物 1.自然界中氮的存在和氮的固定 2.氮的性质 (1)物理性质:无色无味气体,密度略小于空气,难溶于水。 (2)化学性质(写出化学方程式) ①N2与O2的反应:N2+O22NO; ②N2与H2的反应:N2+3H22NH3; ③N2与Mg的反应:3Mg+N2Mg3N2。 3.氮的氧化物 (1)氮的氧化物有多种,氮元素从+1~+5价都有对应的氧化物,+4价氧化物有NO2、N2O4,且只有N2O3和N2O5属于酸性氧化物。 (2)一氧化氮与二氧化氮 NO NO2 物理性质 通常为无色气体, 不溶于水 通常为红棕色、 有刺激性气味的气体 化学性质 与O2反应 2NO+O2===2NO2 与H2O反应 不反应 3NO2+H2O=== 2HNO3+NO 与人体、环境的关系 ①NO与人体血红蛋白结合,使人中毒; ②NO转化成NO2,形成酸雨,光化学烟雾,破坏臭氧层 【多维思考】 1.氮的非金属性很强,但N2的化学性质很不活泼,原因是什么? 提示:N2分子中的N≡N键键能很大,分子结构很稳定。 2.写出能鉴别NO2与溴蒸气的3种试剂。 提示:(1)AgNO3溶液 (2)CCl4 (3)H2O 1.NO、NO2的性质 NO和NO2是环境污染气体,能形成光化学烟雾、酸雨,还能破坏臭氧层,但它们又是工业制硝酸的中间产物,也是冶金工业在使用硝酸过程中的产物,因此在化工产业既需要利用它,又需要处理它。 (1)NO是无色有毒的难溶于水的气体。雷电能使N2和O2反应生成少量的NO,汽车尾气中也含有少量的NO。由于NO为不成盐氧化物,在处理它时必须让其与O2化合生成NO 后再用碱液吸收,也可利用它的氧化性,在催化剂作用下与NH3反应使之转化为N2。 (2)NO2是红棕色的有毒气体,工业上利用它与H2O反生成HNO3,同时又生成NO,再让NO与O2反应生NO2,循环使用,直到全部转化为HNO3。 2.氮的氧化物溶于水的计算 (1)NO2或NO2与N2(非O2且不溶于水)或NO的混合气体溶于水 可依据:3NO2+H2O===2HNO3+NO,利用气体体积差值进行计算,V(NO2)=ΔV(ΔV表示体积差) (2)NO2和O2混合气体溶于水的计算 由4NO2+O2+2H2O===4HNO3可知,当体积比: ①当O2过量时, V(NO2)=ΔV,V(O2)=V总-V(NO2) ②当NO2过量时, 剩余NO的体积为V余,相当于剩余NO2体积为3V余,则V(O2)=(V总-3V余),V(NO2)=(V总-3V余)+3V余 (3)NO与O2同时通入水中 发生反应为:2NO+O2===2NO2 3NO2+H2O===2HNO3+NO 总反应方程式为:4NO+3O2+2H2O===4HNO3 当体积比: V(NO)∶V(O2) (4)NO2、NO、O2三种混合气体通入水中 ①可先将NO和O2转化为NO2,再按4NO2+O2+2H2O===4HNO3处理。 ②也可先将NO2和H2O反应转化为NO,按4NO+3O2+2H2O===4HNO3情况处理。 ③还可以利用混合气体中N、O原子个数比进行分析判断。 N(N)∶N(O) 考向一 N2的性质与应用 1.将空气中氮气转化成氮的化合物的过程称为固氮。下列能实现人工固氮的是( ) A.闪电 B.电解食盐水 C.植物根瘤菌 D.合成氨 解析:选项A、C为自然固氮,合成氨为人工固氮。 答案:D 2.下列有关氮气用途的说法不正确的是( ) A.作焊接金属的保护气 B.制硝酸和化肥的原料 C.食品袋中充氮气来防腐 D.工业上与氧气反应制NO从而制硝酸 解析:工业上一般用氨气和氧气反应来制取NO。 答案:D 考向二 NO、NO2的性质与计算 3.已知化学反应:①2NO+2CON2+2CO2,②NO2+SO2NO+SO3。下列说法正确的是( ) A.反应①可用于汽车尾气处理,NO是还原剂,CO2是氧化产物 B.反应②是非氧化还原反应,反应前后气体分子总数不变 C.反应②中,NO2的氧化性比SO2的氧化性强 D.利用上述两反应处理尾气,能达到保护环境要求 解析:反应①中N元素的化合价由+2价降为0,被还原作氧化剂,A错误;反应②中,N、S元素的化合价均发生了变化,为氧化还原反应,B错误;反应②中的产物NO、SO3均是污染物,D错误。 答案:C 4.相同条件下,等体积的NO2、NO分别与一定体积的氧气混合,恰好能被水完全吸收转化成硝酸。消耗氧气的体积比为( ) A.1∶1 B.1∶2 C.1∶3 D.3∶1 解析:根据电子守恒知,最终生成硝酸;1 mol NO2失去1 mol电子,1 mol NO失去3 mol电子,则消耗氧气的体积之比为∶=1∶3。 答案:C 【技法归纳】 NOx与O2、H2O混合的计算方法 (1)电子守恒法 n(NOx)×(5-2x)=n(O2)×4 (2)总反应式法 ①NO和O2与H2O反应,用4NO+3O2+2H2O===4HNO3计算。 ②NO2和O2与H2O反应,用4NO2+O2+2H2O===4HNO3计算。 (3)原子守恒法 4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与 N2O5+H2O===2HNO3等效。当混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。 N(N)∶N(O) 考点二 硝酸的性质和应用 1.硝酸的性质 (1)物理性质 气味 颜色 挥发性 溶解性 刺激性 无色,久置呈黄色 易挥发 与水互溶 (2)化学性质(写出离子方程式或化学方程式) ①见光分解:4HNO34NO2↑+O2↑+2H2O; ②Cu与浓硝酸的反应:Cu+4H++2NO===Cu2++2NO2↑+2H2O; ③Cu与稀硝酸的反应:3Cu+8H++2NO===3Cu2++2NO↑+4H2O; ④C与浓硝酸的反应:C+4HNO3(浓)CO2↑+4NO2↑+2H2O; ⑤Fe2+与稀硝酸的反应:3Fe2++NO+4H+===3Fe3++NO↑+2H2O。 【多维思考】 1.久置的浓硝酸呈黄色,如何除去? 提示:通入O2(或空气),使其发生反应4NO2+O2+ 2H2O===4HNO3。 2.与浓硝酸反应时,1 mol Cu或C均消耗4 mol HNO3,而反应后Cu和C的化合价为什么不同? 提示:与Cu反应时1 mol Cu被2 mol HNO3氧化(另2 mol HNO3表现酸性)失去2 mol e-,呈+2价,与C反应时HNO3只表现氧化性,1 mol C失去4 mol e-,呈+4价。 金属与硝酸的反应 1.金属与HNO3反应的一般通式 (1)金属+浓硝酸―→金属硝酸盐+NO2↑+H2O (2)金属+稀硝酸―→金属硝酸盐+NO↑+H2O 2.反应规律 (1)金属与硝酸反应一般不生成H2,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO。 (2)铁与稀硝酸反应,先生成Fe(NO3)3,若Fe过量,Fe(NO3)3再和Fe反应生成Fe(NO3)2。 (3)铜与浓HNO3反应,若Cu过量,开始时硝酸的还原产物为NO2,随着反应的进行,浓HNO3变稀,硝酸的还原产物为NO,最终应得到NO2和NO的混合气体。 3.计算方法 (1)原子守恒法 HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。 (2)电子守恒法 HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。 (3)离子方程式计算法 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒。 考向一 硝酸的酸性和强氧化性 1.下列对于硝酸的认识,不正确的是( ) A.浓硝酸的氧化性强于稀硝酸 B.铜与HNO3的反应属于置换反应 C.金属与HNO3反应不产生氢气 D.可用铁和铝制容器盛装浓硝酸 解析:硝酸是氧化性酸,且浓硝酸的氧化性强于稀硝酸;铜与浓、稀硝酸反应的还原产物分别是NO2和NO,没有单质生成,故不属于置换反应;硝酸是氧化性酸,金属与HNO3反应均不产生H2;铁与铝遇冷浓硝酸钝化,故可用铁或铝制容器盛装浓HNO3。 答案:B 2.下列有关实验操作、现象和解释或结论都正确的是( ) 选项 实验操作 现象 解释或结论 ① 过量的Fe粉中加入稀硝酸,充分反应后,滴入KSCN溶液 溶液呈红色 稀硝酸将Fe氧化为Fe3+ ② 浓硝酸久置或光照 变黄色 HNO3不稳定易分解 ③ Al箔插入稀硝酸中 无现象 Al箔表面被HNO3氧化,形成致密的氧化膜 ④ 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 试纸先变红色后褪色 浓硝酸具有酸性和强氧化性 A.①② B.③④ C.②③④ D.②④ 解析:①中过量的Fe与HNO3反应生成Fe2+,滴入KSCN溶液不呈红色;③中Al在常温下遇浓硝酸钝化,而遇稀硝酸反应。 答案:D 【题后悟道】 涉及硝酸的几个易错点 (1)认为活泼金属与稀硝酸反应会产生H2。 (2)在书写离子方程式时,忽视HNO3(或NO+H+)的强氧化性,将氧化还原反应简单地写成复分解反应。 考向二 硝酸与金属反应的计算 3.38.4 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况),反应消耗的硝酸可能是( ) A.1.0 mol B.1.6 mol C.2.2 mol D.2.4 mol 解析:浓HNO3适量,在反应过程中变稀,实际上发生了两个反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,反应消耗的HNO3 包括起酸性作用的和起氧化性作用的两部分,前者反应后以Cu(NO3)2形式存在,后者被还原后生成NO2、NO气体,从两个方程式看出:Cu+2HNO3~Cu(NO3)2,HNO3(氧化剂)~NO2(或NO),所以反应消耗的HNO3的物质的量为×2+=1.2 mol+1 mol=2.2 mol。 答案:C 4.现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4 mol·L-1,稀硝酸浓度为2 mol·L-1。取10 mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体的体积为(假设HNO3只被还原为NO)( ) A.0.224 L B.0.448 L C.0.672 L D.0.896 L 解析:铁过量生成Fe2+,则Fe与H+、NO反应的离子方程式为3Fe+8H++2NO===3Fe2++2NO↑+4H2O,生成的NO的量以NO为准来计算,结合n(NO)=0.02 mol,n(H+)=0.10 mol,故得NO 0.448 L(标准状况),又因过量的铁可以和过量的H+反应产生H2,即Fe+2H+===Fe2++H2↑,则生成的H2为0.224 L(标准状况),故气体体积共计0.672 L(标准状况)。 答案:C 【技法归纳】 (1)硝酸与金属反应的计算模型 (2)金属与硝酸反应的三个等式 ①n(HNO3)消耗=n(Mx+)×x+n(NO)+n(NO2)。 ②n(Mx+)×x=n(NO)×3+n(NO2)。 ③n(HNO3)酸性=n(Mx+)×x=n(e-)。 考点三 氨气和铵盐 1.氨气 (1)物理性质 颜色:无色,气味:刺激性气味,状态:气体,密度比空气小,易液化,极易溶于水。在常温常压下,1体积H2O能溶解700体积氨气。 (2)化学性质 ①与H2O反应——显碱性。反应的方程式为:NH3+H2ONH3·H2ONH+OH- ②与盐酸反应的化学方程式为:NH3+HCl===NH4Cl。 (3)用途:生产硝酸、化肥、纯碱等,液氨可作制冷剂。 2.铵盐 (1)物理性质:都易溶于水,无色离子晶体。 (2)化学性质 ①受热易分解 a.NH4CO3受热分解的化学方程式为:NH4HCO3NH3↑+H2O+CO2↑。 现象:有刺激性气味的气体产生,最后无固体残渣。 b.NH4Cl受热分解的化学方程式为:NH4ClNH3↑+HCl↑。 现象:产生白烟,冷却后又形成白色晶体。 ②与碱反应 a.在干态下,NH4Cl晶体与熟石灰反应的化学方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O。 b.在水溶液中,NH4Cl溶液和NaOH溶液反应的离子方程式分别为: 加热时:NH+OH-NH3↑+H2O 不加热时(稀溶液):NH+OH-===NH3·H2O。 (3)铵根离子(铵盐)的检验 取样品与碱共热,用湿润的红色石蕊试纸检验,若试纸变蓝,则证明样品与碱共热产生氨气,即样品为铵盐;或用蘸有浓盐酸或浓硝酸的玻璃棒靠近,若产生白烟,则证明样品为铵盐。 【多维思考】 1.将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,有白烟产生吗?为什么? 提示:没有,浓硫酸难挥发。 2.用浓NH4Cl溶液处理过的舞台幕布不易着火,其原因是什么? 提示:①NH4Cl分解吸收热量,降低了温度;②NH4Cl分解产生的气体隔绝了空气。 1.NH的检验方法 2.氨气的还原性 (1)催化氧化:4NH3+5O24NO+6H2O (2)被CuO氧化:2NH3+3CuO3Cu+N2+3H2O (3)被氯气氧化:2NH3+3Cl2===N2+6HCl或8NH3+3Cl2===N2+6NH4Cl (4)被氮氧化物氧化: 6NO+4NH3===5N2+6H2O 6NO2+8NH3===7N2+12H2O 考向一 氨气的主要性质及应用 1.NH3是一种重要的化工原料,可以制备一系列物质(见图) 。下列说法正确的是( ) A.NH4Cl和NaHCO3都是常用的化肥 B.NH4Cl、HNO3和Na2CO3受热时都易分解 C.NH3和NO2在一定条件下可发生氧化还原反应 D.图中所涉及的盐类物质均可以发生水解反应 解析:NaHCO3不是化肥,Na2CO3不易分解,NaCl不发生水解反应。 答案:C 2.如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( ) 选项 实验现象 解释 A 浓盐酸附近产生白烟 NH3与浓盐酸挥发的HCl气体反应产生了NH4Cl固体 B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应 C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液 D 干燥红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 NH3是一种可溶性碱 解析:B中的浓硫酸易与NH3发生反应;C中,该溶液也可能是MgCl2溶液等;D中NH3·H2O是碱,而NH3不属于碱。 答案:A 【技法归纳】 理解NH3性质应注意问题 (1)NH3是中学化学中唯一的碱性气体,可在推断题中作为解题的突破口,确定NH3的存在。 (2)氨水的成分是三分子:NH3、NH3·H2O、H2O;三离子:NH、4OH-、H+。氨水呈弱碱性。计算氨水浓度时,溶质视为NH3。 (3)NH3是非电解质,不是碱;而NH3·H2O是电解质,是碱。 (4)NH3催化氧化的产物是NO不是NO2。 考向二 喷泉实验 3.如图的装置中, 干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( ) A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O中含酚酞)/红色喷泉 C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉 解析:A中CO2难溶于NaHCO3溶液,不能形成喷泉;B中NH3极易溶于水,且溶液呈碱性,可形成红色喷泉;C中H2S与CuSO4反应生成黑色的CuS,可形成黑色喷泉;D中HCl与AgNO3反应生成白色沉淀,可形成白色喷泉。 答案:A 4.如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉现象的是( ) A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开弹簧夹 B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开弹簧夹 C.用鼓气装置从装置③的a处不断鼓入空气并打开弹簧夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开弹簧夹 解析:①中的Cl2易溶于CCl4 ,使圆底烧瓶中压强减小,使烧杯中的NaOH溶液进入烧瓶形成喷泉;②中的NO与NaOH溶液不反应,圆底烧瓶内的压强不改变,不会形成喷泉;③中因鼓入空气使锥形瓶内气压增大,使水进入烧瓶而形成喷泉;④中浓H2SO4溶于水放热,促使锥形瓶内氨水分解产生NH3,NH3进入烧瓶与HCl反应而形成喷泉。 答案:B 考点四 氨气的实验室制法 1.氨气的实验室制法 用铵盐和熟石灰制取 2.实验室制取氨气的其他方法 方法 化学方程式(或原理) 发生装置 加热浓氨水 NH3·H2ONH3↑+H2O 浓氨水+固体NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的生成 浓氨水+固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2 3.氨气实验室制法的注意事项 (1)实验室用固体铵盐与碱共热制NH3时,不能使用NH4HCO3、NH4NO3及NaOH固体,因为NH4HCO3受热分解产生CO2 ,使制得的NH3不纯;NH4NO3受热时易发生爆炸;NaOH容易吸水结块,不利于NH3的产生和逸出,且加热条件下NaOH容易腐蚀玻璃。 (2)干燥氨气时不能选用酸性干燥剂,如浓硫酸、P2O5等,也不能选用无水CaCl2,因为它们均能与NH3发生反应,通常选用碱石灰。 (3)吸收氨气(或HCl)时要注意防止倒吸。 可用于吸收氨气(或HCl)并能防倒吸的常用装置为: 【感悟测评】 判断正误(正确的打“√”,错误的打“×”) (1)实验室用NH4Cl和Ca(OH)2制备NH3并不涉及氧化还原反应 ( ) (2)实验室制备NH3时可以用固体NaOH代替Ca(OH)2( ) (3)可用P2O5干燥NH3 ( ) (4)可用排饱和食盐水法收集NH3( ) (5)(2017·高考全国卷Ⅱ,13C)加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,NH4HCO3显碱性( ) 答案:(1)√ (2)× (3)× (4)× (5)× NH3制取实验中3个方面的创新 (1)NH3制取原理的创新 实验室制取少量NH3 ,可不用铵盐和碱混合共热,而采用常温下将浓氨水滴加到固态碱性物质(如CaO、NaOH、碱石灰等)上,来制取NH3。 (2)NH3制取装置的创新 (3)NH3吸收装置的创新 考向一 实验室NH3的制取原理和装置 1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( ) A.①② B.②③ C.③④ D.①③ 解析:①中NH4Cl受热可产生NH3和HCl,但两者遇冷会重新凝结产生NH4Cl,且可能出现堵塞导管的情况;③中试管口未向下倾斜会导致水倒流入试管而使其破裂;②中将浓氨水滴入CaO中会发生:CaO+NH3·H2O===Ca(OH)2+NH3↑,反应放热可用其制取NH3;④中浓氨水受热产生NH3,通过碱石灰吸收水蒸气后得干燥的NH3,符合要求。 答案:D 2.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究。 回答下列问题: (1)若用装置①制取NH3,其反应的化学方程式为____________ _________________________________________________________; 若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是___________________ _________________________________________________________。 (2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是________,分液漏斗中装的试剂是________,收集装置应选择________(填装置序号)。 解析:(1)固体反应物制NH3的反应:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,测定NH3体积则通过NH3排开液体体积测量,选用③和⑦,③中试剂应不溶解NH3,不与NH3反应。 (2)用固—液不加热型装置制NH3,应用浓氨水和NaOH或碱石灰,排空气法收集导气管应伸入容器底部。 答案:(1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ③⑦ 氨气难溶于该溶剂,且该试剂不易挥发,不与氨气反应 (2)NaOH(或碱石灰或CaO) 浓氨水 ⑥ 考向二 氨气制备与性质综合探究 3.某研究小组要快速制取干燥的氨气,提供的药品有:浓氨水、氯化铵固体、氢氧化钠固体、蒸馏水、碱石灰,提供的仪器如下所示(必要的塞子、玻璃导管、橡胶管、固定装置和尾气处理装置略去)。 (1)需选择的药品是__________________________,该小组选择的药品混合后快速放出氨气的原因是__________________________ _________________________________________________________, 选择的仪器是________(填序号)。 (2)若用如图甲装置收集NH3,如何判断烧瓶中已收集满NH3?__________________。 (3)图乙中胶头滴管中的水挤入烧瓶后,观察到的现象是 __________________________________________________________ _________________________________________________________。 解析:(1)要快速制备NH3可选用浓氨水和NaOH固体,原因是NaOH固体溶解时放热加快NH3逸出,且c(OH-)增大,使NH3+H2ONH3·H2ONH+OH-平衡左移,有利于NH3放出。选用①③⑥或①③⑦。 (2)由于氨气易溶于水NH3+H2ONH3·H2O,呈碱性,使滴有酚酞的水变红,据此可判断。 (3)将胶头滴管中的水挤入圆底烧瓶后,由于NH3溶于水使瓶中的气压减小,气球的体积逐渐变大。 答案:(1)浓氨水、氢氧化钠固体 NaOH溶于水放热,促使氨水分解放出氨气,且c(OH-)增大,使NH3+H2ONH3·H2ONH+OH-平衡左移,有利于NH3放出 ①③⑥或①③⑦ (2)漏斗下端边沿与水面接触处溶液颜色变为浅红色 (3)气球逐渐变大 4.(2018·张家口联考) 某化学兴趣小组在实验室探究氨的有关性质,设计了如图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取。 ①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠 按上图连接好各仪器,先将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解。回答下列问题: (1)若A中制取气体时只用了一种药品,则该药品是______(填物质序号)。 (2)B装置的作用为____________________________________。 (3)D中铜片发生反应的离子方程式为____________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入少量下列物质中的________(填下列各项序号)。 A.Na2CO3 B.AgNO3 C.H2SO4 D.FeSO4 (4)图E中持续通入氧气的作用为________________________。 (5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:_____________________ _________________________________________________________。 解析:C中有铂丝网,可知为氨的催化氧化;D 中含有铜片,为验证氨的催化氧化产物及铜片与稀HNO3的反应;E、F为尾气处理装置。A中只用了一种药品,则应为NH4HCO3,受热分解产生NH3、CO2和H2O,通过Na2O2时,CO2和水蒸气被吸收,且生成O2,在C中发生氨的催化氧化反应,生成的NO和O2、H2O在D中反应生成稀HNO3,与Cu片反应生成NO,E中通入O2,使NO转化为NO2,被F中的NaOH溶液充分吸收。(3)加入少量AgNO3溶液,被Cu置换形成原电池,加快反应速率;加入稀硫酸可增大溶液中c(H+),使反应速率加快。 答案:(1)③ (2)吸收CO2和水蒸气并产生O2 (3)3Cu+8H++2NO===3Cu2++2NO↑+4H2O BC (4)使有害气体吸收更完全 (5)D装置的液体易倒流入玻璃管C中,使玻璃管破裂,可在C装置与D装置之间连接一防倒吸装置 1.(2017·高考全国卷Ⅰ,T26)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl=NH4Cl+H3BO3。 回答下列问题: (1)a的作用是________________。 (2)b中放入少量碎瓷片的目的是__________________。f的名称是________。 (3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是________________;打开k2放掉水,重复操作2~3次。 (4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。 ①d中保留少量水的目的是________________。 ②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。 解析:(1)a的作用是平衡气压,以避免b中压强过大。 (2)b中放入少量碎瓷片的目的是防止暴沸。f的名称是直形冷凝管。 (3)g中蒸馏水倒吸进入c,原因是c、e及其所连接的管道内水蒸气冷凝为水后,气压远小于外界大气压,在大气压的作用下,锥形瓶内的蒸馏水被倒吸入c中。 (4)①d中保留少量水的目的是液封,防止氨气逸出。②e中主要反应是铵盐与碱在加热条件下的反应,离子方程式为NH+OH-NH3↑+H2O;e采用中空双层玻璃瓶的作用是保温减少热量损失,有利于铵根离子转化为氨气逸出。 答案:(1)避免b中压强过大 (2)防止暴沸 直形冷凝管 (3)c中温度下降,管路中形成负压 (4)①液封,防止氨气逸出 ②NH+OH-NH3↑+H2O 保温使氨完全蒸出 2.(2017·高考北京卷,T27)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。 (1)SCR(选择性催化还原)工作原理: ①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:________________________________________________。 ②反应器中NH3还原NO2的化学方程式:____________。 ③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成: ________。 ④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol-1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用V2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。 (2)NSR(NOx储存还原)工作原理: NOx的储存和还原在不同时段交替进行,如图a所示。 ①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是________。 ②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是________。 ③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下,15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:________□15NNO+□H2O 解析:(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 ,结合原子守恒,发生反应的化学方程式为CO(NH2)2+H2O2NH3↑+CO2↑。②从图中可以看出NH3在催化剂作用下还原NO2生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式为8NH3+6NO27N2+12H2O。③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式为2SO2+O2+4NH3+2H2O===2(NH4)2SO4。④吸收NH3的硫酸的物质的量为V1×10-3 L×c1 mol·L-1-V2×10-3 L×c2 mol·L-1×=×10-3 mol,尿素的物质的量为×10-3 mol,则尿素溶液中溶质的质量分数是 ÷a g×100%=%。(2)①由图示可知BaO和NOx作用生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质是BaO。②由图示可知,第一步反应为H2与Ba(NO3)2作用生成NH3,每摩尔Ba(NO3)2作用生成NH3共转移16 mol电子,根据电子守恒,参加反应的氢气的物质的量为16 mol÷2=8 mol,则消耗的H2与Ba(NO3)2的物质的量之比是8∶1。③反应物有15NO与NH3,结合产物中有水,可知还有另一反应物O2,反应中NH3是还原剂,15NO与O2是氧化剂,因产物均为15NNO,则15NO与NH3以1∶1参加反应,结合电子守恒和原子守恒可得此反应的化学方程式为415NO+4NH3+3O2415NNO+6H2O。 答案:(1)①CO(NH2)2+H2O2NH3↑+CO2↑ ②8NH3+6NO27N2+12H2O ③2SO2+O2+4NH3+2H2O===2(NH4)2SO4 ④% (2)①BaO ②8∶1 ③415NO+4NH3+3O2415NNO+6H2O查看更多