- 2021-04-29 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
安徽省毛坦厂中学2019-2020学年高二上学期期中考试 化学(实验班)
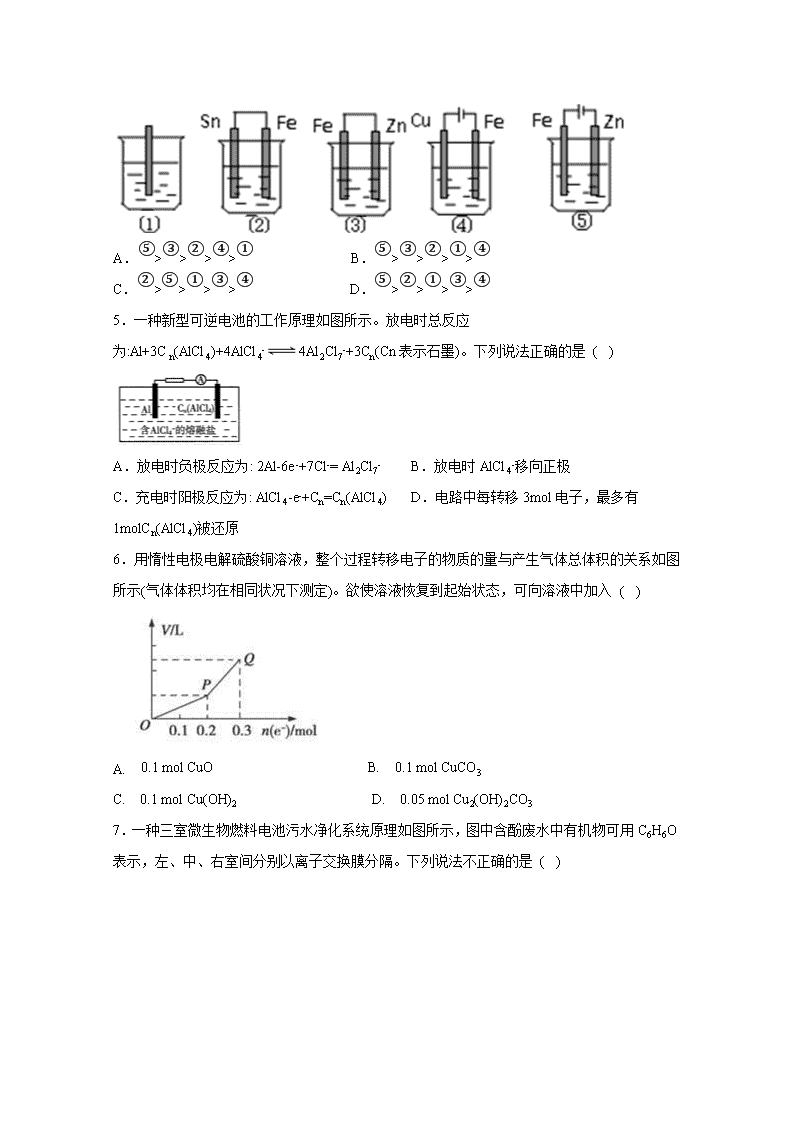
高二年级期中考试化学试题(实验班) 可能用到的相对原子质量: Li: 7 Cu: 64 Zn:65 Ag: 108 (时间:90分钟:满分:100分) 命题:储著权 审题: 第I卷(选择题) 一、单选题(每题3分,共60分) 1.25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=1.3×10-36 ;Ksp(ZnS)=1.6×10-24 。下列关于常温时的有关叙述正确的是 ( ) A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大 B.将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1 C.除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂 D.向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)、Ksp(FeS)都变大 2.t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是 ( ) A.c点可表示AgCl的不饱和溶液 B.b点的AgCl溶液加入AgNO3晶体可以变成a点 C.t℃时,AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)平衡常数K=10-4 D.t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀 3.下列有关电化学原理及应用的相关说法正确的是 ( ) A.电池是能量高效转化装置,燃料电池放电时化学能全部转化为电能 B.电热水器用牺牲阳极的阴极保护法阻止不锈钢内胆腐蚀,阳极选用铜棒 C.工业上用电解法精炼铜过程中,阳极质量减少和阴极质量增加相同 D.电解氧化法在铝制品表面形成氧化膜减缓腐蚀,铝件作为阳极 4.如下图所示的5个容器里盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( ) A.⑤>③>②>④>① B.⑤>③>②>①>④ C.②>⑤>①>③>④ D.⑤>②>①>③>④ 5.一种新型可逆电池的工作原理如图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-4Al2Cl7-+3Cn(Cn表示石墨)。下列说法正确的是 ( ) A.放电时负极反应为: 2Al-6e-+7Cl-= Al2Cl7- B.放电时AlCl4-移向正极 C.充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4) D.电路中每转移3mol电子,最多有1molCn(AlCl4)被还原 6.用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入 ( ) A. 0.1 mol CuO B. 0.1 mol CuCO3 C. 0.1 mol Cu(OH)2 D. 0.05 mol Cu2(OH)2CO3 7.一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是 ( ) A.左池的pH值降低 B.右边为阴离子交换膜 C.右池电极的反应式:2NO3﹣+10e﹣+12H+=N2↑+6H2O D.当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气 8.LED系列产品是一类新型节能产品。图甲是/燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是 ( ) A.电池总反应为: B.电池放电过程中,从B极区向A极区移动 C.电池放电过程中,B极区pH减小,A极区pH增大 D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的A极相连 9.下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是 ( ) A.正极反应为:3O2+12e-+4Al3+=2Al2O3 B.传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI C.外电路转移0.01mol电子,消耗O2的体积为0.56L D.给传感器充电时,Ag+向多孔石墨电极移动 10.大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-x FePO4LiFePO4+6C。下列说法正确的是 ( ) A.放电时Li+从左边移向右边,PO43-从右边移向左边 B.放电时,正极反应式为:Li1-xFePO4+xLi++xe-= LiFePO4 C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x- D.充电时电路中通过2.0mol电子,产生7.0gLi 11.一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是 ( ) A.甲为正极,丙为阴极 B.丁极的电极反应式为MnO42――e-===MnO4- C.KOH溶液的质量分数:c%>a%>b% D.标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区 12.关于有机物的下列叙述中,正确的是 ( ) A.它的系统名称是2,4-二甲基-4-戊烯 B.它的分子中至少有5个碳原子在同一平面上 C.它与甲基环己烷()互为同分异构体 D.该有机物与氢气完全加成后的产物的一氯取代产物共有4种 13.某烃结构式用键线式表示为,该烃与Br2加成时(物质的量之比为1︰1),所得产物有 ( ) A.3种 B.4种 C.5种 D.6种 14.某主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有同分异构体 ( ) A.2种 B.3种 C.4种 D.5种 15.已知:+,如果要合成,所用的起始原料可以是 ( ) ①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔 ③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔 A.①④ B.②③ C.①③ D.②④ 16.两种气态烃组成的混合气体完全燃烧后所得CO2和H2 O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是 ( ) ①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔(C2H2) A.②④ B.②③⑥ C.②⑥ D.①③⑤ 17.下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是 ( ) A.CH4O C3H4O5 B.C3H6 C4H6O3 C.C2H2 C6H6 D.C3H8 C4H6 18.m molC2H2与n mol H2在密闭容器中反应,当该可逆反应进行到一定程度时,生成 p molC2H4。将反应后的混合气体完全燃烧,生成CO2和H2O。所需要氧气的物质的量是 ( ) A.(3m+n)mol B.(2.5m+0.5n-3p)mol C.(3m+n+2p)mol D.(2.5m+0.5n)mol 19.以物质a为原料,制备物质d(金刚烷)的合成路线如图所示,关于以上有机物的说法正确的是 ( ) A.物质a最多有10个原子共平面 B.物质b的分子式为C10H14 C.物质c能使高锰酸钾溶液褪色 D.物质d与物质c互为同分异构体 20.三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下 下列化合物中,经过烯烃复分解反应可以生成的是 ( ) A. B. C. D. 第Ⅱ卷(填空题) 二、填空题(每空2分,共40分) 21.按要求回答下列问题。(8分) (1)立方烷 的六氯代物有_________种。 (2)甲基的电子式 ________________________。 (3)的系统命名________________________________________。 (4)下列物质的沸点按由高到低的顺序排列的是_________________________。 ①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③ (CH3)3CH ④ (CH3)2CHCH2CH3 22. (Ⅰ)在烷烃分子中的基团-CH3、-CH2-、、,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:(12分) ①下列说法正确的是_____________。 A.a的数目与b的数目的大小无关 B.c增加l,a就会增加3 C.d增加1,a就会增加2 D.b增加1,a就会增加2 ②四种基团之间的关系为:a=___________________________(用a、b、c、d表示)。 (Ⅱ)C4H4有多种同分异构体,分别具有以下特征, 试写相应同分异构体的结构简式 ① A为链状结构, 可以由两分子的乙炔加成而得,A为___________________________。 ② C 为正四面体, 每个C原子分别与另三个C 原子通过单键相连,则C为___________________________________。 (Ⅲ)烯烃与高锰酸钾酸性溶液反应的氧化产物有如下的反应关系: 已知某烯烃的化学式为C5H10,它与高锰酸钾酸性溶液反应后得到的产物若为乙酸和丙酸,则此烯烃的结构简式是_____________________________________;若为二氧化碳和丁酮(),则此烯烃的结构简式是____________________________________________。 23.某兴趣小组的同学用图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转。(10分) 请回答下列问题: (1)通入 CH3OH 电极的电极反应:______________________________________________________________。 (2)乙池中 A(石墨)电极的名称为_________________(填“正极”、“负极”或“阴极”、“阳极”),总化学反应式为____________________________________________________。 (3)当乙池中 B 极质量增加 5.40g 时,甲池中理论上消耗 O2 的体积为____________mL(标准状况)。若丙池中KCl溶液的体积是500 mL,电解后,溶液的pH为_____________(设电解前后溶液体积无变化)。 24.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:(10分) 溶解度/(g/100g水) 化合物 Zn(OH)2 Fe(OH)2 Fe(OH)3 Ksp近似值 10-17 10-17 10-39 回答下列问题: (1)该电池的正极反应式为 __________________________________________________。 (2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol) (3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为___________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 。 参考答案 一、单选题(每题3分,共60分) 1- 5. C D D D C 6- 10. D B D B B 11-15. C C C A A 16-20. A A D D A 二、填空题(每空2分,共40分) 21. (1) 3 (2) (3) 4-甲基-2-乙基-1-戊烯 (4) ②④①③ 22. (Ⅰ) ① AC ② 2+c+2d (Ⅱ) ① CH≡C—CH=CH2 ② (Ⅲ) CH3CH=CHCH2CH3 CH2=C(CH3)CH2CH3 23. (1) CH3OH﹣6e-+8OH-═CO32-+6H2O (2) 阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3 (3) 280 13 22. (1) MnO2+e—+H+=MnOOH (2)0.05 (3) 2.7 6 Zn2+和Fe2+分离不开查看更多