- 2021-04-29 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版发展中的化学电源学案
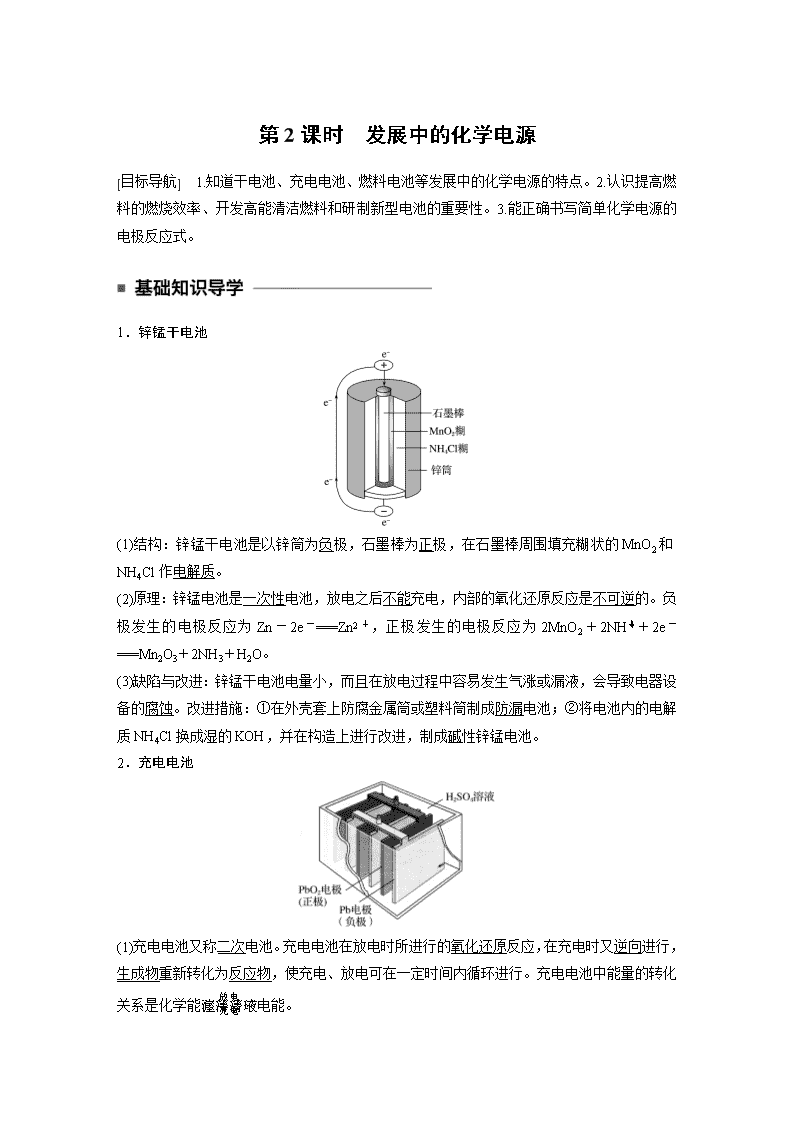
第2课时 发展中的化学电源 [目标导航] 1.知道干电池、充电电池、燃料电池等发展中的化学电源的特点。2.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。3.能正确书写简单化学电源的电极反应式。 1.锌锰干电池 (1)结构:锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质。 (2)原理:锌锰电池是一次性电池,放电之后不能充电,内部的氧化还原反应是不可逆的。负极发生的电极反应为Zn-2e-===Zn2+,正极发生的电极反应为2MnO2+2NH+2e-===Mn2O3+2NH3+H2O。 (3)缺陷与改进:锌锰干电池电量小,而且在放电过程中容易发生气涨或漏液,会导致电器设备的腐蚀。改进措施:①在外壳套上防腐金属筒或塑料筒制成防漏电池;②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池。 2.充电电池 (1)充电电池又称二次电池。充电电池在放电时所进行的氧化还原反应,在充电时又逆向进行,生成物重新转化为反应物,使充电、放电可在一定时间内循环进行。充电电池中能量的转化关系是化学能电能。 (2)常见的充电电池 ①铅蓄电池 负极是Pb,正极是PbO2,电解质溶液是硫酸溶液,常作汽车电瓶,电压稳定,使用方便安全。 ②镍镉电池 以Cd为负极,NiO(OH)为正极,以KOH为电解质,寿命比铅蓄电池长,但镉是致癌物质,废弃镍镉电池如不回收,会严重污染环境。 ③碱金属中的Li是最轻的金属,活泼性极强,是制造电池的理想物质。锂离子电池是新一代可充电的绿色电池。 3.燃料电池 (1)燃料电池是通过燃料与氧化剂分别在两个电极上发生氧化还原反应,将化学能直接转化为电能的装置。 (2)燃料电池与火力发电相比,其燃料的利用率高、能量转化率高。与干电池或者蓄电池的主要差别在于反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂等。 (3)以30%的KOH溶液为电解质溶液的氢氧燃料电池的电极反应如下: 负极:2H2+4OH--4e-===4H2O(氧化反应); 正极:O2+2H2O+4e-===4OH-(还原反应); 总反应:2H2+O2===2H2O。 议一议 判断正误,正确的打“√”,错误的打“×” (1)锌锰干电池工作一段时间后碳棒变细( ) (2)氢氧燃料电池是将热能直接转变为电能( ) (3)氢氧燃料电池工作时氢气在负极上被氧化( ) (4)太阳能电池的主要材料是高纯度的二氧化硅( ) 答案 (1)× (2)× (3)√ (4)× 一、原电池电极反应式的书写 例1 锂电池是一代新型高能电池,它以质量轻、能量高而受到普遍重视,目前已成功研制多种锂电池。某种锂电池的总反应为Li+MnO2===LiMnO2,下列说法正确的是( ) A.Li是正极,电极反应为Li-e-===Li+ B.Li是负极,电极反应为Li-e-===Li+ C.MnO2是负极,电极反应为MnO2+e-===MnO D.Li是负极,电极反应为Li-2e-===Li2+ 解析 根据原电池中,负极发生氧化反应,正极发生还原反应,再结合总反应可知,Li失去电子生成Li+被氧化,为负极;MnO2得到电子被还原,为正极。 答案 B 归纳总结 1.电极反应方程式的书写方法 (1)负极反应式的书写 ①活泼金属作负极(电极材料本身反应) 生成的阳离子与电解质溶液不反应时:M-ne-===Mn+。 若生成的阳离子与电解质溶液反应,应将“金属失电子的反应式”与“阳离子和电解质溶液反应的反应式”叠加写出。 ②燃料电池(电极材料本身不反应) H2—O2(H2SO4)燃料电池负极反应式: H2-2e-===2H+。 H2—O2(KOH)燃料电池负极反应式: H2-2e-+2OH-===2H2O⇒H2-2e-===2H+;2H++2OH-===2H2O。 (2)正极反应式的书写 ①首先判断在正极反应的物质 当负极材料与电解质溶液能反应时,在正极上发生电极反应的物质是电解液中的某种粒子。 当负极材料与电解质溶液不反应时,在正极上发生电极反应的是溶解在电解液中的O2。 燃料电池中正极反应的物质是作氧化剂的物质。 ②根据具体情况书写正极反应式(也要考虑是否与电解液反应) H2—O2(H2SO4)的正极反应式:O2+4e-+4H+===2H2O。 H2—O2(KOH)的正极反应式:O2+4e-+2H2O===4OH-。 2.书写原电池电极反应式时注意的问题 (1)正确判断原电池的负极和正极,确定两极上分别发生的具体反应。 (2)确认电极得失电子后的产物是否与电解质溶液发生反应,若能反应,则应写与电解质溶液反应后的电极反应式。 (3)在正极上,若是电解质溶液中的某种离子被还原,提供该离子的电解质无论电离难易如何,一律写离子符号(而在原电池反应中,要遵循离子方程式的书写规则,只有易溶的强电解质用离子符号表示)。 变式训练1 可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是( ) A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为O2+2H2O+4e-===4OH- B.以NaOH溶液为电解质溶液时,负极反应为Al+3OH--3e-===Al(OH)3↓ C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的碱性保持不变 D.电池工作时,电子通过外电路从正极流向负极 答案 A 解析 当电解质溶液显碱性或中性时,该燃料电池的正极发生的反应均为O2+2H2O+4e-===4OH-,A项是正确的;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为Al+4OH--3e-===AlO+2H2O,B项是错误的;该电池在碱性条件下工作时,消耗了碱,反应的化学方程式为4Al+3O2+4OH-===4AlO+2H2O,溶液的碱性减弱,C项是错误的;电池工作时,电子从负极流出来经过外电路流向正极,D项是错误的。 二、燃料电池 例2 燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( ) A.负极反应式:O2+2H2O+4e-===4OH- B.负极反应式:CH4+8OH--8e-===CO2+6H2O C.随着放电的进行,溶液的氢氧根浓度不变 D.放电时溶液中的阴离子向负极移动 解析 O2+2H2O+4e-===4OH-应为正极反应式。燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根。所以负极反应式为CH4+10OH--8e-===CO+7H2O。由于部分碱液和二氧化碳反应,所以溶液的c(OH-)将减小。 答案 D 归纳总结 常见的燃料电池 常见的燃料电池有氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。燃料电池的正极反应物一般为氧气。电解质不同,电极反应就不同,如氢氧燃料电池以强碱溶液为电解质,其放电原理为 负极(H2)反应式:2H2-4e-+4OH-===4H2O(氧化反应) 正极(O2)反应式:O2+2H2O+4e-===4OH-(还原反应) 电池总反应式:2H2+O2===2H2O 氢氧燃料电池以酸为电解质,其放电原理为 负极(H2)反应式:2H2-4e-===4H+(氧化反应) 正极(O2)反应式:O2+4H++4e-===2H2O(还原反应) 电池总反应式:2H2+O2===2H2O 变式训练2 燃料电池是目前电池研究的热点之一。 现有某课外小组自制的氢氧燃料电池,如图所示a、b均为惰性电极。下列叙述不正确的是( ) A.a极是负极,该电极上发生氧化反应 B.b极反应是O2+4OH--4e-===2H2O C.总反应的化学方程式为2H2+O2===2H2O D.氢氧燃料电池是一种具有应用前景的绿色电源 答案 B 解析 a极通H2为负极,电极反应式为2H2+4OH--4e-===4H2O发生氧化反应,A正确;b极通O2为正极,电极反应式为O2+2H2O+4e-===4OH-,B不正确;正负极电极反应式相加得总反应为2H2+O2===2H2O,C正确;氢氧燃料电池的能量高,且产物为水,对环境无污染,故是具有应用前景的绿色电源,D正确。 1.对化学电源的叙述正确的是( ) A.化学电源比火力发电对化学能的利用率高 B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位 C.化学电源均是安全、无污染的 D.化学电源即为可充电电池 答案 A 解析 由于是化学能与电能的直接转化,节省了许多中间环节,所以化学电源对化学能的利用率比火力发电高得多,但火力发电仍居世界耗电量的首位;化学电源一般较安全,但含重金属的电源如果随意丢弃,将会给环境带来严重的污染;有些化学电源是可充电电源(如镍镉电池),有些是不可充电的(如干电池)。 2.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是( ) A.把锌皮取下洗净用于实验室制取氢气 B.碳棒取出洗净用作电极 C.把铜帽取下洗净回收利用 D.电池内部填有NH4Cl等化学物质,将废电池中的黑色糊状物作化肥施用 答案 D 解析 虽然氯化铵是一种化学肥料,但电池内部还有其他有害物质,如果用作化肥,会污染土壤,进入生物链后,影响人体健康。 3.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁-空气燃料电池,镁-海水燃料电池,镁-过氧化氢燃料电池,镁-次氯酸盐燃料电池。如图为镁-次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( ) A.放电过程中OH-移向正极 B.电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl- C.镁电池中镁均为负极,发生氧化反应 D.镁—过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-===2H2O 答案 A 解析 根据图像判断反应过程,判断正、负极,正确书写电极反应式。镁燃料电池,镁作负极失电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,碱性溶液生成Mg(OH)2。ClO-在正极反应,由图可知有Cl-和OH-生成,OH-向负极移动,生成Mg(OH)2。 4.汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下: PbO2+Pb+2H2SO4===2PbSO4+2H2O 根据此反应判断下列叙述中正确的是( ) A.PbO2是电池的负极 B.Pb是电池的负极 C.PbO2得电子,被氧化 D.电池放电时,溶液酸性增强 答案 B 解析 根据电池反应知放电过程中铅失去电子,因此它是原电池的负极,其电极反应式为Pb+SO-2e-===PbSO4,B正确;PbO2在放电过程中得到电子被还原,所以它是原电池的正极,A、C错误;由于原电池放电的过程中消耗硫酸,所以溶液的酸性减弱,D错误。 5.(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为 3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题: ①高铁电池的负极材料是________。 ②放电时,正极发生________(填“氧化”或“还原”)反应;已知负极反应为Zn-2e-+2OH-===Zn(OH)2,则正极反应为_____________________________。 ③放电时,________(填“正”或“负”)极附近溶液的碱性增强。 (2)某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。 ①使用时,空气从________(填“A”或“B”)口通入。 ②假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为 _______________________________________________。 答案 (1)①Zn ②还原 FeO+3e-+4H2O===Fe(OH)3+5OH- ③正 (2)①B ②CH3OH-6e-+8OH-===CO+6H2O 解析 (1)高铁电池放电时为原电池,负极发生氧化反应,正极发生还原反应。总反应式减去负极反应式得正极反应式,正极生成OH-,故此极附近溶液碱性增强。(2)由电子流动方向可知a为负极,b为正极,空气应从B口通入,容易写出总反应式和正极反应式,两者相减得出负极反应式。 [基础过关] 题组1 电池及电极判断 1.下列说法正确的是( ) A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池 B.燃料电池是一种高效但是会污染环境的新型电池 C.化学电池的反应基础是氧化还原反应 D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2 答案 C 解析 碱性锌锰干电池是一次电池,燃料电池是一种高效且不会污染环境的新型电池,铅蓄电池放电的时候正极材料是PbO2,负极材料是Pb。 2.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg===Mg2++ 2Ag+2Cl- 。有关该电池的说法正确的是( ) A.Mg为电池的正极 B.负极反应为AgCl+e-===Ag+Cl- C.不能被KCl溶液激活 D.可用于海上应急照明供电 答案 D 解析 由电池反应方程式看出,Mg是还原剂、AgCl是氧化剂,Mg作负极,A错误; Mg作负极,其电极反应式为Mg-2e-===Mg2+,B错误;因为该电池能被海水激活,故KCl溶液也可以激活电池,C错误;电池是一种能被海水激活的一次性贮备电池,电池工作时将化学能转化为电能,电能的产生可用于海上应急照明供电,D正确。 3.据报道,锌电池可能将会取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解质溶液和空气。则下列叙述正确的是( ) A.锌为正极,空气进入负极反应 B.负极反应为Zn+2OH--2e-===ZnO+H2O C.正极发生氧化反应 D.电解质溶液为强酸 答案 B 解析 Zn与O2反应的电子转移情况为-2===2ZnO,所以Zn作负极,负极发生氧化反应,Zn+2OH--2e-===ZnO+H2O。O2是正极反应物,发生还原反应。若电解质溶液是强酸,电池的化学反应不是2Zn+O2===2ZnO,而是Zn+2H+===Zn2++H2↑。 4.已知空气—锌电池的电极反应为 锌片:Zn+2OH--2e-===ZnO+H2O; 碳棒:O2+H2O+2e-===2OH-, 据此判断,锌片是( ) A.正极并被还原 B.正极并被氧化 C.负极并被还原 D.负极并被氧化 答案 D 解析 Zn失电子作负极,被氧化。 题组2 各种燃料电池的突破 5.下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( ) A.氢氧燃料电池中OH-向b极移动 B.该装置中只涉及两种形式的能量转化 C.电池正极电极反应式为O2+2H2O+4e-===4OH- D.P-型半导体连接电池负极 答案 C 解析 由电子流向可知a为负极,b为正极,氢氧燃料电池中OH-移向负极,即向a极移动,A错误;该装置中涉及的能量转化形式有:化学能转化为电能,电能转化为光能和热能,B错误;b处通入氧气,b为电池正极,发生还原反应,电极反应为O2+4e-+2H2O===4OH-,C正确;P—型半导体连接电池正极,D错误。 6.下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( ) A.该电池的负极反应式为CH3CH2OH+3H2O-12e-===2CO2↑+12H+ B.该电池的正极反应式为O2+4e-+4H+===2H2O C.电流由O2所在的铂电极经外电路流向另一电极 D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 答案 A 解析 本题的关键是读图。由图示可知,呼气时进去的是CH3CH2OH出来的是CH3COOH,负极的电极反应式为CH3CH2OH-4e-+H2O===CH3COOH+4H+,A错误;氧气由正极通入,酸性条件下生成H2O,B正确;电流由正极流向负极,C正确;酒精含量高,转移的电子数多,电流大,D正确。 7.飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2===2H2O,负极反应为H2+CO-2e-===CO2↑+H2O ,则下列推断正确的是( ) A.电池工作时,CO向负极移动 B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极 C.正极的电极反应式为4OH--2e-===O2↑+2H2O D.通氧气的电极为正极,发生氧化反应 答案 A 解析 原电池放电时,电子由负极经外电路流向正极,B错误;正极反应为O2+4e-+2H2O===4OH-,C错误;通氧气一极为正极,发生还原反应,D错误。 8.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( ) A.有O2放电的a极为电池的负极 B.O2-移向电池的正极 C.b极对应的电极反应为2H2-4e-+2O2-===2H2O D.a极对应的电极反应为O2+2H2O+4e-===4OH- 答案 C 解析 在燃料电池中,有O2放电的a极为原电池的正极,A错误;在燃料电池中,O2-移向电池的负极,B错误;在燃料电池中,有H2放电的b极为电池的负极,电极反应为2H2-4e-+2O2-===2H2O,C错误;a极是正极,氧气在正极得电子,则对应的电极反应为O2+4e-===2O2-,D错误。 题组3 有关电池的计算 9.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应: 负极:Pb+SO-2e-===PbSO4 正极:PbO2+4H++SO+2e-===PbSO4+2H2O 今欲制得Cl2 0.050 mol, 这时电池内消耗的H2SO4的物质的量至少是( ) A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol 答案 C 解析 要求得硫酸的量,需首先找出铅蓄电池的总反应。将上述两个电极反应合并可得:Pb+PbO2+2H2SO4===2PbSO4+2H2O。而在制取Cl2时,每生成1 mol Cl2,电子转移2 mol ,现需要转移电子0.050 mol×2=0.100 mol。由铅蓄电池总反应可知,每转移0.100 mol电子,将消耗0.100 mol硫酸。 [能力提升] 10.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,______________。 欲除去Cu2+,最好选用下列试剂中的________(填字母)。 A.NaOH B.Zn C.Fe D.NH3·H2O 答案 (1)Zn(或锌) 正极 (2)锌与还原出的铜形成铜锌原电池而加快锌的腐蚀 B 解析 (1)负极是失电子的一极,Zn失电子由负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+置换为单质而除去。 11.如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题: (1)酸式电池的电极反应:负极_________________________________________, 正极________________;电池总反应:_________________________________; 电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。 (2)碱式电池的电极反应:负极_________________________________________, 正极__________________;电池总反应:_______________________________; 电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。 答案 (1)2H2-4e-===4H+ O2+4e-+4H+===2H2O 2H2+O2===2H2O 变大 (2)2H2-4e-+4OH-===4H2O O2+4e-+2H2O===4OH- 2H2+O2===2H2O 变小 解析 (1)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O;负极上,H2失电子变为H+,H+进入电解质溶液。电池总反应为H2和O2生成H2O的反应,由于有H2O生成,溶液将逐渐变稀,故pH增大。 (2)正极上,O2得电子变为O2-,溶液中O2-不能单独存在,碱性条件下与H2O分子结合生成OH-;负极上,H2失去电子变为H+,碱性条件下H+不能大量存在,与OH-结合生成水。电池总反应也是H2和O2生成水的反应。同样,由于有水生成,c(OH-)变小,pH变小。 [拓展探究] 12.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。 请回答下列问题: (1)电池的负极材料为____________,发生的电极反应为________________________。 (2)电池正极发生的电极反应为_________________________________________ ________________________________________________________________________。 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是_________________________________________ ________________________________________________________________________, 反应的化学方程式为__________________________________________ ________________________________________________________________________。 (4)组装该电池必须在无水、无氧的条件下进行,原因是 ________________________________________________________________________ ________________________________________________________________________。 答案 (1)Li Li-e-===Li+ (2)2SOCl2+4e-===4Cl-+S+SO2↑ (3)出现白雾,有刺激性气味的气体生成 SOCl2+ H2O===SO2 ↑+ 2HCl↑ (4)因为构成电池的主要成分Li能和氧气、水反应,且SOCl2也与水反应 解析 分析反应的化合价变化,可得Li为还原剂 ,SOCl2为氧化剂。 (1)负极材料为Li(还原剂),发生反应:Li-e-===Li+。 (2)正极反应式可由总反应减去负极反应式得到:2SOCl2+4e-===4Cl-+S+SO2↑。 (3)题中给出有碱液吸收时的产物,则没有碱液而用水吸收时的产物应为SO2和HCl,所以现象应该为出现白雾和有刺激性气味的气体生成。 (4)因为构成电池的两个主要成分Li能和氧气、水反应,且SOCl2也与水反应。查看更多