- 2021-04-29 发布 |
- 37.5 KB |
- 19页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习晶胞的结构课件(19张)
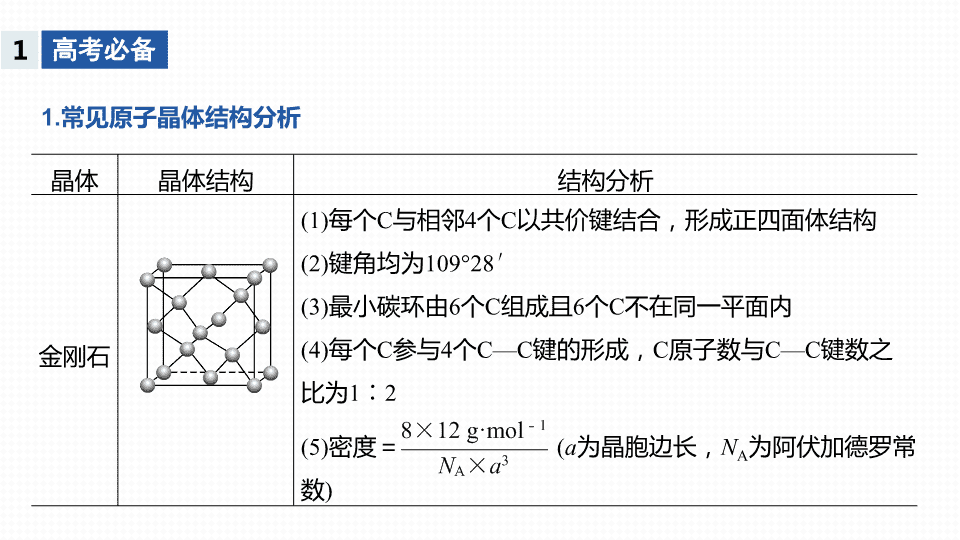
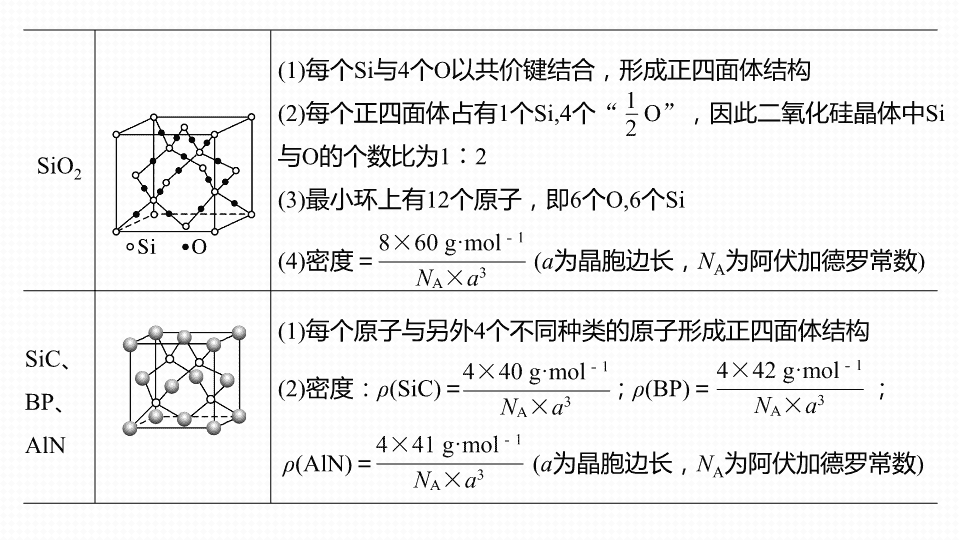
晶胞的结构 专题 四 大题 题 空逐空突破 ( 五 ) 高考必备 1 1. 常见原子晶体结构分析 晶体 晶体结构 结构分析 金刚石 (1) 每个 C 与相邻 4 个 C 以共价键结合,形成正四面体结构 (2) 键角均为 109°28 ′ (3) 最小碳环由 6 个 C 组成且 6 个 C 不在同一平面内 (4) 每个 C 参与 4 个 C—C 键的形成, C 原子数与 C—C 键数之比为 1 ∶ 2 (5) 密度= ( a 为晶胞边长, N A 为阿伏加德罗常数 ) SiO 2 (1) 每个 Si 与 4 个 O 以共价键结合,形成正四面体结构 (2) 每个正四面体占有 1 个 Si,4 个 “ O ” ,因此二氧化硅晶体中 Si 与 O 的个数比为 1 ∶ 2 (3) 最小环上有 12 个原子,即 6 个 O,6 个 Si (4) 密度= ( a 为晶胞边长, N A 为阿伏加德罗常数 ) SiC 、 BP 、 AlN (1) 每个原子与另外 4 个不同种类的原子形成正四面体结构 (2) 密度: ρ (SiC) = ; ρ (BP) = ; ρ (AlN) = ( a 为晶胞边长, N A 为阿伏加德罗常数 ) 2. 常见分子晶体结构分析 晶体 晶体结构 结构分析 干冰 (1) 每 8 个 CO 2 构成 1 个立方体且在 6 个面的面心又各有 1 个 CO 2 (2) 每个 CO 2 分子周围紧邻的 CO 2 分子有 12 个 (3) 密度= ( a 为晶胞边长, N A 为阿伏加德罗常数 ) 白磷 (1) 面心立方最密堆积 (2) 密度= ( a 为晶胞边长, N A 为阿伏加德罗常数 ) 3. 常见离子晶体结构分析 典型离子晶体模型 NaCl 型 CsCl 型 ZnS 型 CaF 2 型 晶胞 配位数及影响因素 配位数 6 8 4 F - : 4 ; Ca 2 + : 8 影响 因素 阳离子与阴离子的半径比值越大,配位数越多,另外配位数还与阴、阳离子的电荷比有关等 密度的计算 ( a 为晶胞边长, N A 为阿伏加德罗常数 ) 1. [2019· 全国卷 Ⅰ , 35(4)] 图 (a) 是 MgCu 2 的拉维斯结构, Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 Cu 。图 (b) 是沿立方格子对 角面取得的截图。可见, Cu 原子之间最短距离 x = ______pm , Mg 原子之间最短距离 y = ____pm 。设阿伏加德罗常数的值为 N A ,则 MgCu 2 的密度是 ______________g·cm - 3 ( 列出计算表达式 ) 。 真题演练 2 1 2 3 4 1 2 3 4 2. [2018· 全国卷 Ⅰ , 35(5)] Li 2 O 具有反萤石结构,晶胞如图 (b) 所示。已知晶胞参数为 0.466 5 nm ,阿伏加德罗常数的值为 N A ,则 Li 2 O 的密度为 _________________g·cm - 3 ( 列出计算式 ) 。 1 2 3 4 1 2 3 4 3. [2018· 全国卷 Ⅱ , 35(5)] FeS 2 晶体的晶胞如图 (c) 所示。晶胞边长为 a nm 、 FeS 2 相对 式量为 M 、阿伏加德罗常数的值为 N A ,其晶体密度的计算表达式为 __________g·cm - 3 ; 晶胞中 Fe 2 + 位于 所形成的正八面体的体心,该正八面体的边长为 ______nm 。 1 2 3 4 1 2 3 4 4. [2018· 全国卷 Ⅲ , 35(5)] 金属 Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为 __________________ 。六棱柱底边边长为 a cm ,高为 c cm ,阿伏加德罗常数的值 为 N A , Zn 的密度为 ________________g·cm - 3 ( 列出计算式 ) 。 1 2 3 六方最密堆积 (A 3 型 ) 4 1 2 3 4 1.Cr 和 Ca 可以形成某种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化 学式为 ________ ,若 Ca 与 O 的核间距离为 x nm ,则该晶体的密度为 ______________g·cm - 3 。 题组集训 3 CaCrO 3 1 2 3 1 2 3 2. 铜镍合金的立方晶胞结构如图所示,其中原子 A 的坐标参数为 (0,1,0) 。 (1) 原子 B 的坐标参数为 __________ 。 1 2 3 (2) 若该晶体密度为 d g·cm - 3 ,则铜镍原子间最短距离为 __________________pm 。 1 2 3 3. 奥氏体是碳溶解在 γ-Fe 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为 ____________ 。若晶体密度为 d g·cm - 3 ,则晶胞中 最近的两个碳原子的距离为 __________________pm( 阿伏加德罗常数的值用 N A 表示,写出简化后的计算式即可 ) 。 FeC( 或 Fe 4 C 4 ) 1 2 3 1 2 3查看更多